Похожие презентации:
Хімічний зв’язок і будова речовини. Тема 4. 8 клас
1.
8 клас. Тема 4.Хімічний зв’язок
і будова речовини
Беркета Наталія Михайлівна,
вчитель хімії Уманської
загальноосвітньої школи
І - ІІІ ступенів № 14
1
21.10.2022
2. Учень повинен вміти:
наводити приклади сполук із ковалентним та йоннимхімічним зв’язком;
визначати вид хімічного зв'язку в типових випадках,
ступені окиснення атомів елементів у сполуках за їх
формулами;
складати бінарні формули речовин за ступенями окиснення
атомів елементів;
використовувати
поняття
електронегативності
при
складанні хімічних формул;
пояснювати утворення йонного, ковалентного неполярного,
ковалентного полярного зв’язків;
характеризувати особливості ковалентного та йонного
зв’язків;
обґрунтовувати електронну природу хімічних зв’язків;
прогнозувати властивості речовин залежно від виду
2
хімічного зв’язку і типу кристалічної ґратки.
21.10.2022
3. Вступ
Як розвивалось вчення про хімічний зв’язок?Чому і як сполучаються атоми?
Чим зумовлене перетворення
електронейтральних атомів на заряджені
частинки – йони?
Як залежать властивості речовин від їхньої
будови?
Яких змін зазнають електронні оболонки
атомів при утворенні хімічного зв’язку?
3
21.10.2022
4. Розвиток вчення про хімічний зв’язок
XVI – XVII століттяМеханічні теорії
Корпускулярні уявлення
Збіг форм частинок
Na
CI
Р. Бойль
Хімічні процеси – операція
“ збирання – розбирання ”
4
21.10.2022
5. Динамічні концепції взаємодії речовин
XVII століттяNa
сили
притягання
CI
І. Ньютон
Причиною хімічної спорідненості є
сили притягання різної інтенсивності
5
21.10.2022
6. Електрохімічна теорія
Початок ХІХ століттяАтом – електричний диполь
-
Na
+
-
CI
+
Я. Берцелиус
Електричні сили ототожнені із тими
силами, які зумовлюють хімічні процеси і
утримують атоми в молекулах
6
21.10.2022
7. Валентність - спорідненість
Майже 200 років тому введено поняття валентностіВалентність – число хімічних зв’язків, що
атом утворює з іншими атомами
Валентність - чисельне вираження величини
спорідненості та числа хімічних зв’язків атома
Зображення структурних формул молекул .
Атоми Гідрогену – одновалентні, а Оксигену –
двовалентні:
О
Н Н
О═О
Н
Н
А. Кекулє
7
21.10.2022
8. Що являють собою хімічні зв’язки ?
1897 рікВідкриття електрона
Хімічні зв’язки мають електричну
природу і утворюються завдяки
зсуву або перенесенню електронів
від одного атома до іншого
Дж. Томсон
Для опису хімічного зв’язку сьогодні
використовують математичний апарат
квантової хімії
8
21.10.2022
9. Електронна природа зв’язку
Хімічний зв’язок утворюється за рахуноквзаємодії всіх електронів і всіх ядер
атомів, які входять до складу молекули.
Хімічний зв’язок – це взаємодія двох або кількох
атомів, у результаті якої утворюється хімічно стійка
дво- або багатоатомна система (молекула або
кристал).
Енергія утвореної системи менша за
енергію складових частин (атомів).
9
21.10.2022
10. Умови виникнення хімічного зв’язку
1916 рікПРАВИЛО ОКТЕТУ
•Атоми металічних елементів
11Na
0
- 1ē →
атом
1s22s22p63s1
11Na¹
+
йон
1s22s22p6
- 2 ē → 12Mg2+
атом
йон
12Mg
0
1s22s22p63s2
1s22s22p6
октет
октет
•Атоми неметалічних елементів
0
8О
+
2ē
атом
1s22s22p4
→
28О
йон
1s22s22p6
17СІ
0
-
1ē
атом
1s22s22p63s23р5
октет
ПРАВИЛО ДУПЛЕТУ -
→
17СІ ¹
–
Гілберт Ньютон Льюіс
йон
1s22s22p63s23р6
октет
для атомів Гідрогену
10
21.10.2022
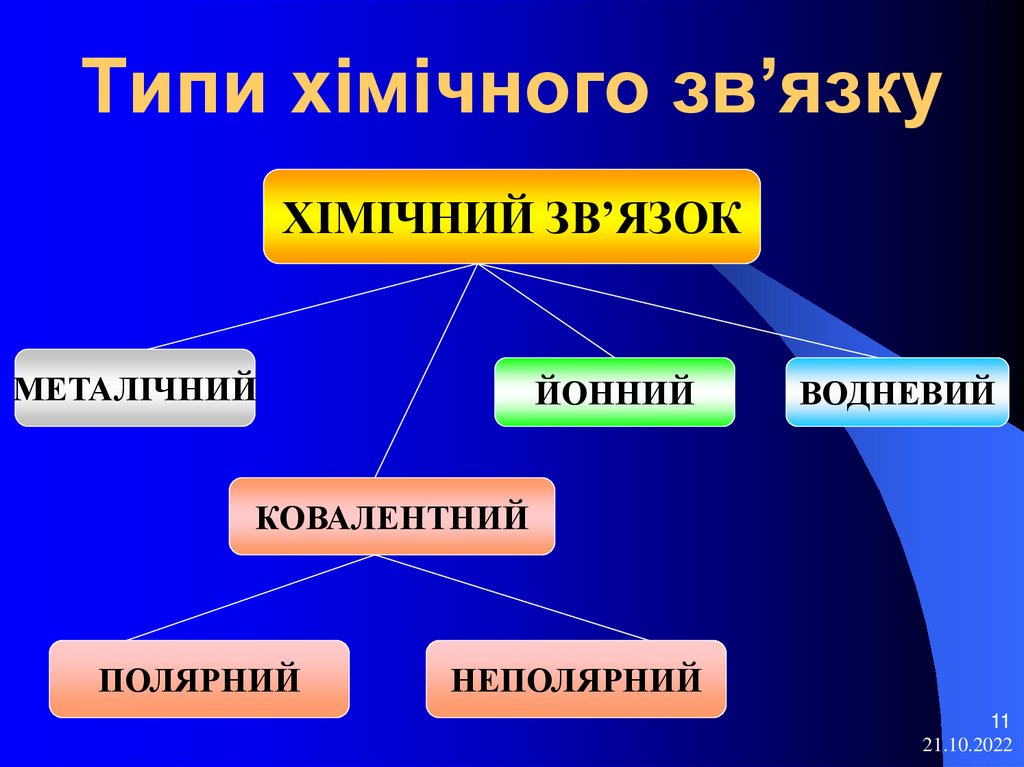
11. Типи хімічного зв’язку
ХІМІЧНИЙ ЗВ’ЯЗОКМЕТАЛІЧНИЙ
ЙОННИЙ
ВОДНЕВИЙ
КОВАЛЕНТНИЙ
ПОЛЯРНИЙ
НЕПОЛЯРНИЙ
11
21.10.2022










 Химия
Химия








