Похожие презентации:
Будова металів. Металічний зв’язок. Фізичні і хімічні властивості металів
1.
2.
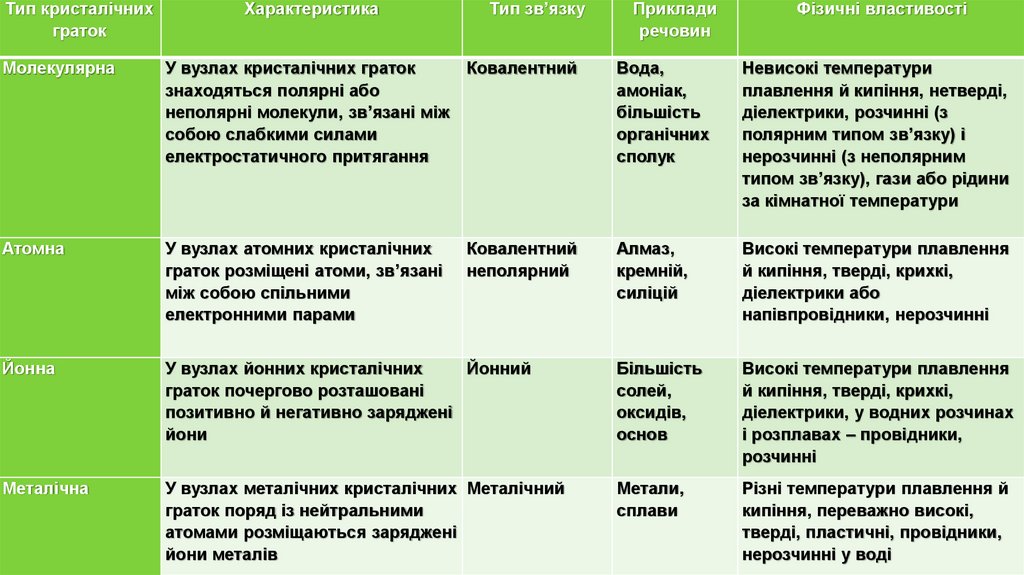
Тип кристалічнихграток
Характеристика
Тип зв’язку
Приклади
речовин
Молекулярна
У вузлах кристалічних граток
Ковалентний
знаходяться полярні або
неполярні молекули, зв’язані між
собою слабкими силами
електростатичного притягання
Вода,
амоніак,
більшість
органічних
сполук
Невисокі температури
плавлення й кипіння, нетверді,
діелектрики, розчинні (з
полярним типом зв’язку) і
нерозчинні (з неполярним
типом зв’язку), гази або рідини
за кімнатної температури
Атомна
У вузлах атомних кристалічних
граток розміщені атоми, зв’язані
між собою спільними
електронними парами
Алмаз,
кремній,
силіцій
Високі температури плавлення
й кипіння, тверді, крихкі,
діелектрики або
напівпровідники, нерозчинні
Йонна
У вузлах йонних кристалічних
Йонний
граток почергово розташовані
позитивно й негативно заряджені
йони
Більшість
солей,
оксидів,
основ
Високі температури плавлення
й кипіння, тверді, крихкі,
діелектрики, у водних розчинах
і розплавах – провідники,
розчинні
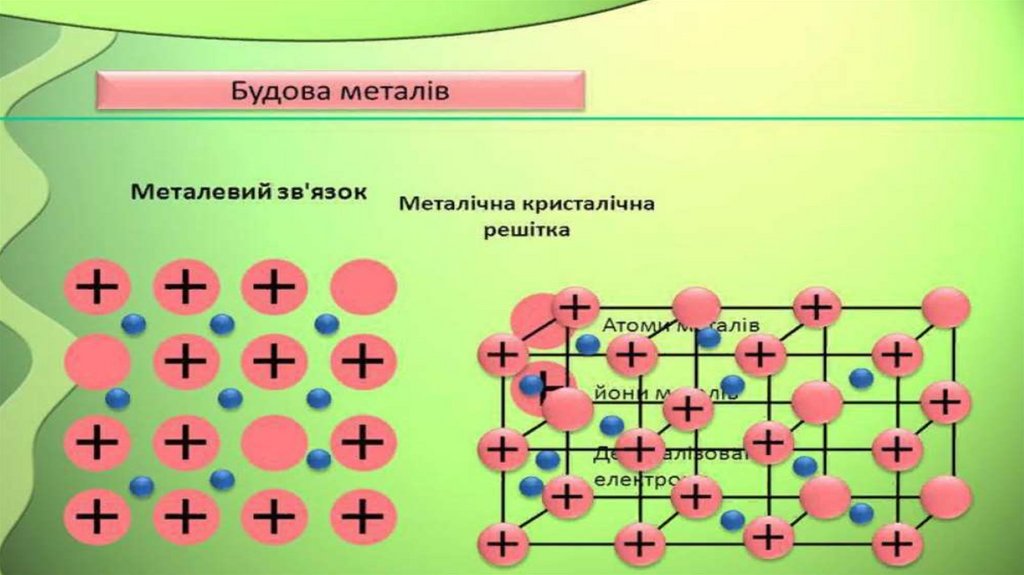
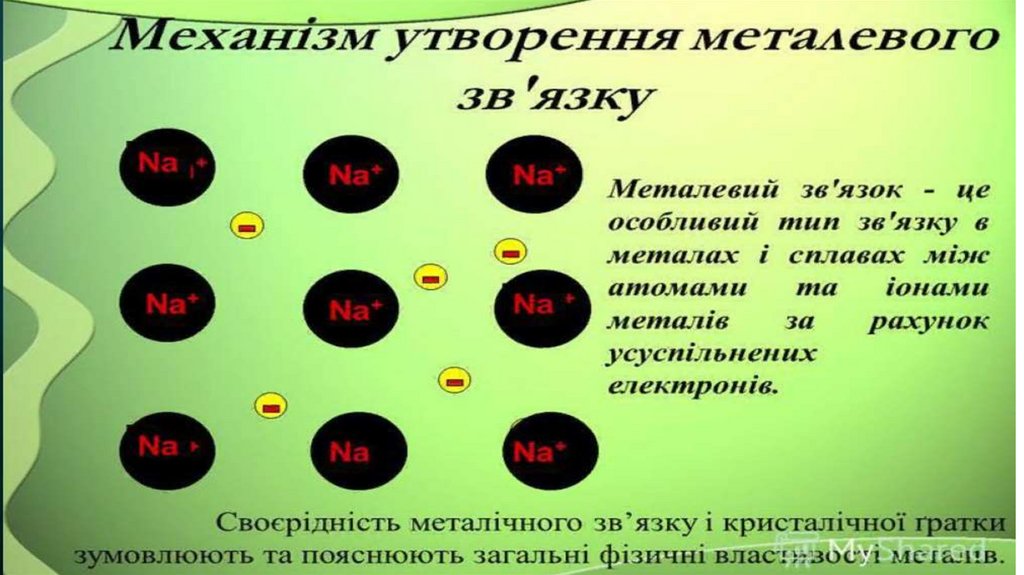
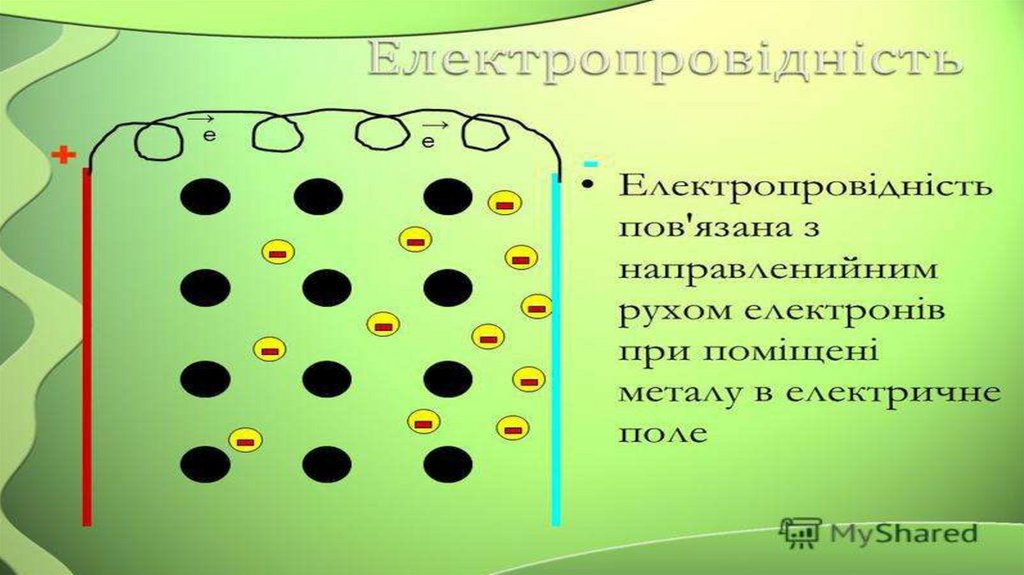
Металічна
У вузлах металічних кристалічних Металічний
граток поряд із нейтральними
атомами розміщаються заряджені
йони металів
Метали,
сплави
Різні температури плавлення й
кипіння, переважно високі,
тверді, пластичні, провідники,
нерозчинні у воді
Ковалентний
неполярний
Фізичні властивості
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
Загальні хімічнівластивості металів
14.
Серед металів традиційно виділяють декілька груп. Представники, щовходять до їх складу характеризуються відмінною від інших металів
хімічною активністю. Такими групами є:
благородні метали (срібло, золото, платина);
лужні метали (метали, утворені елементами IА
групи Періодичної системи);
лужноземельні метали (кальцій, стронцій,
барій, радій).
15.
16.
Ряд активності металів:Li, K, Ba, Ca, Na,
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
H2
Cu, Hg, Ag, Pt, Au
активні
метали середньої
неактивні
метали
ктивності
метали
1. Чим лівіше стоїть метал у цьому ряду, тим сильнішим відновником він є.
2. Кожен метал має здатність витісняти з розчинів солей ті метали, які у ряду активності
стоять після нього (правіше).
3. Метали, що знаходяться у ряду активності лівіше водню, здатні витісняти його з
розчинів кислот.
4. Лужні і лужноземельні метали у будь-яких водних розчинах взаємодіють насамперед
з водою.
17.
18.
Взаємодія з простимиречовинами-неметалами.
1. Метали взаємодіють з киснем, утворюючи оксиди.
Метал + кисень → оксид
магній
2Mg0+O02→2Mg+2O−2
магній оксид
19.
Срібло, золото іплатина з киснем не
реагують.
ПЕКТОРАЛЬ
–
нагрудна
прикраса
з
дорогоцінних металів овальної форми, що
носилася на шиї.
20.
Взаємодія з простимиречовинами-неметалами.
Метали взаємодіють з галогенами (фтором, хлором,
бромом і йодом), з утворенням галогенідів.
Метал + галоген → метал галогенід
натрій
2Na0+Cl02→2Na+Cl−1
натрій хлорид
21.
Взаємодія з простимиречовинами-неметалами.
3. Метали взаємодіють з сіркою, утворюючи сульфіди.
Метал + сірка → метал сульфід
цинк
Zn0+S0→Zn+2S−2
цинк сульфід
22.
Взаємодія зі складнимиречовинами.
1. Лужні і лужноземельні метали взаємодіють з водою
за звичайних умов, утворюючи розчинну у воді основу
(луг) і водень.
Активний метал + вода → луг + водень
натрій гідроксид
2Na+2H2O→2NaOH+H2↑
23.
Взаємодія зі складнимиречовинами.
2. Mеталли, що стоять в ряду активності металів
лівіше водню, взаємодіють з розчинами кислот,
утворюючи сіль і водень.
Метал + кислота → сіль + водень
алюміній сульфат
Li, K, Ba, Ca, Na,
2Al+3H2SO4→Al2(SO4)3+3H2↑
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
H2
Cu, Hg, Ag, Pt, Au
24.
Взаємодія зі складнимиречовинами.
3. Метали реагують з солями менш активних металів
в розчині, утворюючи сіль активнішого металу і
менш активний метал у вільному вигляді.
Активніший метал + сіль → сіль активнішого + менш активний метал
Fe+CuSO4→FeSO4+Cu
Fe+ CaSO4→FeSO4+Cа
Li, K, Ba, Ca, Na,
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
ферум (ІІ) сульфат
H2
Cu, Hg, Ag, Pt, Au
25.
Mg + N2 →Fe + AgNO3 →
Li + S →
Ca + P →
Cu + FeSO4 →
Al + S →
26.
Ba + H2O →Na + CuCl2 →
K + HCl →
Li + H2O →
Ca + NaCl →
K + H2SO4 →

















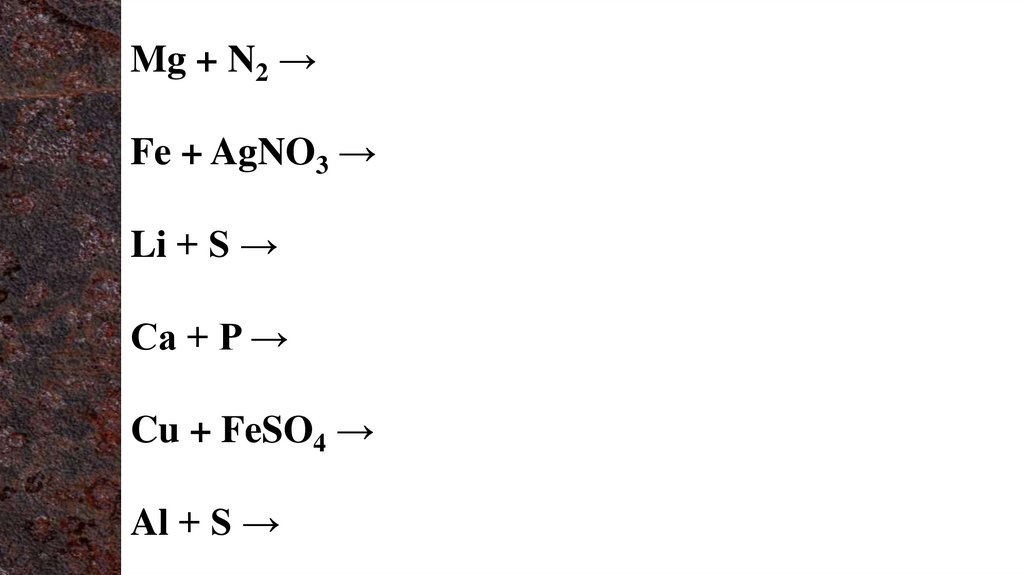

 Химия
Химия








