Похожие презентации:
Правила работы и основные методы исследований в химической лаборатории
1. Лабораторная №1
Правила работы и основныеметоды исследований в
химической лаборатории
2. Практическая часть
Правила работы в химическойлаборатории
3. Цель
• Сформировать представления оправилах и методах работы в
химической лаборатории
• Задачи
– Научиться методам безопасной работы в
лаборатории
– Научиться пользоваться оборудованием
химической лаборатории
4.
Работать в лаборатории необходимо в халате, защищая одежду и
кожу от попадания и разъедания реактивами и обсемененности
микроорганизмами.
Каждый должен работать на закрепленном за ним рабочем месте.
Переход на другое место без разрешения преподавателя не
допускается.
Рабочее место следует поддерживать в чистоте, не загромождать
его посудой и побочными вещами.
Студентам запрещается работать в лаборатории без присутствия
преподавателя или лаборанта, а также в неустановленное время
без разрешения преподавателя.
До выполнения каждой лабораторной работы можно приступить
только после получения инструктажа по технике безопасности и
разрешения преподавателя.
Приступая к работе, необходимо: осознать методику работы,
правила ее безопасного выполнения; проверить соответствие
взятых веществ тем веществам, которые указаны в методике
работы.
5.
Опыт необходимо проводить в точном соответствии с его описанием в
методических указаниях, особенно придерживаться очередности добавления
реактивов.
Для выполнения опыта пользоваться только чистой, сухой лабораторной
посудой; для отмеривания каждого реактива нужно иметь мерную посуду
(пипетки, бюретки, мензурку, мерный цилиндр или мерный стакан); не следует
выливать избыток налитого в пробирку реактива обратно в емкость, чтобы не
испортить реактив.
Если в ходе опыта требуется нагревание реакционной смеси, надо следовать
предусмотренным методическим указаниям способа нагрева: на водяной бане,
на электроплитке или на газовой горелке и др. Сильно летучие горючие
вещества опасно нагревать на открытом огне.
Пролитые на пол и стол химические вещества обезвреживают и убирают под
руководством лаборанта (преподавателя) в соответствии с правилами.
При работе в лаборатории следует соблюдать следующие требования:
выполнять работу нужно аккуратно, добросовестно, внимательно, экономно,
быть наблюдательным, рационально и правильно использовать время,
отведенное для работы.
По окончании работы следует привести в порядок свое рабочее место: помыть
посуду, протереть поверхность рабочего лабораторного стола, закрыть
водопроводные краны, выключить электрические приборы.
6.
Правила техники безопасности в лаборатории при работе с кислотами и щелочами
Кислоты и щелочи в большинстве относятся к веществам повышенного класса опасности и способны
вызвать химические ожоги и отравления. Поэтому необходимо внимательно следить за тем, чтобы
реактивы не попадали на лицо, руки и одежду.
Не ходить по лаборатории с концентрированными кислотами и щелочами, а наливать их только в
отведенном для этого месте.
Разливать концентрированную азотную, серную и соляную кислоты следует только при включенной
вентиляции в вытяжном шкафу.
Запрещается набирать кислоты и щелочи в пипетку ртом. Для этого следует применять резиновую грушу и
прочее оборудование для отбора проб.
Для приготовления растворов серной, азотной и других кислот необходимо их приливать к воде тонкой
струей при непрерывном перемешивании, а не наоборот. Приливать воду в кислоту запрещается!
Растворять твердые щелочи следует путем медленного добавления их небольшими кусочками к воде при
непрерывном перемешивании. Кусочки щелочи нужно брать только щипцами.
При смешивании веществ, которое сопровождается выделением тепла, необходимо пользоваться
термостойким толстостенной стеклянной или фарфоровой посудой.
Разлитые кислоты или щелочи необходимо немедленно засыпать песком, нейтрализовать, и только после
этого проводить уборку.
При попадании на кожу или одежду кислоты, надо смыть ее большим количеством воды, а затем 3-5%
раствором питьевой соды или разбавленным раствором аммиака.
При попадании на кожу или одежду щелочи, после смывания ее большим количеством воды, нужно
провести обработку 2-3% раствором борной, лимонной или уксусной кислотами.
Вещества, фильтры, бумагу, использованные при работе, следует выбрасывать в специальное ведро,
концентрированные растворы кислот и щелочей также сливать в специальную посуду.
7.
Правила техники безопасности в лаборатории с легковоспламеняющимися и горючими
жидкостями (ЛВЖ и ГЖ)
Все работы с ЛВЖ и ГЖ должны осуществляться в вытяжном шкафу при включенной
вентиляции, отключенных газовых проводках и электронагревательных приборов.
Запрещается нагревать на водяных банях вещества, которые могут вступать между собой в
реакцию, которая сопровождается взрывом или выделением паров и газов.
При случайном проливании ЛВЖ (сероуглерод, бензин, диэтиловый эфир и др.), а также
при потерях горючих газов необходимо немедленно отключить все источники открытого
огня, электронагревательные приборы.
Сосуды, в которых проводились работы с ЛВЖ и ГЖ, после окончания исследований
должны быть немедленно освобождены от оставшейся жидкости и промыты.
Опыты с ядовитыми веществами и веществами, которые имеют сильно выраженный запах,
можно проводить только в вытяжном шкафу.
При тушении бензина, спирта, эфира, пользоваться песком, которым следует засыпать на
вспыхнувшее пламя.
При распознавании газа по запаху, который выделяется, нюхать газ только на
определенном расстоянии, направляя его струю движением руки от сосуда к себе.
8. Теоретическая часть
9.
• Атом — это наименьшая частицахимического элемента, сохраняющая
все его химические свойства.
• Атом состоит из
– ядра, имеющего положительный
электрический заряд
– отрицательно заряженных электронов
10.
• При химических реакциях ядра атомовостаются без изменений, изменяется лишь
строение электронных оболочек вследствие
перераспределения электронов между
атомами.
• Способностью атомов отдавать или
присоединять электроны определяются его
химические свойства.
11.
• Электрон имеет двойственную (корпускулярноволновую) природу. Благодаря волновым свойствамэлектроны в атоме могут иметь только строго
определенные значения энергии, которые зависят от
расстояния до ядра.
• Электроны, обладающие близкими значениями
энергии образуют энергетический уровень. Он
содержит строго определенное число электронов максимально 2n*n.
• Энергетические уровни подразделяются на s-, p-, dи f- подуровни; их число равно номеру уровня.
12.
13.
14.
15. Квантовые числа электронов
Состояние каждого электрона в атомеобычно описывают с помощью четырех
квантовых чисел: главного (n),
орбитального (l), магнитного (m) и
спинового (s). Первые три характеризуют
движение электрона в пространстве, а
четвертое - вокруг собственной оси.
16. Главное квантовое число (n).
Главное квантовое число (n).• Определяет энергетический уровень электрона,
удаленность уровня от ядра, размер электронного
облака. Принимает целые значения (n = 1, 2, 3 ...) и
соответствует номеру периода. Из периодической
системы для любого элемента по номеру периода
можно определить число энергетических уровней
атома и какой энергетический уровень является
внешним.
• Пример.
• Элемент кадмий Cd расположен в пятом периоде,
значит n = 5. В его атоме электроны раcпределены
по пяти энергетическим уровням (n = 1, n = 2, n =
3, n = 4, n = 5); внешним будет пятый уровень (n =
5).
17. Орбитальное квантовое число (l)
Орбитальное квантовое число (l)• характеризует геометрическую форму орбитали.
Принимает значение целых чисел от 0 до (n - 1). Независимо
от номера энергетического уровня, каждому значению
орбитального квантового числа соответствует орбиталь
особой формы. Набор орбиталей с одинаковыми
значениями n называется энергетическим
уровнем, cодинаковыми n и l - подуровнем.
• Для
• l=0 s- подуровень, s- орбиталь – орбиталь сфера
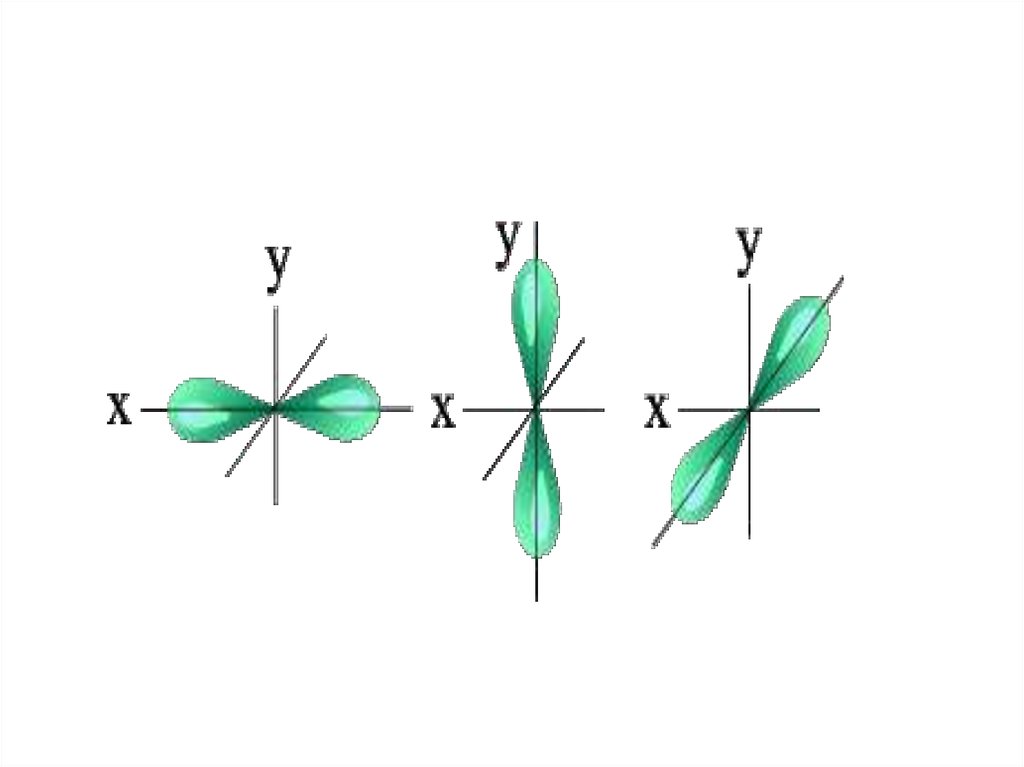
• l=1 p- подуровень, p- орбиталь – орбиталь гантель
• l=2 d- подуровень, d- орбиталь – орбиталь сложной формы
• f-подуровень, f-орбиталь – орбиталь еще более сложной
формы
18.
На первом энергетическом уровне (n = 1) орбитальное квантовое
число l принимает единственное значение l = (n - 1) = 0. Форма
обитали - сферическая; на первом энергетическом только один
подуровень - 1s. Для второго энергетического уровня (n = 2)
орбитальное квантовое число может принимать два значения: l =
0, s- орбиталь - сфера большего размера, чем на первом
энергетическом уровне; l = 1, p- орбиталь - гантель. Таким образом,
на втором энергетическом уровне имеются два подуровня - 2s и 2p.
Для третьего энергетического уровня (n = 3) орбитальное
квантовое число l принимает три значения: l = 0, s- орбиталь сфера большего размера, чем на втором энергетическом уровне; l =
1, p- орбиталь - гантель большего размера, чем на втором
энергетическом уровне; l = 2, d- орбиталь сложной формы.
Таким образом, на третьем энергетическом уровне могут быть
три энергетических подуровня - 3s, 3p и 3d.
19.
• Магнитное квантовое число (m) характеризует положениеэлектронной орбитали в пространстве и принимает
целочисленные значения от -I до +I, включая 0. Это означает,
что для каждой формы орбитали существует (2l + 1)
энергетически равноценных ориентации в пространстве.
• Для s- орбитали (l = 0) такое положение одно и
соответствует m = 0. Сфера не может иметь разные
ориентации в пространстве.
• Для p- орбитали (l = 1) - три равноценные ориентации в
пространстве (2l + 1 = 3): m = -1, 0, +1.
• Для d- орбитали (l = 2) - пять равноценных ориентаций в
пространстве (2l + 1 = 5): m = -2, -1, 0, +1, +2.
• Таким образом, на s- подуровне - одна, на p- подуровне - три,
на d- подуровне - пять, на f- подуровне - 7 орбиталей.
20. Спиновое квантовое число (s)
Спиновое квантовое число (s)• характеризует магнитный момент,
возникающий при вращении электрона
вокруг своей оси. Принимает только
два значения +1/2 и –1/2
соответствующие противоположным
направлениям вращения.
21.
Принципы заполнения орбиталей
1.
Принцип Паули. В атоме не может быть двух электронов, у
которых значения всех квантовых чисел (n, l, m, s) были бы одинаковы, т.е. на
каждой орбитали может находиться не более двух электронов
(c противоположными спинами).
2.
Правило Клечковского (принцип наименьшей энергии). В основном
состоянии каждый электрон располагается так, чтобы его энергия была
минимальной. Чем меньше сумма (n + l), тем меньше энергия орбитали. При
заданном значении (n + l) наименьшую энергию имеет орбиталь с меньшим n.
Энергия орбиталей возрастает в ряду:
1S < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s.
3.
Правило Хунда. Атом в основном состоянии должен иметь
максимально возможное число неспаренных электронов в пределах
определенного подуровня.
22.
Полная электронная формула элемента
Запись, отражающая распределение электронов в атоме химического элемента по энергетическим
уровням и подуровням, называется электронной конфигурацией этого атома. В основном
(невозбужденном) состоянии атома все электроны удовлетворяют принципу минимальной энергии.
Это значит, что сначала заполняются подуровни, для которых:
1)
Главное квантовое число n минимально;
2)
Внутри уровня сначала заполняется s- подуровень, затем p- и лишь затем d- (l минимально);
3)
Заполнение происходит так, чтобы (n + l) было минимально (правило Клечковского);
4) В пределах одного подуровня электроны располагаются таким образом, чтобы их суммарный спин
был максимален, т.е. содержал наибольшее число неспаренных электронов (правило Хунда).
5) При заполнении электронных атомных орбиталей выполняется принцип Паули. Его следствием
является, что энергетическому уровню с номером n может принадлежать не более чем
2n2 электронов, расположенных на n2 подуровнях.
23. Полная электронная формула элемента
• Пример.
• Цезий (Сs) находится в 6 периоде, его 55
электронов (порядковый номер 55) распределены по
6 энергетическим уровням и их
подуровням. Cоблюдая последовательность
заполнения электронами орбиталей получим:
• 55Cs
1s2 2s2 2p6 3s2 3p6 4s2 4p6 4d10 5s2 5p6 5d10 6s1
24.
• Углерод в органических соединениях,как правило, четырехвалентен; атомы
его способны соединяться не только с
другими атомами, но и друг с другом,
образуя цепи; последние могут
замыкаться с образованием циклов.
Это свойство углерода и явление
изомерии и обуславливают
многообразие органических веществ.
25. Состояние валентных электронов в атоме углерода
• электронная структура невозбужденногоатома углерода может быть выражена
формулой
• 1s2 2s2 2p2,
• во втором (внешнем) электронном слое у
него два спаренных (с противоположными
спинами) s- электрона и только два
неспаренных p-электрона, которые могут
участвовать в образовании ковалентных
связей.
25
26.
• углерод должен был бы проявлятьвалентность, равную двум, но в большинстве
своих соединений он четырехвалентен –
образует четыре ковалентные связи.
• Это объясняется тем, что при затрате
некоторой энергии происходит
"распаривание" 2s- электронов: один из них
переводится на свободную орбиту подуровня
2p, и атом переходит в возбужденное
состояние
26
27.
• у атома углерода, участвующего вобразовании четырех ковалентных
связей, во внешнем электронном слое,
четыре валентных электрона.
• Состояние их не одинаково. Один из
них (s- электрон), двигаясь вокруг ядра
образует шаровое облако, подобное
облаку электрона в атоме
водорода (s-состояние электрона).
27
28.
• Облака трех других электронов (pэлектроны) имеют форму объемныхвосьмерок (гантелей) с "перетяжкой" в
области ядра и ориентированных в трех
взаимно перпендикулярных
направлениях (p- состояния электрона)
28
29.
2930. Химическая связь (Вопросы для самоподготовки)
1. Перечислите виды химической связи2. Охарактеризуйте ковалентную связь
по основным признакам
3. Охарактеризуйте ионную связь по
основным признакам
4. Явление sp3, sp2, sp – гибридизации
31. Темы для сообщений
1. История органической химии2. Определение структуры органических
соединений. Инфракрасная
спектроскопия и спектроскопия
комбинационного рассеяния
3. Определение структуры органических
соединений. Масс-спектроскопия











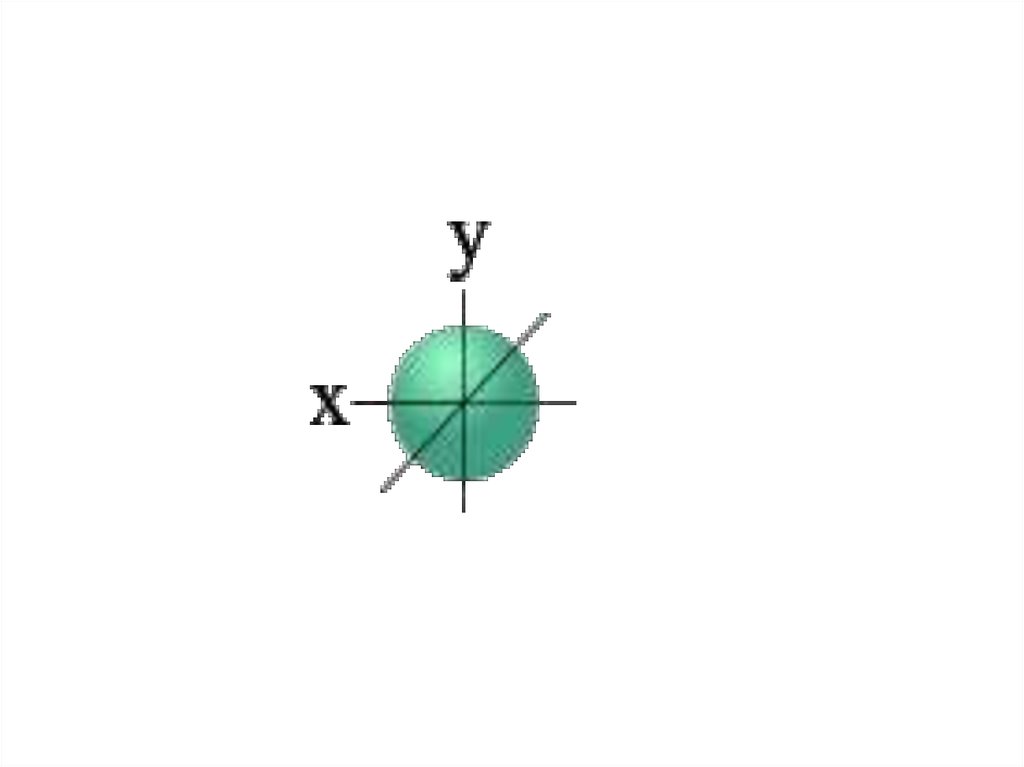


















 Химия
Химия








