Похожие презентации:
Растворы. Реакции ионного обмена. Гидролиз солей
1.
ЗАНЯТИЕ 7«Растворы.
Реакции ионного обмена.
Гидролиз солей»
2.
3.
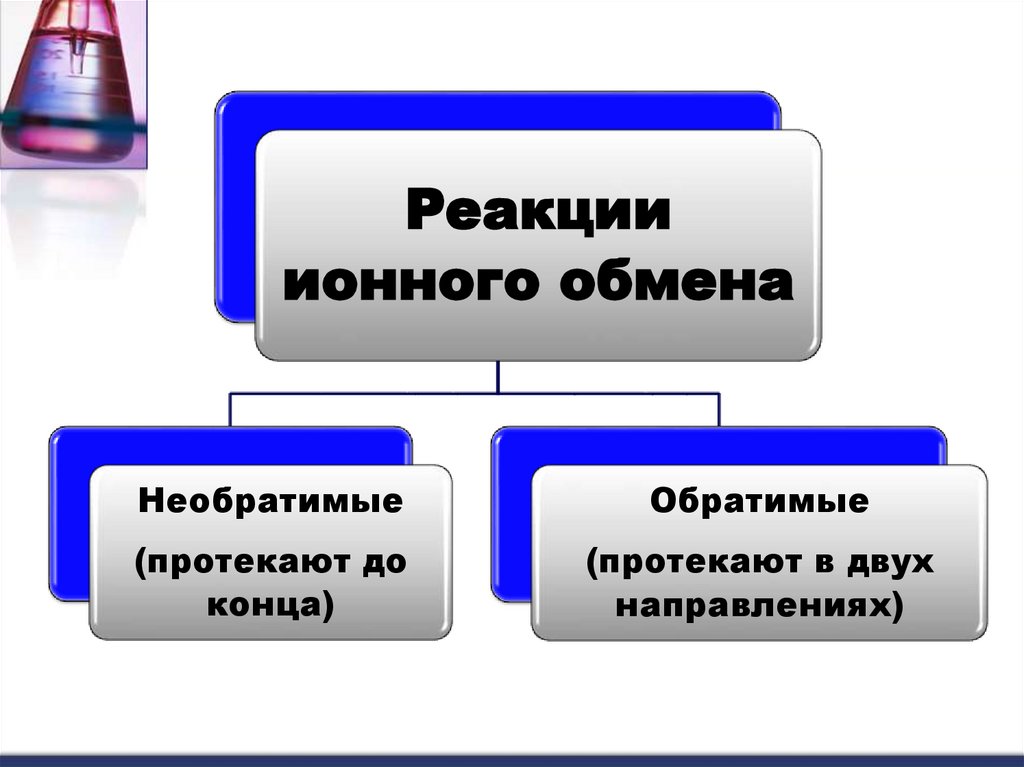
Реакцииионного обмена
Необратимые
Обратимые
(протекают до
конца)
(протекают в двух
направлениях)
4.
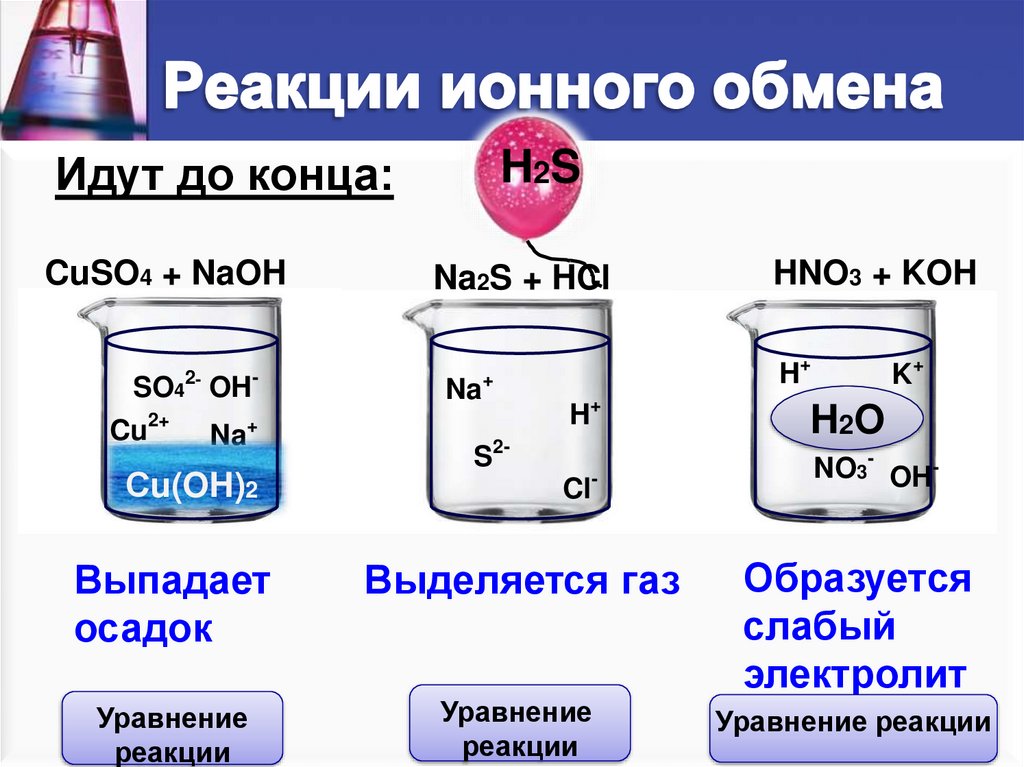
Идут до конца:CuSO4 + NaOH
2-
SO4 OH
2+
Cu
Na
-
H2S
Na2S + HCl
Na
Сu(OH)2
H+
+
+
K+
H+
H2O
Cl-
NO3- OH-
2-
S
HNO3 + KOH
Выпадает
осадок
Выделяется газ
Образуется
слабый
электролит
Уравнение
реакции
Уравнение
реакции
Уравнение реакции
5.
3.Составитьионное ионы
уравнение
(записать
4.Найти полное
одинаковые
в левой
и
1.Записать
уравнение
реакции
в
диссоциацию
растворимых
исходных
веществ
2.По
таблице
растворимости
определить
правой
частях,
сократить
их
и
записать
молекулярном
виде
и продуктов реакции)
растворимость
каждого
вещества
сокращенное ионное
уравнение
Молекулярное уравнение
CuSO4+2NaOH = Cu(OH)2 + Na2SO4
Полное ионное уравнение
2+
+
2-
-
+
Т1
2-
Cu + SO4 +2Na+2OH =Cu(OH)2 +2Na +SO4
Сокращенное ионное уравнение
2+
-
Cu + 2OH = Cu(OH)2
6.
Вода H2O.Слабые
кислоты
(HNO2,
H2CO3,
H2SO3,
CH3COOH и др.).
Слабые основания (NH4OH, Fe(OH)2, Cu(OH)2, и
др.).
Нерастворимые соли(↓): (AgCl , BaSO4, CaCO3,
FeS и др.).
Амфотерные
гидрооксиды
(↓):
Al(OH)3,
Zn(OH)2, Cr(OH)3 и др.
Газообразные вещества( CO2, SO2, H2, H2S,
NH3 и др.).
Оксиды металлов и неметаллов (Li2O, MgO,
P2O5, SiO2, и т.д).
7.
Молекулярное уравнениеNa2S+2HCl = H2S + 2NaCl
Полное ионное уравнение
+
-
+
2-
+
-
2Na + S +2H +2 Cl = H2S + 2Na + 2 Cl
Сокращенное ионное уравнение
2-
S
+
+ 2H
= H2S
8.
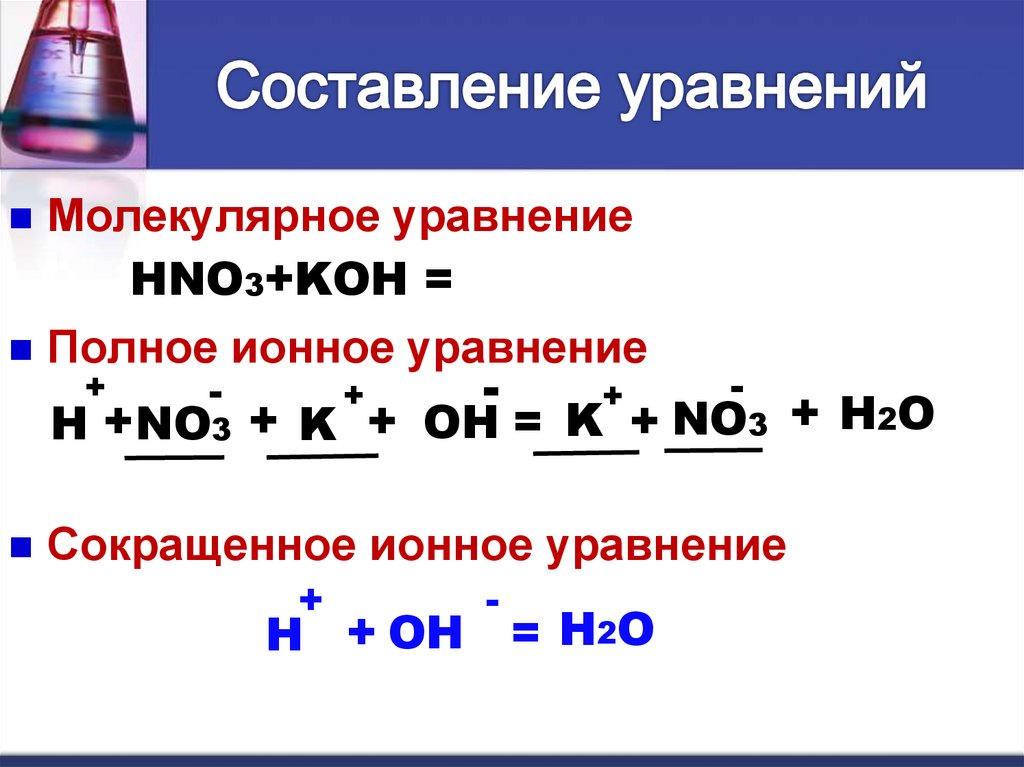
Молекулярное уравнениеHNO3+KOH = KNO3 + H2O
Полное ионное уравнение
+
-
+
-
+
-
H + NO3 + K + OH = K + NO3 + H2O
Сокращенное ионное уравнение
+
H + OH
-
= H2O
9.
Вода H2O.Слабые
кислоты
(HNO2,
H2CO3,
H2SO3,
CH3COOH и др.).
Слабые и нерастворимые основания (NH4OH,
Fe(OH)2, Cu(OH)2, и др.).
Нерастворимые соли(↓): (AgCl , BaSO4, CaCO3,
FeS и др.).
Амфотерные
гидрооксиды
(↓):
(Al(OH)3,
Zn(OH)2, Cr(OH)3 и др.).
Газообразные вещества( CO2, SO2, H2, H2S,
NH3 и др.).
Оксиды металлов и неметаллов (Li2O, MgO,
P2O5, SiO2, и др.).
10.
Na2SO4 + KNO31.Нет осадка
2.Не выделяется газ
3.Не образуется
слабый электролит
Na+
NO3-
SO42K+
11.
Молекулярное уравнениеNa2SO4+2KNO3 2NaNO3 + K2SO4
Полное ионное уравнение
+
2-
+
-
+
-
+
2-
2Na+SO4 +2K +2NO3 2Na+2NO3+2K + SO4
Обратимые реакции – реакции, идущие
во взаимно
противоположных направлениях
12.
2+1.SO4 и H ;
-
2.Cl и Fe
2+
-
2+
2+
и SO4
Ag и Cl
2+
; Fe
3.OH и Cu
4.Ba
+
и OH
Fe(OH)2
-
2и SiO3
Cu(OH)2
2+
BaSO4
Cu(OH)2
+
; Na
2-
AgCl
-
; Cu
-
и OH
13.
Na2МолодецCO3 + HNO3
AlCl
Молодец
3 + NaOH
NaOH
+ H2SO4
Молодец
CaCl
Ошибка
2 + HNO3
LiNO
Ошибка
3 + K2SO4
Молодец
ZnO
+ HCl
Запишите уравнения возможных реакций
в молекулярном, ионном виде.
14.
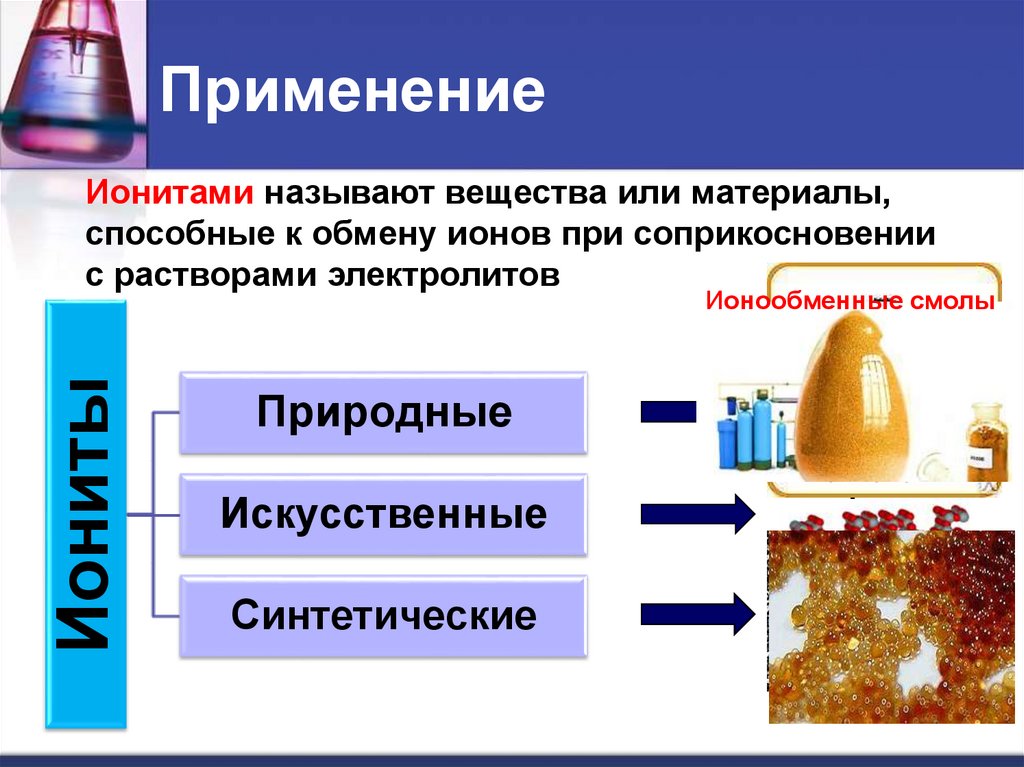
ПрименениеИонитами называют вещества или материалы,
способные к обмену ионов при соприкосновении
с растворами электролитов
Иониты
Ионообменные смолы
Природные
Искусственные
Синтетические
Цеолит
15.
Применение ионитовОчистка воды
1. Для уменьшения жёсткости воды
путём замены обусловливающих её
ионов кальция и магния на другие,
например, натрия.
2. Для обессоливания воды, при этом
удаляются и катионы, и анионы
путём
последовательного
прохождения воды через катионит и
анионит.
3. Для обезжелезивания воды особую
роль играет возможность катионов
удалять двухвалентное железо.
4. Очистка
сточных
вод
промышленных предприятий.
16.
Применение ионитовВ пищевой промышленности:
1.Очистка соков в производстве сахара.
2.В производстве дрожжей, фруктовых соков,
глицерина, глюкозы, сгущенного молока, какао,
кофе со сгущенным молоком.
17.
Применение ионитовДля извлечения металлов
С помощью ионитов извлекаются
редкие и рассеянные элементы из
полиметаллических руд.
W
В сельском хозяйстве иониты
используются для доставки
растениям необходимых им
элементов.
Mo
18.
Применение ионитовВ медицине:
1.Для увеличения сроков хранения крови.
2.Для производства, выделения и очистки антибиотиков.
3.Использование ионитов, селективно извлекающих
токсические вещества из крови человека.














 Химия
Химия








