Похожие презентации:
Устойчивость коллоидных растворов. Явления коагуляции, коллоидной защиты, пептизации (лекция 9)
1.
Устойчивость коллоидныхрастворов. Явления коагуляции,
коллоидной защиты, пептизации
Химия
для специальности 31.05.01 Лечебное дело
Институт фундаментальных основ и информационных технологий в медицине
Автор: кандидат химических наук, доцент
Иванова Надежда Семёновна
2.
План1. Основные виды устойчивости растворов
2. Коагуляция
3. Факторы, вызывающие коагуляцию.
4. Особые случаи коагуляции.
5. Коллоидная защита.
6. Пептизация, виды пептизации.
7. Теории коагуляции.
2
3.
Виды устойчивости растворов (по Пескову)Седиментационная ‒
…
… устойчивость ДФ к
оседанию под действием
силы тяжести.
9η
КСУ
2r 2 ρ ρ 0
Агрегативная ‒ …
… устойчивость ДФ к агрегации
(укрупнению) частиц за счёт:
Вывод: основной вид
1) электростатического
устойчивости
коллоидов ‒
2)
адсорбционнобарьера,
обусловленного F
агрегативная.
сольватного
барьера,
отталкивания из-за
одинакового
q у гранул.
обусловленного
наличием
сольватной оболочки у
мицеллы, препятствующей её
3
сближению с другими.
4.
Коагуляция ‒ …… процесс слипания частиц, образование крупных агрегатов
с потерей седиментационной и фазовой устойчивости и
последующим разделением фаз.
… процесс уменьшения степени дисперсности ДФ под
действием тех или иных факторов.
Стадии коагуляции
скрытая
явная
Вывод: для золей переход скрытой в явную происходит
практически мгновенно!!!
4
5.
Факторы, вызывающие коагуляцию1. Увеличение концентрации золя приводит к
уменьшению расстояния между частицами, на котором
начинают действовать силы притяжения.
2. Добавление неэлектролитов из-за способности
разрушения гидратной (сольватной) оболочки.
Отсутствие оболочки позволяет частицам приблизиться
на расстояние, на котором действуют силы притяжения.
5
6.
Факторы, вызывающие коагуляцию3. Добавление электролитов наиболее сильное по
2-м причинам:
из-за адсорбции ионов электролита на грануле и агрегате,
ζ
снижении заряда гранулы и -потенциала;
из-за уменьшения толщины диффузионного слоя, что приводит
к уменьшению расстояния между частицами и возникновению
сил притяжения.
6
7.
При изучении влияния электролитов на коагуляциюследует учитывать:
коагуляция начинается при достижении порога коагуляции (сп, ск)
сп
с э Vэ
1000 ммоль
3
дм
Vэ Vз
γ Vкс
1
сп
Вывод: чем меньше сп, тем выше γ электролита.
коагулирующей частью электролита является ион, q
которого противоположен q гранулы, а коагуляция наступает в
ИЭТ золя.
7
8.
чем выше заряд коагулирующего иона, тем меньше сп ивыше γ электролита.
Правило Шульце ‒ Гарди …
•… коагулирующее действие оказывает противоион и его γ возрастает
пропорционально некоторой высокой степени его заряда.
•… γ электролита возрастает с увеличением заряда коагулирующего
иона, противоположного по знаку заряду гранулы
8
9.
Правило Дерягина ‒ Ландау …… устанавливает связь
между сп и зарядом
коагулирующего иона.
А
сп 6
Z
Дерягин
Борис Владимирович
(1902‒1994)
Теор.: с п Ме : с п Ме : с п Ме
2
3
Эксп.: сп Ме : сп Ме : сп Ме
2
3
Ландау Лев Давидович
(1908 — 1968)
1 1
1
6 : 6 : 6 730 : 11 : 1
1 2
3
540 : 7 : 1
9
10.
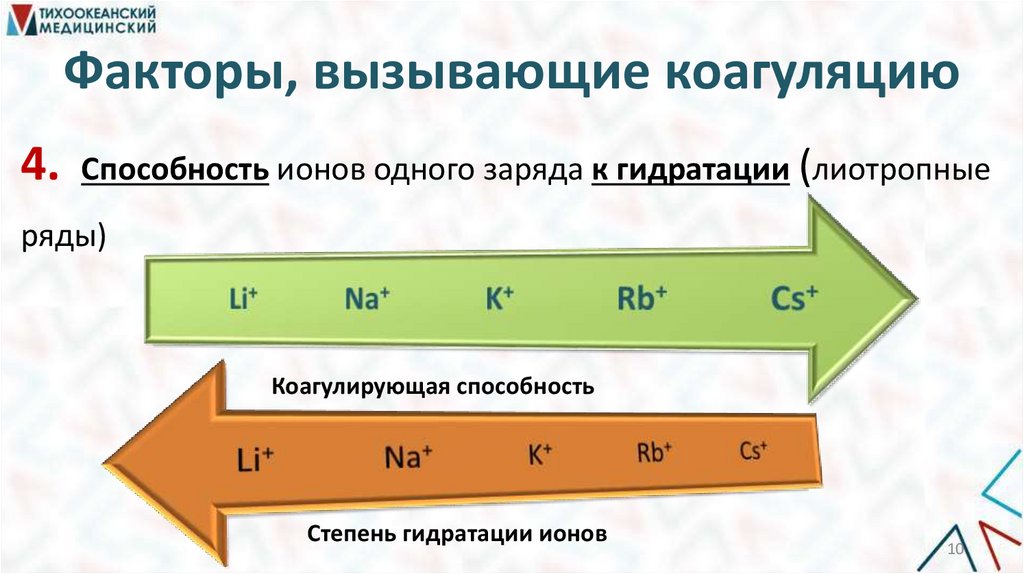
Факторы, вызывающие коагуляцию4. Способность ионов одного заряда к гидратации (лиотропные
ряды)
Коагулирующая способность
Степень гидратации ионов
10
11.
Факторы, вызывающие коагуляцию5. «Ионы-партнёры», идущие в паре с
коагулирующими ионами, уменьшают их γ в случае
адсорбции на поверхности коллоидной частицы.
11
12.
Факторы, вызывающие коагуляцию6. Влияние рН….
Можно рассмотреть на примере слюны, до недавнего времени
считавшейся истинным ионно-белковым водным раствором.
Но откуда:
1. высокая вязкость при незначительном содержании белка (0,20,4%);
2. одновременное присутствие в слюне несовместимых ионов;
3. процессы, характерные для мицеллярных систем (образование
зубного налета, зубных камней) ?
12
13.
Факторы, вызывающиекоагуляцию
• Поэтому наиболее вероятный состав мицеллы слюны
[Ca ( PO ) ] nHPO (n x)Ca
3
4
2
2
4
2 2 x
xCa 2
• При подкислении слюны (рН 5,6) состав мицеллыx
x
(n x)
2
2
[
Ca
(
PO
)
]
nH
PO
Ca
Ca
3
4 2
2
4
2
2
Вывод: заряд мицеллы понижается в два раза, резко понижается
устойчивость мицеллы, что проводит к растворению части эмали
зубов (для восстановлению устойчивости).
13
14.
Факторы, вызывающиекоагуляцию
• При подщелачивании слюны (рН 5,6) состав
мицеллы
3x
3 3( n x )
2
[
Ca
(
PO
)
]
nPO
Ca
3
4 2
4
2
3x
Ca 2
2
Вывод: мицелла также неустойчива, активизируется
образование зубных камней и зубного налета.
14
15.
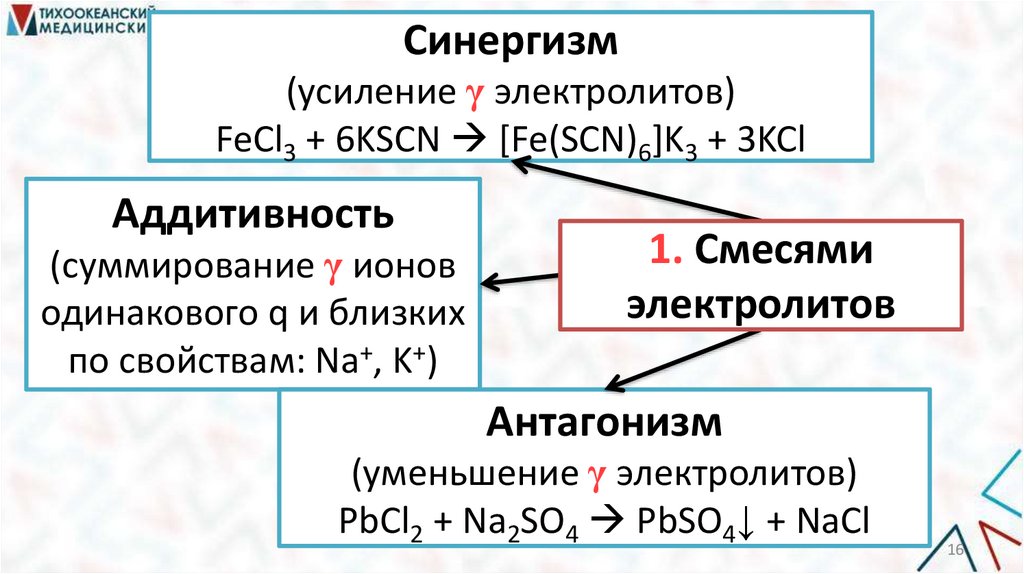
ОСОБЫЕ СЛУЧАИ КОАГУЛЯЦИИ1. Смесями электролитов;
2. Многозарядными ионами‒коагуляторами (чередование
зон коагуляции);
3. При смешивании коллоидов с гранулами разного по
знаку заряда (взаимная коагуляция / гетерокоагуляция);
4. Добавлением очень малых количеств ВМС
(сенсибилизация).
15
16.
Синергизм(усиление γ электролитов)
FeCl3 + 6KSCN [Fe(SCN)6]K3 + 3KCl
Аддитивность
(суммирование γ ионов
одинакового q и близких
по свойствам: Na+, K+)
1. Смесями
электролитов
Антагонизм
(уменьшение γ электролитов)
PbCl2 + Na2SO4 PbSO4↓ + NaCl
16
17.
2. Чередование зон коагуляции‒ζ
II
‒ 30 мВ
0
+ 30 мВ
‒
IV
I
‒
‒
+
VI
+
+
III
‒
V
VII
сэл
+ζ
Причина явления ‒ перезарядка коллоидной частицы за
счёт адсорбции многозарядных ионов.
17
18.
3. ГетерокоагуляцияПричина явления ‒
электростатическое притяжение
+
0
‒
частиц золя противоположного q.
Наиболее полно гетерокоагуляция
протекает при равенстве по
величине, но различия по знаку q
гранул 2-х золей.
18
19.
4. Сенсибилизация …… вызвана добавлением очень малых количеств ВМС и
понижает устойчивость коллоидов.
… связана с особенностями ВМС:
1. образование макроионов с большой адсорбционной
способностью;
2. одновременная адсорбция макроионов на нескольких
коллоидных частицах с образованием флокул
(мостиковый механизм).
19
20.
…повышениеустойчивости
коллоидов
добавлением ВМС в
концентрациях,
достаточных
для
полного
адсорбционного
насыщения
поверхности мицелл
защищаемого золя.
Коллоидная защита …
Вывод: адсорбционный слой является механическим
20
препятствием для иона ‒ коагулянта.
21.
Защитное число …… min масса ВМС (мг), достаточная для защиты 10 см3
гидрозоля от коагулирующего действия 1 см3 раствора
NaCl с ω=10% (массовая концентрация 100 г/л).
З.Ч.
100 VВМС ω ВМС
Vзоля
21
22.
Процесс перехода свежевыпавшего при коагуляцииосадка во взвешенное состояние (золь) под влиянием
пептизация
пептизаторов ‒
Адсорбционная
Включают
Диссолюционная
стадии:
а) образование пептизатора за счёт
а) ↓Fe(OH)
+
HCl
→
FeOCl
(пепт)
+
2Н
О
↓Fe(OH)
+
FeCl
(пепт.)
→
3
2
3
3
хим. реакции;
а) введение пептизатора;
б) адсорбция
ионов пептизатора
на поверхности
частиц
осадка,
3+FeOCl
‒}x+
‒
б) ↓Fe(OH)
+
(пепт)
→
{[Fe(OH)
]
·nFe
·(3n‒x)Cl
·xCl
3
3 m
появление у них одинакового q+и за счёт электростатического
{[Fe(OH)3]m·nFeО ·(n‒x)Cl‒}x+ ·xCl‒
22
отталкивания – переход в раствор.
23.
Теории коагуляцииФизическая
Адсорбционная
(ДЛФО)
(Фрейндлих)
Уменьшение толщины
Адсорбция ионов –
диффузионного слоя и гидратной
коагулянтов на агрегате и
оболочки, уменьшение
расстояния между мицеллами, грануле, снижение величины
возникновение сил притяжения,
q и ζ – потенциала,
коагуляция.
коагуляция.
При действии‒9ионов-коагулянтов
10 м
На данном
расстоянии
происходит
сжатие
10‒7мионной атмосферы.
Частицыдействуют
сближаютсясилы
на расстояние,
где действуют
силы притяжения.
отталкивания
++
+ +
23
24.
ЗАКЛЮЧЕНИЕ1. Различия в свойствах коллоидов и истинных растворов определяются увеличением
размеров коллоидных частиц.
2. Мицеллярное строение частиц объясняет агрегативную устойчивость коллоидов,
приводит к формированию ДЭС и возникновению φ и - потенциалов.
3. - потенциал – основная характеристика золя, так как определяет его устойчивость.
4. Нарушение агрегативной устойчивости коллоидов приводит к коагуляции.
5. По теории ДЛФО действие всех факторов, вызывающих коагуляцию, сводится к
уменьшению диффузионного слоя и сольватной оболочки мицеллы, что ведет к
уменьшению расстояния между частицами и возникновению сил притяжения.
6. ВМС, добавленные к коллоиду, могут вызвать два противоположных процесса: в
малых количествах – понижение устойчивости коллоидов (сенсибилизация), в больших
– повышение устойчивости (коллоидная защита).
7. Пептизация – процесс обратный коагуляции, но реализация его ограничена
структурой выпавшего осадка.
24






















 Химия
Химия








