Похожие презентации:
Катионы III-IV аналитических групп
1.
Федеральное государственное бюджетное образовательное учреждениевысшего образования «Красноярский государственный медицинский
университет имени профессора В.Ф. Войно-Ясенецкого» Министерства
здравоохранения Российской Федерации
Катионы III-IV аналитических
групп
к.п.н. Агафонова И.П.
2.
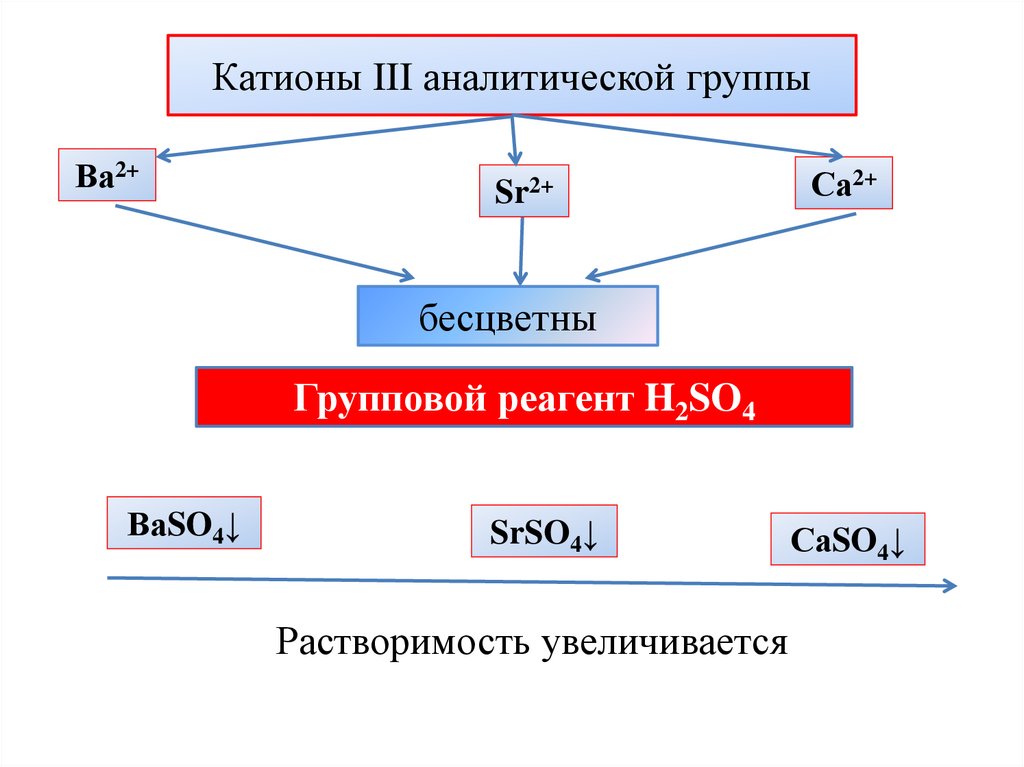
Катионы III аналитической группыВа2+
Sr2+
Са2+
бесцветны
Групповой реагент H2SO4
ВаSO4↓
SrSO4↓
Растворимость увеличивается
СаSO4↓
3.
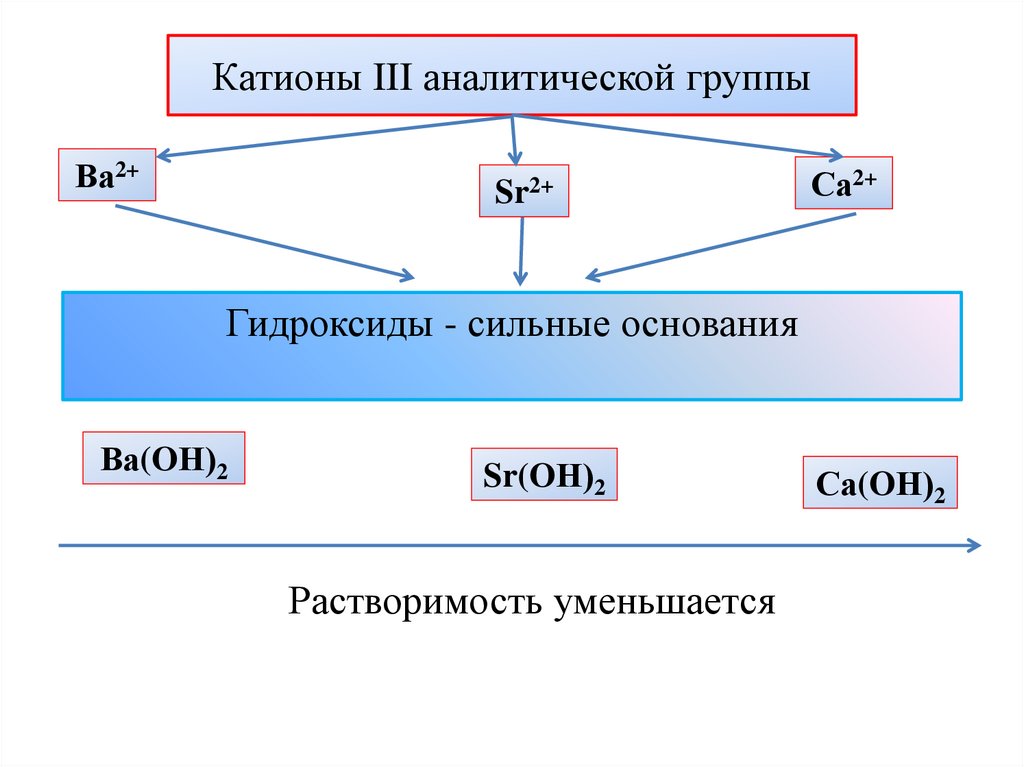
Катионы III аналитической группыВа2+
Sr2+
Са2+
Гидроксиды - сильные основания
Ва(OН)2
Sr(OН)2
Растворимость уменьшается
Са(OН)2
4.
Ва2+- небольшая концентрация обнаружена в пигментной
оболочке глаза;
- соединения в малых дозах стимулируют деятельность
костного мозга, но в больших дозах ионы бария токсичны;
- даже в ничтожно малых количествах заметно влияет на
состояние гладкой мускулатуры;
избыток
Роль бария полностью не изучена, его суточная доза для
человека определена – от 0,3 до 0,9 мг.
нарушается кальциевый обмен, может развиться тяжёлое
заболевание – уровская болезнь, при которой процессы
окостенения замедляются, а опорно-двигательный аппарат
изнашивается очень быстро
5.
6.
Sr2+избыток
- элемент, обмен которого связан с обменом кальция;
- в количествах до 3-4 мг в сутки предотвращает развитие
кариеса и остеопороза;
- особенно опасен для организма радиоактивный 90Sr,
который при попадании в состав костной ткани способен
влиять на костный мозг и нарушать кроветворные
процессы.
Высокая концентрация стронция крайне опасна, особенно для
детского организма. Радиоактивный стронций негативно
сказывается на растущей костной ткани, облучая ее и приводя
к болезням суставов и их деформации, что также
сопровождается задержкой в росте ребенка. Такое заболевание
называется стронциевым рахитом.
7.
8.
Cа2+- в построении твердых тканей организма: костей (особенно в
первый год жизни), зубов и волос;
- в проведении импульса при сокращении мышечных волокон;
- в свертывании крови при кровотечениях;
- в снижении раздражительности и реакции на стресс;
- входит в состав ядер клеток и тканевой жидкости;
- оказывает
заметный
антиаллергический
и
противовоспалительный эффект ;
избыток
800-1000 мг
Тошнота, которая нередко сопровождается рвотой; отсутствие
аппетита; запоры; аритмия и нарушение работы сердечной
мышцы; нарушение работы почек; ухудшение психического
состояния вплоть до галлюцинаций и др.
9.
10.
Аналитические реакции накатион бария
11.
Частные реакции на катион бариякатион
Аналитический реагент
Аналитический
эффект
Ва2+
Реакция окрашивания
пламени
Желто-зеленое
окрашивание
Летучие соли бария окрашивают
бесцветное пламя в желто-зеленый цвет
12.
Частные реакции на катион бариякатион
Аналитический реагент
Аналитический
эффект
Ва2+
Серная кислота H2SO4 и
растворимые сульфаты
Белый осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
ВаС12 + H2SO4 → BaSO4↓ + 2HCI
Ва2+ + SO42- → BaSO4↓
13.
Частные реакции на катион бариякатион
Аналитический реагент
Аналитический
эффект
Ва2+
Хромат калия К2СгО4
Желтый осадок
УСЛОВИЯ: - нейтральная, уксуснокислая среда.
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
ВаС12 + К2СгО4 → ВаСгО4↓ + 2KCI
Ba2+ + СгО42- → BаСгО4↓
14.
Частные реакции на катион бариякатион
Аналитический реагент
Аналитический
эффект
Ва2+
Оксалат аммония (NH4)2C2O4 Белый
кристаллический
осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
BаСl2 + (NH4)2C2O4 → BаС2О4↓ + 2NH4Cl
Bа2+ + C2O42- → BаС2О4 ↓
15.
Аналитические реакции накатион кальция
16.
Частные реакции на катион кальциякатион
Аналитический реагент
Аналитический
эффект
Cа2+
Реакция окрашивания
пламени
Кирпично-красное
окрашивание
Летучие соли кальция окрашивают
бесцветное пламя в кирпично-красный
цвет
17.
Частные реакции на катион кальциякатион
Аналитический реагент
Аналитический
эффект
Cа2+
Серная кислота H2SO4 и
растворимые сульфаты
белый осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
СаСl2 + H2SO4 → CaSO4↓ + 2HCI
Ca2+ +SO42- → CaSO4↓
Более полное осаждение сульфата происходит при добавлении к
раствору этилового спирта
При медленной кристаллизации выделяется в форме
игольчатых кристаллов гипса - CaSO4∙2 Н2О
18.
Частные реакции на катион кальциякатион
Аналитический реагент
Аналитический
эффект
Cа2+
Оксалат аммония (NH4)2C2O4 Белый
кристаллический
осадок
УСЛОВИЯ: - нейтральная, уксуснокислая или слабощелочная среда;
- охлаждение;
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
BаСl2 + (NH4)2C2O4 → BаС2О4↓ + 2NH4Cl
Bа2+ + C2O42- → BаС2О4 ↓
19.
Частные реакции на катион кальциякатион
Аналитический реагент
Аналитический
эффект
Cа2+
Оксалат аммония (NH4)2C2O4 Белый
кристаллический
осадок
УСЛОВИЯ: - нейтральная, уксуснокислая или слабощелочная среда;
- охлаждение;
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
BаСl2 + (NH4)2C2O4 → BаС2О4↓ + 2NH4Cl
Bа2+ + C2O42- → BаС2О4 ↓
20.
Частные реакции на катион кальциякатион
Аналитический реагент
Аналитический
эффект
Cа2+
Гексацианоферрат (II) калия
K4[Fe(СN)6]
Белый
кристаллический
осадок
УСЛОВИЯ: - слабощелочная среда (аммиачно-буферная смесь рН = 9)
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
CaCl2 + K4[Fe(CN)6] + NH4Cl → CaKNH4[Fe(CN)6]↓ + ЗКСl
Са2++ К+ + NH4+ + [Fe(CN)6]4- → CaKNH4[ Fe(CN)6]↓
21.
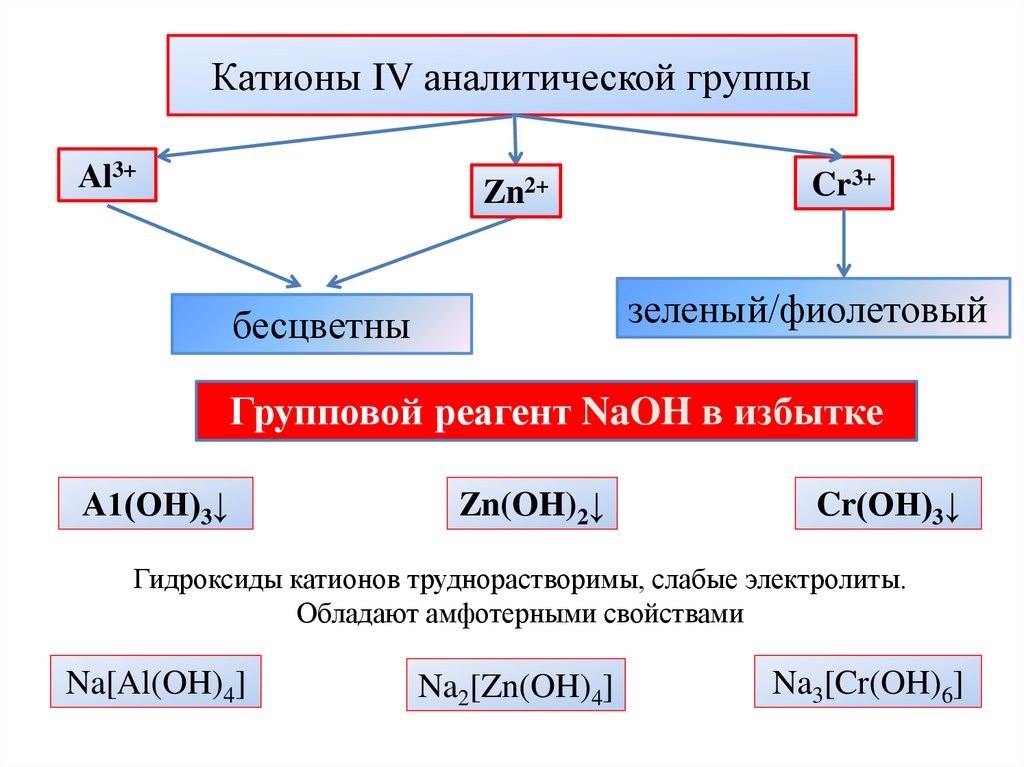
Катионы IV аналитической группыАl3+
Zn2+
Cr3+
зеленый/фиолетовый
бесцветны
Групповой реагент NaOH в избытке
А1(ОН)3↓
Zn(OH)2↓
Cr(ОН)3↓
Гидроксиды катионов труднорастворимы, слабые электролиты.
Обладают амфотерными свойствами
Na[Al(OH)4]
Na2[Zn(OH)4]
Na3[Cr(OH)6]
22.
Al3+- накапливается в костях, печени, легких, почках, головном
мозге;
- участвует в процессах регенерации костной,
соединительной и эпителиальной ткани;
- влияет на пищеварительные ферменты, на функцию
околощитовидных желез
избыток
45-50 мг
умерщвляет клетки мозга (парализует центральную нервную
систему, вызывает дрожание головы и судороги),
вызывает
анемию и артрит, угнетает выработку желудочных и слюнных
ферментов, способствует развитию остеопороза и рахита
23.
24.
Zn2+- играет важную роль в деятельности клеток головного
мозга,
-способствует повышению общего энергетического уровня
биохимических процессов;
- усиливает защитную реакцию организма .
избыток
8-11 мг
металлический привкус во рту; ожоги слизистой ЖКТ; боли в
животе, тошнота; рвота и диарея; падение артериального
давления;возникновение судорог в икроножных мышцах;
явления фарингита или бронхита; увеличение и болезненность
печени. Люди, которые используют назальные спреи и гели,
содержащие цинк, могут иметь побочные эффекты – например,
такие, как потеря обоняния.
25.
26.
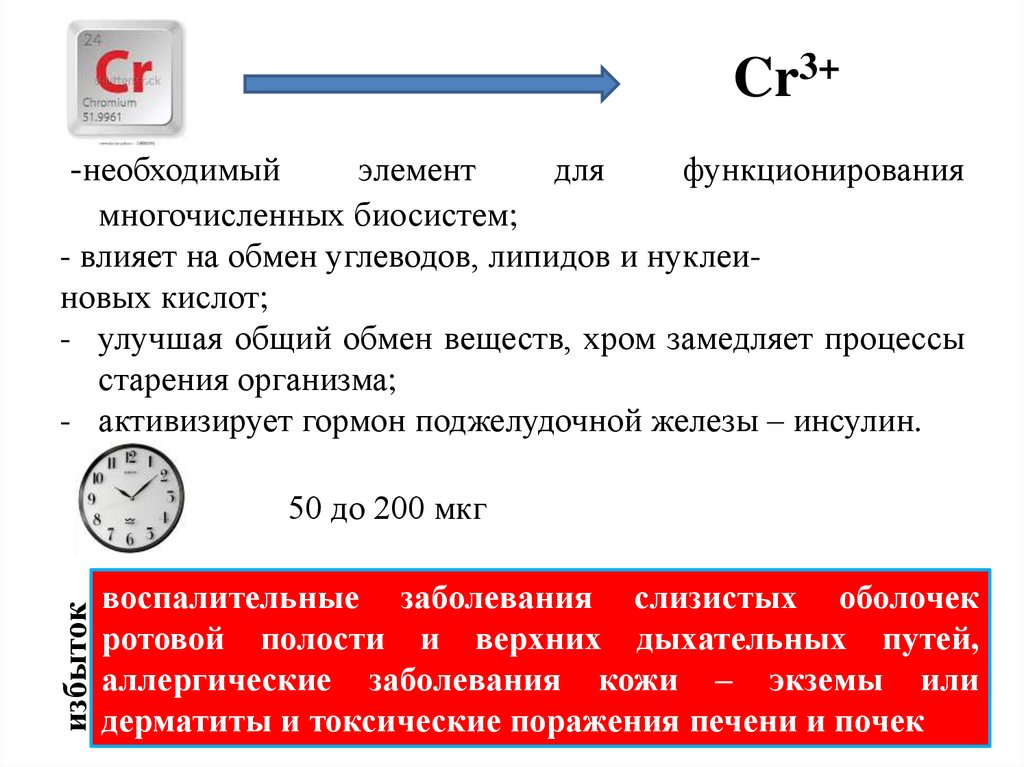
Cr3+-необходимый
элемент
для
функционирования
многочисленных биосистем;
- влияет на обмен углеводов, липидов и нуклеиновых кислот;
- улучшая общий обмен веществ, хром замедляет процессы
старения организма;
- активизирует гормон поджелудочной железы – инсулин.
избыток
50 до 200 мкг
воспалительные заболевания слизистых оболочек
ротовой полости и верхних дыхательных путей,
аллергические заболевания кожи – экземы или
дерматиты и токсические поражения печени и почек
27.
28.
Аналитические реакции накатион алюминия
29.
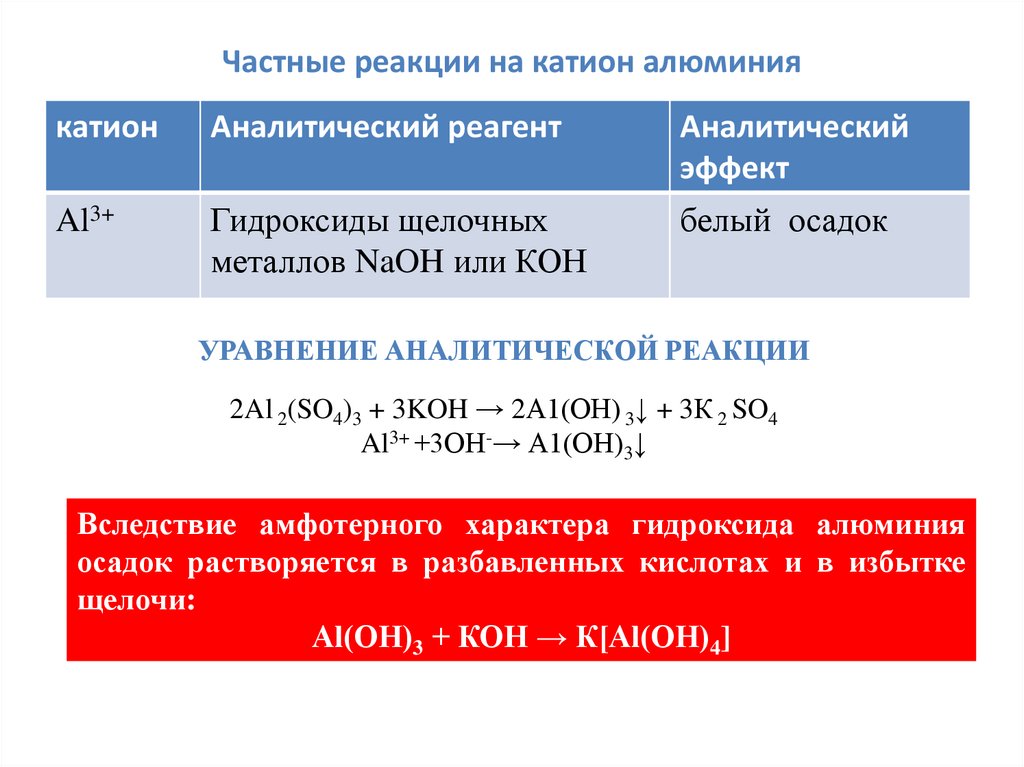
Частные реакции на катион алюминиякатион
Аналитический реагент
Аналитический
эффект
Al3+
Гидроксиды щелочных
металлов NaOH или КОН
белый осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
2Al 2(SO4)3 + 3KOH → 2А1(ОН) 3↓ + 3К 2 SO4
Al3+ +3ОН-→ А1(ОН)3↓
Вследствие амфотерного характера гидроксида алюминия
осадок растворяется в разбавленных кислотах и в избытке
щелочи:
Аl(ОН)3 + КОН → К[Аl(ОН)4]
30.
Частные реакции на катион алюминиякатион
Аналитический реагент
Аналитический
эффект
Al3+
Сухой хлорид аммония NH4CI белый осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
К[А1(ОН)4] + NH4C1 → Аl(ОН)3↓ + КС1 + NH3↑+ Н2О
[А1 (ОН) 4]-+ NH4+ → Al (ОН)3↓+ NH3↑+ Н2О
31.
катионЧастные реакции на катион алюминия
Аналитический реагент
Аналитический
эффект
Al3+
Ализарин
Ярко-красное
соединение
(алюминиевый
лак)
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
!
Реакция с гидроксидом алюминия
32.
катионAl3+
Частные реакции на катион алюминия
Аналитический реагент
Аналитический
эффект
Нитрата кобальта (II)
Co(NO3)2
«Тенариева синь»
- зола синего цвета
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
2Al(SO4)3 + 2 Co(NO3)2 → 2 Co(AlO2)2 + 6 SO3↑ 4NO2↑ +O2↑
При озолении образуется зола, окрашенная в синий цвет алюминатом
кобальта («Тенариева синь» )
33.
Аналитические реакции накатион цинка
34.
Частные реакции на катион цинкакатион
Аналитический реагент
Аналитический
эффект
Zn2+
Гидроксиды щелочных
металлов NaOH или КОН
белый
студенистый
осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
Zn(NO3)2 + 2KOH → Zn(OH)2↓ + 2KNO3
Zn2+ + 2ОН- → Zn(OH)2↓
Вследствие амфотерного характера гидроксида алюминия
осадок растворяется в разбавленных кислотах и в избытке
щелочи:
Zn(OH)2 + 2KOH → K2[Zn(OH)4]
35.
Частные реакции на катион цинкакатион
Аналитический реагент
Аналитический
эффект
Zn2+
Гексацианоферрат (III) калия
К3[Fе(СN)6]
Коричневатожелтый осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
3Zn(NO3)2 + 2К3[Fе(СN)6] → Zn3[Fe(CN)6]2↓+ 6KNO3
3Zn2+ + 2[Fе(СN)6]3- → Zn3[Fe(CN)6]2↓
36.
Частные реакции на катион цинкакатион
Аналитический реагент
Аналитический
эффект
Zn2+
Гексацианоферрат (II) калия
K4[Fe(CN)6 ]
Белый осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
3Zn(NO3)2 + 2К4[Fе(СN)6] → K2Zn3[Fe(CN)6]2↓+ 6 KNO3
3Zn2+ +2K+ + 2[Fе(СN)6]4- → K2Zn3[Fe(CN)6]2↓
37.
Частные реакции на катион цинкакатион
Аналитический реагент
Аналитический
эффект
Zn2+
Сульфид натрия Na2S
Белый аморфный
осадок
УСЛОВИЯ: - нейтральная среда.
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
Zn(NO3)2 + Na2S → ZnS ↓+2NaNO3
Zn2+ + S2- → ZnS↓
38.
катионZn2
Частные реакции на катион алюминия
Аналитический реагент
Аналитический
эффект
Нитрата кобальта (II)
Co(NO3)2
«зелень Ринмана»
- зола зеленого
цвета
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
Zn(NO3)2+ Co (NО3)2 → CoZnO2 + 4NO2↑+ O2↑
При озолении образуется зола,
окрашенная в зеленый цвет цинкатом
кобальта («зелень Ринмана» » )

































 Химия
Химия








