Похожие презентации:
Катионы V аналитической группы
1.
Федеральное государственное бюджетное образовательное учреждениевысшего образования «Красноярский государственный медицинский
университет имени профессора В.Ф. Войно-Ясенецкого» Министерства
здравоохранения Российской Федерации
Катионы V аналитической
группы
к.п.н. Агафонова И.П.
2.
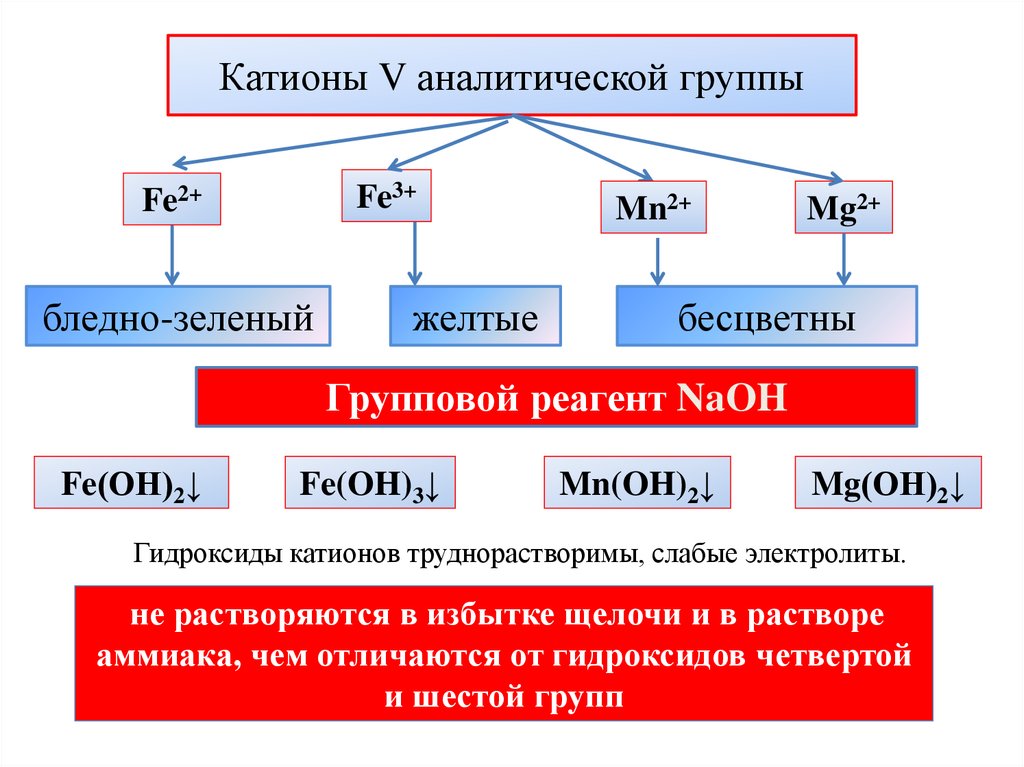
Катионы V аналитической группыFe3+
Fe2+
бледно-зеленый
желтые
Mn2+
Mg2+
бесцветны
Групповой реагент NaOH
Fe(ОН)2↓
Fe(OH)3↓
Mn(OH)2↓
Mg(ОН)2↓
Гидроксиды катионов труднорастворимы, слабые электролиты.
не растворяются в избытке щелочи и в растворе
аммиака, чем отличаются от гидроксидов четвертой
и шестой групп
3.
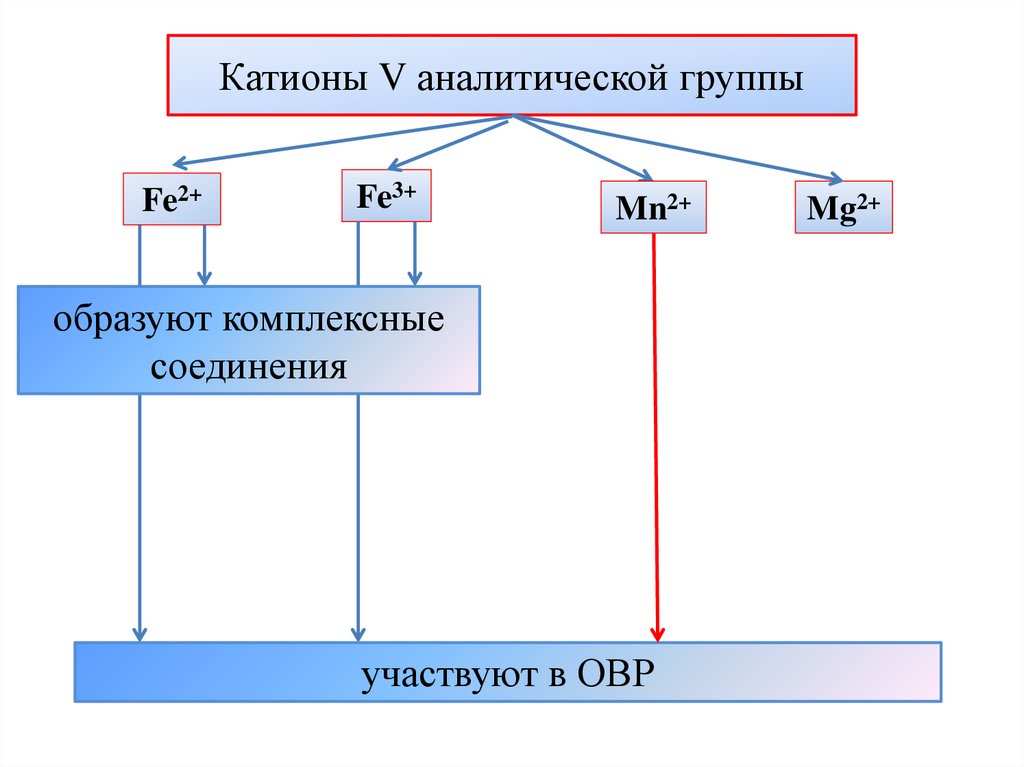
Катионы V аналитической группыFe2+
Fe3+
Mn2+
образуют комплексные
соединения
участвуют в ОВР
Mg2+
4.
Fe3+Fe2+
- обеспечивает транспорт кислорода (входит в состав
гемоглобина);
- обеспечивает транспорт электронов в окислительновосстановительных реакциях организма (входит в состав
цитохромов и железосеропротеидов);
участвует
в
формировании
активных
центров
окислительно-восстановительных ферментов.
избыток
10-15 мг
сидероз (отложение железа в тканях и органах) головные боли,
головокружения,
повышенная
утомляемость,
слабость
гиперпигментация кожи различные диспептические явления,
угнетение клеточного и гуморального иммунитета и увеличение
риска
развития
различных
заболеваний
печеночная
недостаточность, фиброз печениу, меньшение массы тела
5.
6.
Mg2+является кофактором многих ферментов, в т.ч. кокарбоксилазы и
коэнзима А (принимают участие в высвобождении энергии из пищи)
- играет значительную роль при передаче нервных импульсов и
необходим для ритмичной работы сердца
- активно участвует в обмене белка и нуклеиновых кислот
- регулирует митохондриальную выработку и перенос энергии
- регулирует передачу сигнала в нервной и мышечной ткани
- способствует расслаблению гладкомышечных волокон
- снижает артериальное давление
- угнетает агрегацию тромбоцитов
- ускоряет пассаж содержимого кишечник
-
от 400 мг
избыток
снижение работоспособности, вялость,
сонливость, диарея
7.
8.
Mn2+- активирует или входит в состав многих ферментов;
- является катализатором некоторых реакций в организме человека;
- участвует в обмене инсулина, гормонов щитовидной железы;
- препятствует окислению свободными радикалами, обеспечивая
стабильность клеточных мембран;
- регулирует функционирование мышц, развитие соединительной
ткани, хрящей, скелета;
повышает утилизацию жиров и углеводов
избыток
от 2 мг
психические нарушения, нарушения желудочнокишечного тракта, повышенная утомляемость,
вялость,
сонливость,
заторможенность,
нарушения
памяти,
депрессия,
различные
парестезии,
замедленность
и
скованность
движений
9.
10.
Аналитические реакции накатион железа (II)
11.
Частные реакции на катион железа (II)катион
Аналитический реагент
Аналитический
эффект
Fe2+
Гидроксиды щелочных
металлов NaOH и КОН
Бледно-зеленый
осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
FeSO4 + 2KOH → Fe(OH)2↓+ К2SO4
Fe2+ + 2OH- → Fe(OH)2↓
При стоянии на воздухе осадок быстро буреет вследствие
окисления до гидроксида железа (III):
4Fe(OH)2 + О2 + 2Н2О → 4 Fe(OH)3↓
12.
Частные реакции на катион железа (II)катион
Аналитический реагент
Аналитический
эффект
Fe2+
Гексацианоферрат (III) калия
К3[Fе(СN)6]
Темно-синий
осадок
(турнбулева синь)
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
3FeSO4 + 2K3[Fe(CN)6] → Fе3[Fе(СN)6]2↓ + 3K2SO4
3Fe2+ + 2[Fe(CN)6]3- → Fе3[Fе(СN)6]2↓
Следует избегать избытка реагента , так как его желтая окраска
придает осадку зеленоватый оттенок.
13.
Частные реакции на катион железа (II)катион
Аналитический реагент
Аналитический
эффект
Fe2+
Сульфид аммония (NH4)2S
Черный осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
FeSO4 + (NH4)2S → FeS↓ + (NH4)2SO4
Fe2++ S2- →FeS↓
14.
Аналитические реакции накатион железа (III)
15.
Частные реакции на катион железа (III)катион
Аналитический реагент
Аналитический
эффект
Fe3+
Гидроксиды щелочных
металлов NaOH и КОН
Бурый осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
FeCl3 + 3КОН → Fe(OH)3↓+ 3KC1
Fe3+ + 3ОН- → Fe(OH)3↓
16.
Частные реакции на катион железа (III)катион
Аналитический реагент
Аналитический
эффект
Fe3+
Гексацианоферрат (II) калия
K4 Fe(CN)6]
Темно-синий
осадок (берлинская
лазурь )
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
4FeCl3 + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3↓ + 12КС1
4Fe3+ + 3[Fe(CN)6]4- → Fе4[(CN)6]3↓
17.
Частные реакции на катион железа (III)катион
Аналитический реагент
Аналитический
эффект
Fe3+
Сульфид аммония (NH4)2S
Черный осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
2FeCl3 + 3(NH4)2S → Fe2S3↓ + 6NH4CI
2Fe3+ + 3S2- → Fe2S3 ↓
18.
Частные реакции на катион железа (III)катион
Аналитический реагент
Аналитический
эффект
Fe3+
Роданид калия KSCN
Кроваво-красное
окрашивание
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
Упрощенное уравнение может быть записано следующим образом
FeCl3 + 3KSCN → Fe(SCN)3 + 3KC1
Fe3+ + 3SCN- → Fe(SCN)3
Для повышения ее чувствительности реагент должен взят в
избытке
19.
Частные реакции на катион железа (III)катион
Аналитический реагент
Аналитический
эффект
Fe3+
Иодид калия KI
Бурое
окрашивание
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
2FeCl3 + 2KI → 2FeCl2 + 2КС1 + I2
Реакцию выполняют на фильтровальной бумаге
20.
Аналитические реакции накатион магния
21.
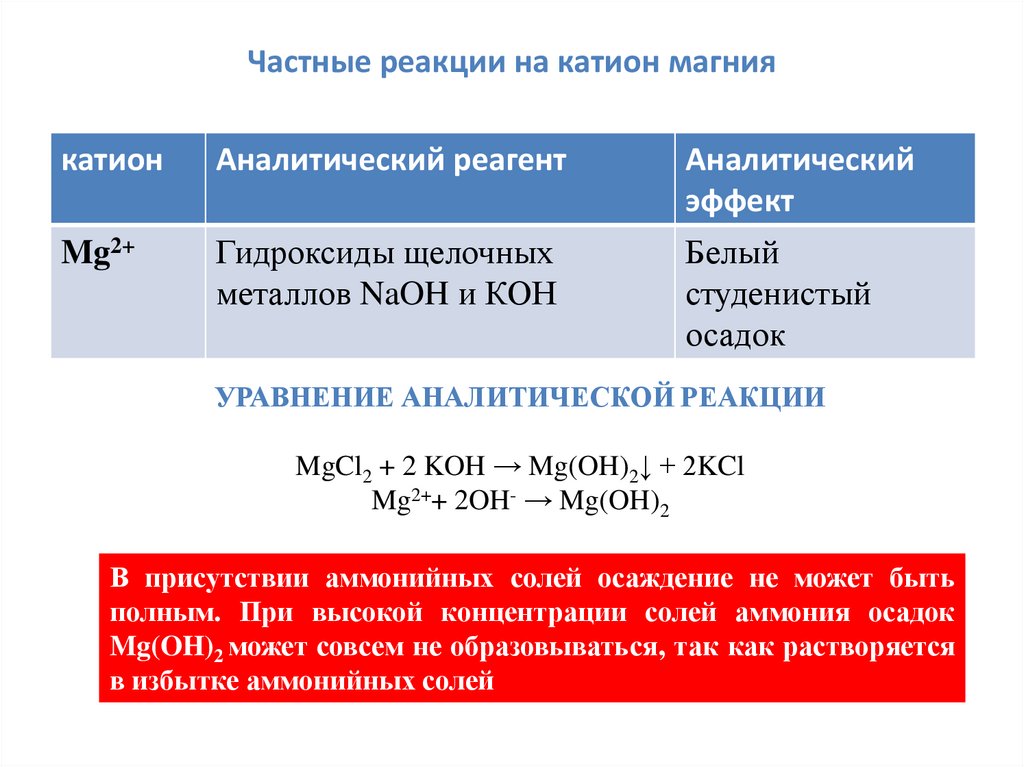
Частные реакции на катион магниякатион
Аналитический реагент
Аналитический
эффект
Mg2+
Гидроксиды щелочных
металлов NaOH и КОН
Белый
студенистый
осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
MgCl2 + 2 KOH → Mg(OH)2↓ + 2KCl
Mg2++ 2OH- → Mg(OH)2
В присутствии аммонийных солей осаждение не может быть
полным. При высокой концентрации солей аммония осадок
Mg(OH)2 может совсем не образовываться, так как растворяется
в избытке аммонийных солей
22.
Частные реакции на катион магниякатион
Аналитический реагент
Аналитический
эффект
Mg2+
Гидрофосфат натрия Na2HPO4 Белый
мелкокристалличе
ский осадок
УСЛОВИЯ: - слабощелочная среда (аммиачно-буферная смесь рН = 9)
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
MgCl2 + NaHPO4 + NH4OH → NH4MgPO4↓ + 2NaCl + H2O
Mg2+ + PO43- + NH4+ → NH4MgPO4↓
23.
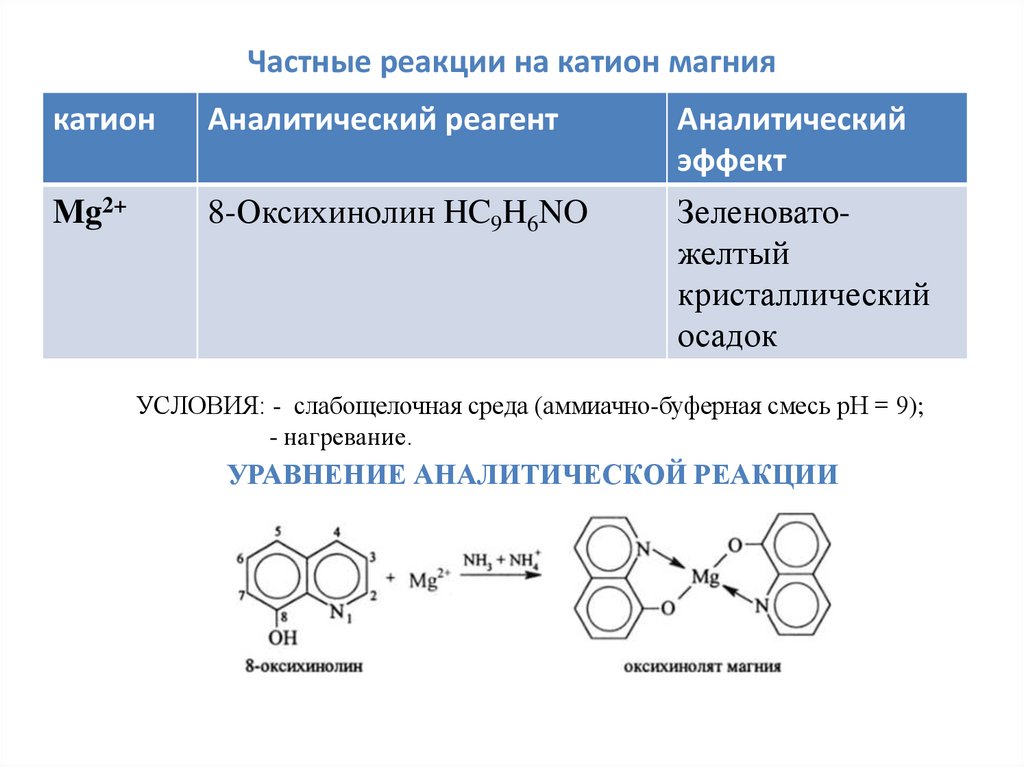
Частные реакции на катион магниякатион
Аналитический реагент
Аналитический
эффект
Mg2+
8-Оксихинолин HC9H6NO
Зеленоватожелтый
кристаллический
осадок
УСЛОВИЯ: - слабощелочная среда (аммиачно-буферная смесь рН = 9);
- нагревание.
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
24.
Аналитические реакции накатион марганца (II)
25.
Частные реакции на катион марганца (II)катион
Аналитический реагент
Аналитический
эффект
Mn2+
Гидроксиды щелочных
металлов NaOH и КОН
Белый осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
MnSO4 + 2КОН → Mn(OH)2↓ + K2SO4
Mn2+ + 2ОН- → Mn(OH)2↓
При стоянии на воздухе осадок быстро буреет
2Mn(OH)2↓ + О2 → 2MnО(OH)2↓ (Н2МnО3)
26.
Частные реакции на катион марганца (II)катион
Аналитический реагент
Аналитический
эффект
Mn2+
Пероксид водорода Н2О2
Темно-бурый
осадок
УСЛОВИЯ: - щелочная среда.
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
MnSO4 + Н2О2 + 2NaOH → МnО(ОН)2↓ + Na2SO4 + Н2О
Mn2++ Н2О2 + 2ОН- → МnО(ОН)4 + Н2О
Бромная вода оказывает такое же действие
27.
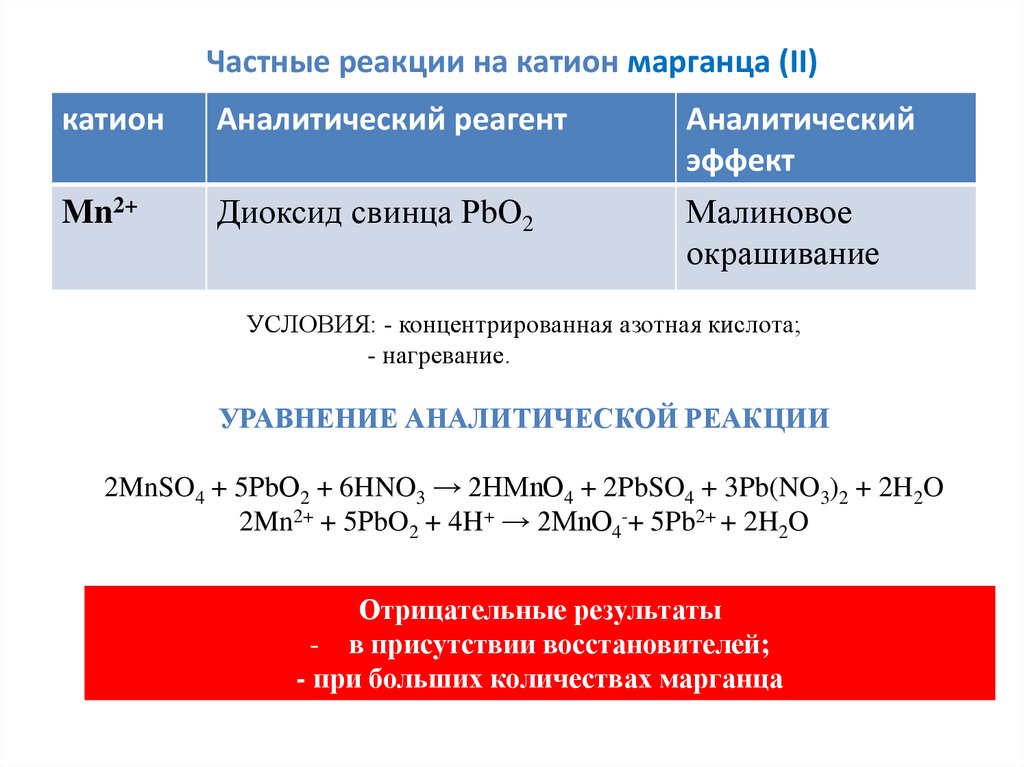
Частные реакции на катион марганца (II)катион
Аналитический реагент
Аналитический
эффект
Mn2+
Диоксид свинца РbО2
Малиновое
окрашивание
УСЛОВИЯ: - концентрированная азотная кислота;
- нагревание.
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
2MnSO4 + 5РbО2 + 6HNO3 → 2HMnO4 + 2PbSO4 + 3Pb(NO3)2 + 2H2O
2Mn2+ + 5РbO2 + 4H+ → 2MnO4-+ 5Pb2+ + 2H2O
Отрицательные результаты
- в присутствии восстановителей;
- при больших количествах марганца
28.
Частные реакции на катион марганца (II)катион
Аналитический реагент
Аналитический
эффект
Mn2+
Висмутат натрия NaBiO3
Малиновое
окрашивание
УСЛОВИЯ: - концентрированная азотная кислота;
- нагревание.
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
2MnSO4 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 +NaNO3 + 2Na2SO4 +7H2O
Отрицательные результаты
- в присутствии восстановителей;
- при больших количествах марганца
29.
Частные реакции на катион марганца (II)катион
Аналитический реагент
Аналитический
эффект
Mn2+
Сульфид аммония (NH4)2S
Розово-телесный
осадок
УРАВНЕНИЕ АНАЛИТИЧЕСКОЙ РЕАКЦИИ
MnSO4 + (NH4)2S → MnS ↓ + (NH4)2SO4
Mn2+ + S2- → MnS ↓























 Химия
Химия








