Похожие презентации:
Распад и синтез липидов. Обмен жирных кислот. Синтез кетоновых тел. Лекция №9
1. Распад и синтез липидов. Обмен жирных кислот. Синтез кетоновых тел.
Лекция № 9 для специальности 31.05.01 Лечебное делоподготовлена доцентом ИФОИТМ ТГМУ Артюковой О.А.
2020–2021 учебный год
2. Основные вопросы лекции:
Особенности переваривания и ассимиляции жиров в организме.Обмен жирных кислот Активация и транспорт жирных кислот
в митохондрии. Роль карнитина.
-окисление
насыщенных
и
ненасыщенных
жирных
кислот
с четным числом атомов углерода. Окисление жирных кислот
с нечетным числом С-атомов, образование малонил-КоА.
Синтез и использование кетоновых тел. Гиперкетонемия, кетонурия,
ацидоз при сахарном диабете и голодании.
Пальмитатсинтазный комплекс: строение, последовательность реакций
синтеза жирных кислот. Источники восстановительных эквивалентов.
Микросомальная
система
удлинения
жирных
кислот.
Обмен
полиненасыщенных жирных кислот.
Образование эйкозаноидов, их биологическая роль.
3.
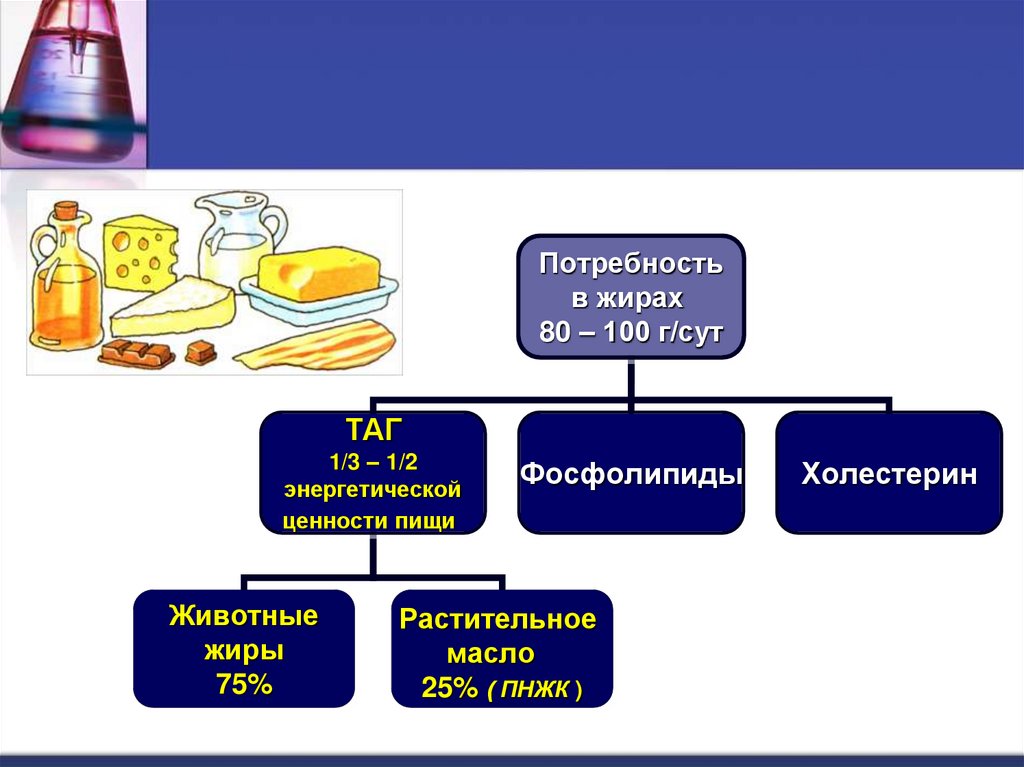
Потребностьв жирах
80 – 100 г/сут
ТАГ
1/3 – 1/2
энергетической
ценности пищи
Животные
жиры
75%
Фосфолипиды
Растительное
масло
25% ( ПНЖК )
Холестерин
4. Ассимиляция пищевых жиров включает все этапы метаболизма пищевых ТАГ, начиная с переваривания их в ЖКТ и заканчивая
распределением продуктов гидролиза по тканям.Все природные липиды хорошо перевариваются.
При смешанном питании усвоение составляет:
сливочное масло 93-98%,
свиной жир 96-98%,
говяжий жир 80-94%,
подсолнечное масло - 86-90%.
Так как липиды нерастворимы в воде, их переваривание и всасывание имеет
свои особенности и протекает в несколько стадий.
Липиды пищи при механическом воздействии и под влиянием желчи
смешиваются с пищеварительными соками с образованием эмульсии
(«масло в воде»). Образование эмульсии необходимо для увеличения
площади действия ферментов, т.к. они работают только в водной фазе.
Липиды жидкой пищи (молоко, бульон) поступают сразу в виде эмульсии.
5. Особенности переваривания жиров в разных отделах ЖКТ.
Ротовая полость:механическое измельчение пищи и смачивание ее слюной.
гидролиз ТАГ с короткими и средними жирными кислотами, поступающих
с жидкой пищей в виде эмульсии, осуществляет лингвальная липаза.
Желудок:
в клетках желудка вырабатывается желудочная липаза (активна
при рН 5-6 у новорожденных, неактивна у взрослых при рН 1-2).
Образующиеся в желудке новорожденных ЖК и моноацилглицерины
далее участвуют в эмульгировании липидов в двенадцатиперстной кишке.
Двенадцатиперстная кишка и тонкой кишечник:
процесс гидролиза жиров происходит под действием панкреатической липазы
(необходимы особые условия – эмульгирование жиров!).
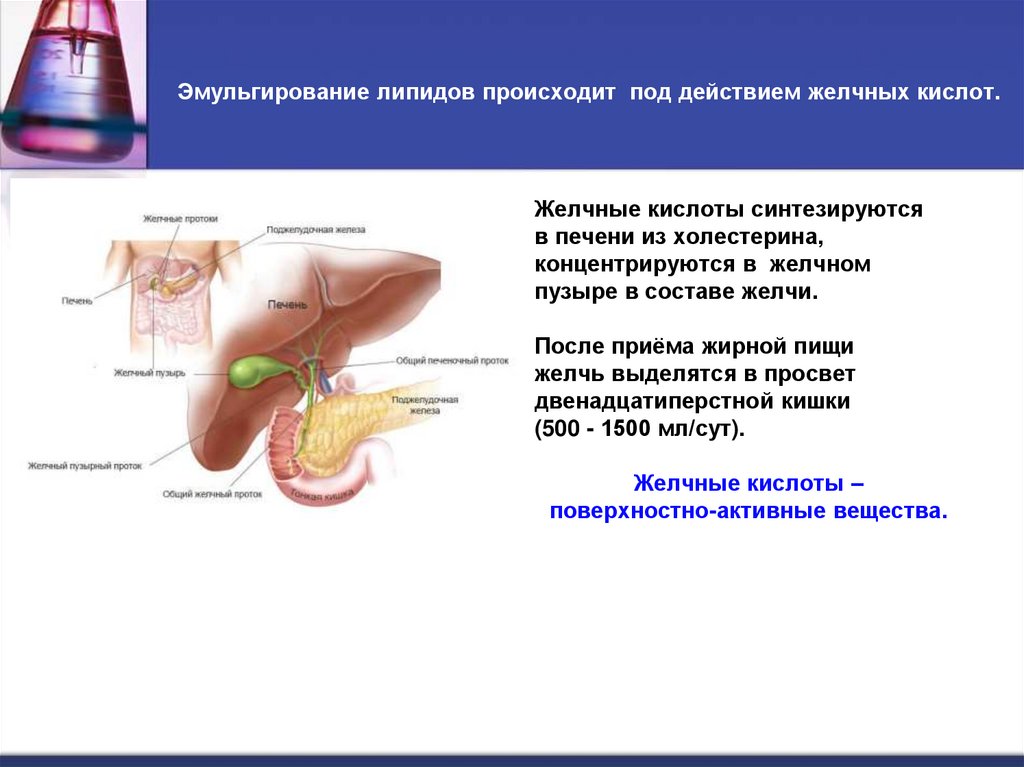
6. Эмульгирование липидов происходит под действием желчных кислот.
Желчные кислоты синтезируютсяв печени из холестерина,
концентрируются в желчном
пузыре в составе желчи.
После приёма жирной пищи
желчь выделятся в просвет
двенадцатиперстной кишки
(500 - 1500 мл/сут).
Желчные кислоты –
поверхностно-активные вещества.
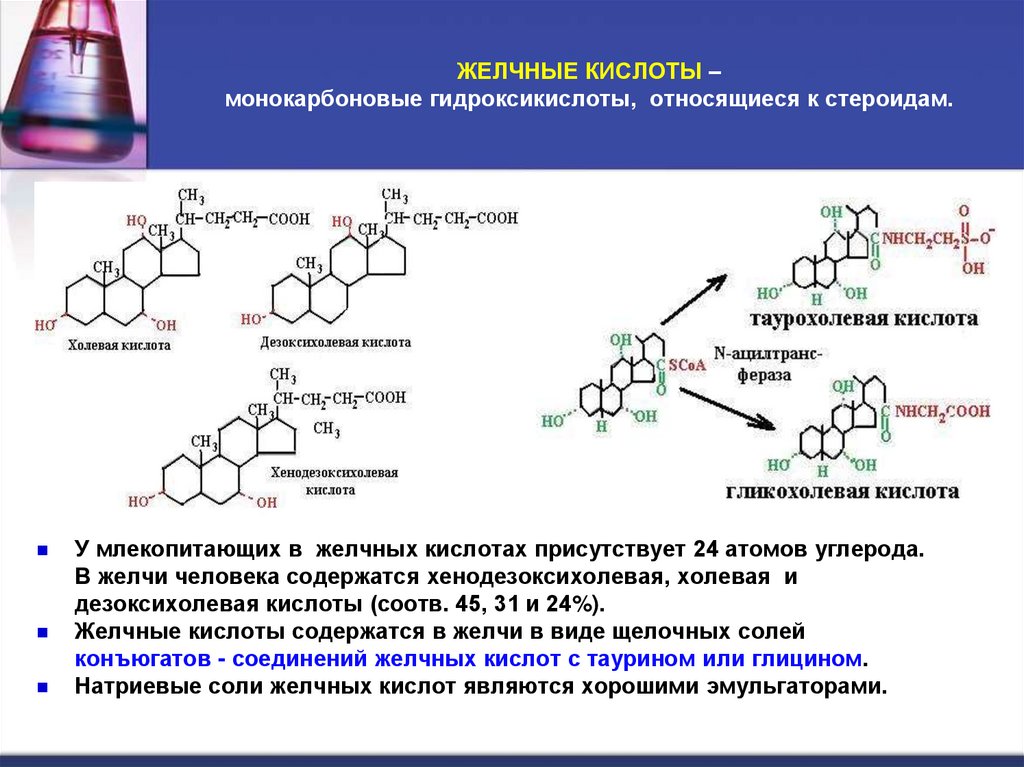
7. ЖЕЛЧНЫЕ КИСЛОТЫ – монокарбоновые гидроксикислоты, относящиеся к стероидам.
ЖЕЛЧНЫЕ КИСЛОТЫ –монокарбоновые гидроксикислоты, относящиеся к стероидам.
У млекопитающих в желчных кислотах присутствует 24 атомов углерода.
В желчи человека содержатся хенодезоксихолевая, холевая и
дезоксихолевая кислоты (соотв. 45, 31 и 24%).
Желчные кислоты содержатся в желчи в виде щелочных солей
конъюгатов - соединений желчных кислот с таурином или глицином.
Натриевые соли желчных кислот являются хорошими эмульгаторами.
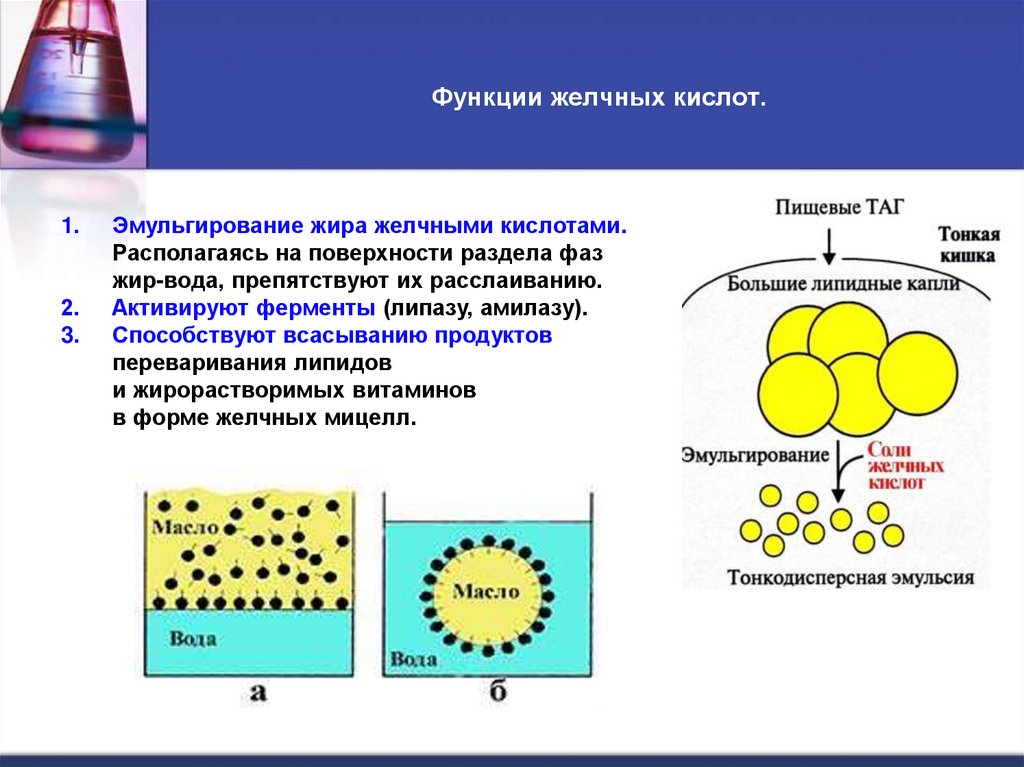
8. Функции желчных кислот.
1.2.
3.
Эмульгирование жира желчными кислотами.
Располагаясь на поверхности раздела фаз
жир-вода, препятствуют их расслаиванию.
Активируют ферменты (липазу, амилазу).
Способствуют всасыванию продуктов
переваривания липидов
и жирорастворимых витаминов
в форме желчных мицелл.
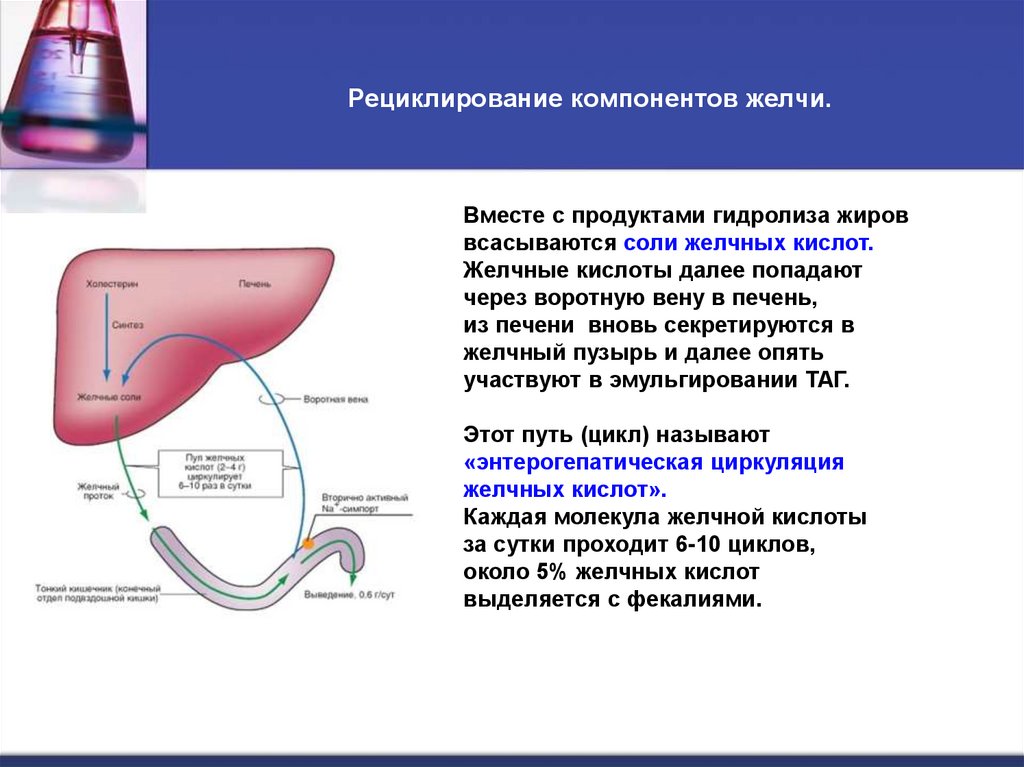
9. Рециклирование компонентов желчи.
Вместе с продуктами гидролиза жироввсасываются соли желчных кислот.
Желчные кислоты далее попадают
через воротную вену в печень,
из печени вновь секретируются в
желчный пузырь и далее опять
участвуют в эмульгировании ТАГ.
Этот путь (цикл) называют
«энтерогепатическая циркуляция
желчных кислот».
Каждая молекула желчной кислоты
за сутки проходит 6-10 циклов,
около 5% желчных кислот
выделяется с фекалиями.
10.
Гидролиз ТАГ в тонком кишечнике осуществляетпанкреатическая липаза (рН=8).
Оптимум рН для работы липазы создается в результате
нейтрализации кислого содержимого, поступающего из желудка,
бикарбонатом, секретируемым поджелудочной железой:
Липаза гидролизует ТАГ преимущественно в положениях 1 и 3,
с образованием 2 молекул ЖК и моноацилглицерола (МАГ),
часть МАГ гидролизуется до глицерина и 3 молекул ЖК.
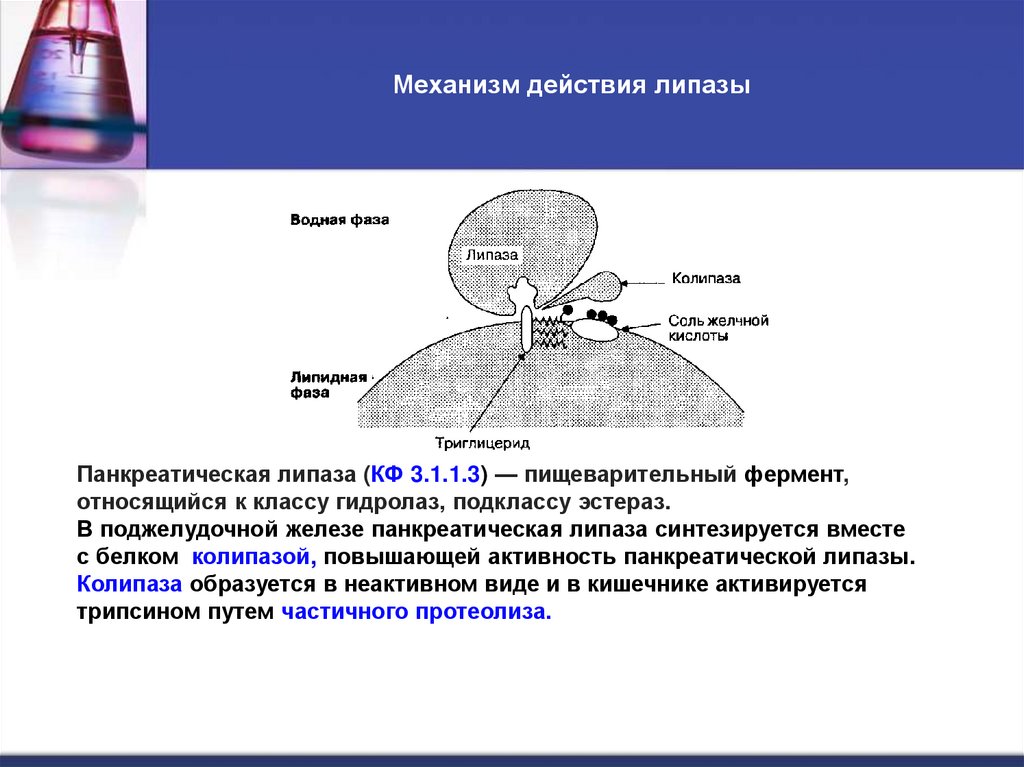
11. Механизм действия липазы
Панкреатическая липаза (КФ 3.1.1.3) — пищеварительный фермент,относящийся к классу гидролаз, подклассу эстераз.
В поджелудочной железе панкреатическая липаза синтезируется вместе
с белком колипазой, повышающей активность панкреатической липазы.
Колипаза образуется в неактивном виде и в кишечнике активируется
трипсином путем частичного протеолиза.
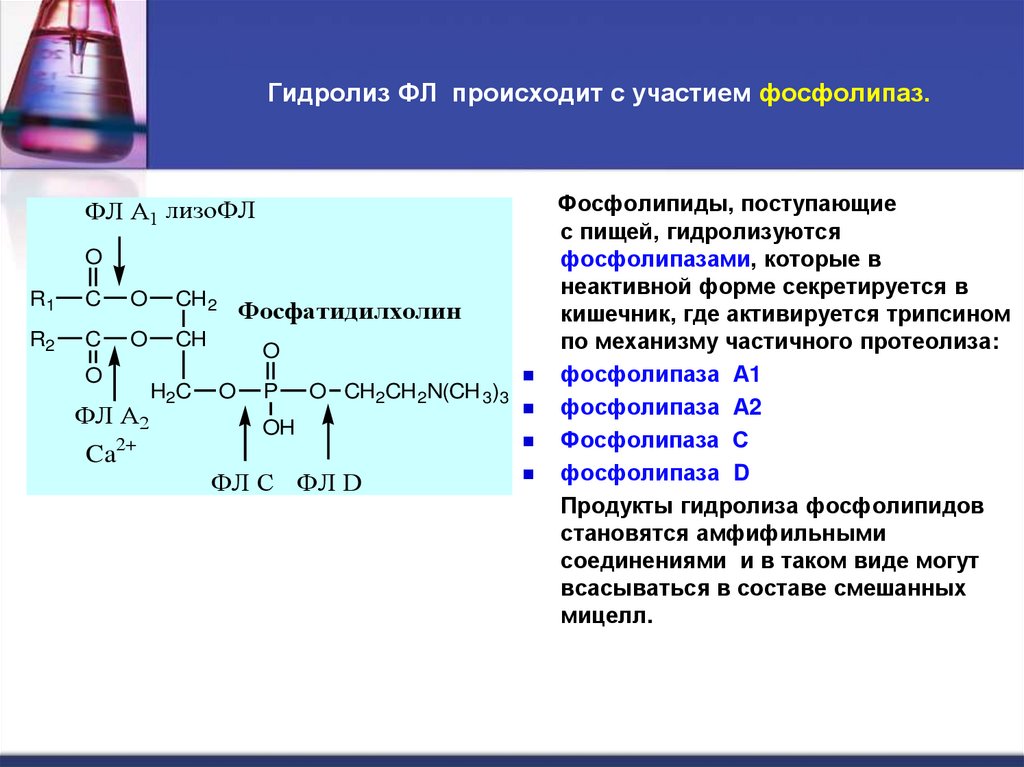
12. Гидролиз ФЛ происходит с участием фосфолипаз.
ФЛ А1 лизоФЛO
R1
C
O
CH 2
R2
C
O
CH
O
ФЛ А2
Ca2+
H2C
Фосфатидилхолин
O
O
P
O CH 2CH 2N(CH 3)3
OH
ФЛ C ФЛ D
Фосфолипиды, поступающие
с пищей, гидролизуются
фосфолипазами, которые в
неактивной форме секретируется в
кишечник, где активируется трипсином
по механизму частичного протеолиза:
фосфолипаза А1
фосфолипаза А2
Фосфолипаза С
фосфолипаза D
Продукты гидролиза фосфолипидов
становятся амфифильными
соединениями и в таком виде могут
всасываться в составе смешанных
мицелл.
13.
Образование и всасывание мицелл.Продукты гидролиза жиров (жирные кислоты, МАГ, холестерол)
вместе с компонентами желчи образуют в просвете кишечника структуры смешанные мицеллы.
Гидрофобные части молекул обращены внутрь мицелл, а гидрофильные —
наружу, поэтому мицеллы хорошо растворяются в водной фазе
содержимого тонкой кишки и легко усваиваются.
14. Большая часть продуктов переваривания жиров вновь превращается в ТАГ в клетках стенки кишечника (ресинтез жиров).
Ресинтезу жиров предшествует активация жирных кислот,т.е. присоединение ЖК к коферменту HS-КоА (образуется ацил-КоА).
Ресинтез ТАГ происходит под действием ферментов ацилтрансфераз,
в процессе образуются видоспецифичные ТАГ,
отличающиеся по составу от тех, которые входили в состав пищи
(более свойственные нашему организму, а не пищевому жиру).
Состав ТАГ человека: 25%(С16:0), 8%(С18:0), 46%(С18:1), 10%(С18:2).
15. Нарушения переваривания и всасывания жиров может быть обусловлено рядом причин.
1. Нарушение оттока желчи (холестаз).Уменьшение секреции желчи вызывает нарушение эмульгирования ТАГ
(желчнокаменная болезнь, опухоли и др.).
2. Нарушение секреции сока поджелудочной железы (панкреатит).
Дефицит панкреатической липазы приводит к снижению гидролиза ТАГ.
Нарушение переваривания липидов тормозит
их всасывание, что приводит к увеличению
количества липидов в фекалиях —
возникает стеаторея (жирный стул).
При длительном нарушении переваривания жиров снижается
усвоение незаменимых факторов питания липидной природы жирорастворимых витаминов и ПНЖК. В результате развиваются
гиповитаминозы с соответствующими клиническими симптомами.
16. Ресинтезированные ТАГ транспортируются в лимфу, затем в кровь в составе транспортных форм – хиломикронов (ХМ).
Липиды не растворяются в водных фазах организма, поэтому транспорт их кровьюи лимфой осуществляется липопротеинами - надмолекулярными комплексами
сферической формы, состоящими из ФЛ и белков –аполипопротеинов (-апо).
Гидрофильную оболочку составляют
амфифильные ФЛ, ХС, белок В-48
(синтезируется в клетках слизистой
оболочки тонкой кишки, необходим
для формирования структуры ХМ).
В гидрофобное ядро входят
гидрофобные липиды (85 %ТАГ, ЭХС).
«Созревание» ХМ происходит в крови
при включении в состав апопротеинов:
апо-С-II (активатор фермента ЛП-липазы),
апо-Е (лиганд к рецепторам гепатоцита).
17. Алиментарная гиперлипемия (гиперхиломикронемия).
Повышение концентрации ХМ в крови после приема пищи вызываеталиментарную гиперлипемию (max через 4-6 час после приема пищи).
В крови жиры ХМ расщепляются липопротеидлипазой (ЛП-липаза, КФ3.1.1.34).
ЛП-липаза синтезируется в адипоцитах и др. клетках, секретируется и
прикрепляется к наружной поверхности эндотелиальных клеток капилляров,
непосредственно контактирует с кровью.
Липопротеинлипаза активна в сердце, мышцах и жировой ткани, легких.
Продукты гидролиза (жирные кислоты) поступают в клетки, где могут
окисляться, участвовать в синтезе ФЛ или депонироваться в виде ТАГ.
18. Через 8-12 час после приема пищи хиломикроны из кровотока исчезают (натощак отсутствуют!)
Структуры, которыеобразуются из ХМ после
гидролиза ТАГ, называются
остаточными хиломикронами
и захватываются печенью.
В составе остаточных
хиломикронов содержатся:
холестерол,
жирорастворимые витамины,
апопротеины.
Остаточные хиломикроны
в клетках печени подвергаются
гидролизу в лизосомах.
19. Семейная гиперхиломикронемия (гипертриацилглицеролемия 1 типа).
Нарушение утилизации ХМ может быть вызвано:- недостатком апобелков С-II, Е (протеинопатии),
- снижением активности ЛП-липазы (ферментопатия),
что приводит к развитию семейной гиперхиломикронемии («кровь с молоком»)
Клинические проявления возникают в возрасте до 10 лет;
характерны отложения липидов в коже в виде ксантом,
а также в печени и селезенке, что проявляется гепатоспленомегалией.
Часто наблюдаются боли в животе, панкреатит.
20. Распад жиров (липолиз) в организме.
Липиды организма являются резервуаром потенциальной химической энергиигораздо большем, чем углеводы.
Резервные липиды на 99% представлены ТАГ жировой ткани (депо!)
Жиры, депонированные в адипоцитах в абсорбтивный период,
используются как источник энергии. Жиры являются самыми
высококалорийными веществами в организме.
При окислении 1 г жиров выделяется 9,7 ккал, а 1 г углеводов - 4,7 ккал.
Использование резервных ТАГ происходит при
- голодании,
- воздействии холода,
- физической нагрузке,
- репродукции,
- росте и развитии организма.
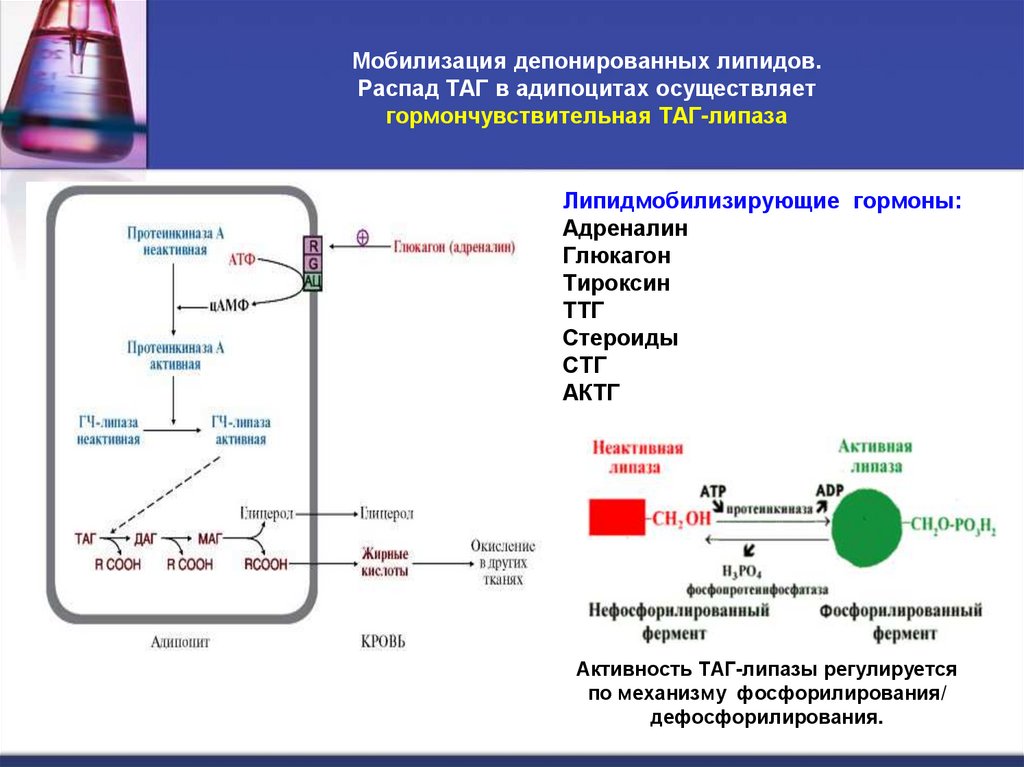
21. Мобилизация депонированных липидов. Распад ТАГ в адипоцитах осуществляет гормончувствительная ТАГ-липаза
Липидмобилизирующие гормоны:Адреналин
Глюкагон
Тироксин
ТТГ
Стероиды
СТГ
АКТГ
Активность ТАГ-липазы регулируется
по механизму фосфорилирования/
дефосфорилирования.
22. Мобилизация депонированных липидов. Последовательность процессов:
В результате мобилизации ТАГконцентрация свободных ЖК
в крови увеличивается в 2 раза.
Жирные кислоты, как и глюкоза,
являются основными
«топливными молекулами»
(энергоносителями).
ЖК, как гидрофобные молекулы,
транспортируются кровью в
периферические ткани белком
альбумином, имеющим центры
связывания гидрофобных молекул.
Большинство тканей
(кроме нервной и эритроцитов),
использует ЖК как источник энергии.
23. β-ОКИСЛЕНИЕ ВЫСШИХ ЖИРНЫХ КИСЛОТ - ИСТОЧНИК ЭНЕРГИИ ДЛЯ СИНТЕЗА АТФ.
β–окисление–процесс, в ходе которого ЖК распадаются до ацетил~КоА.Окисление ацетил~КоА в ЦТК служит источником энергии синтеза АТФ.
Локализация процесса в клетке: митохондрии (аэробный процесс!).
Локализация процесса в органах: печень, мышцы (сердечная мышца),
жировая ткань, почки и др.
Жирные кислоты, проникающие из крови в клетку, подвергаются
реакции активации под действием фермента ацил-КоА-синтетазы:
24. Внутренняя мембрана митохондрий непроницаема для ацил-КоА.
Существует система переноса ЖК черезмембрану в комплексе с карнитином.
Карнитинацилтрансфераза I, осуществляющая
перенос ЖК на карнитин на внешней мембране
митохондрий, является регуляторным
ферментом и определяет скорость
переноса ЖК внутрь митохондрий
(ингибитор - малонил-КоА).
Карнитин - природное вещество,
родственное витаминам группы В,
синтезируется в организме, является
витаминоподобным веществом.
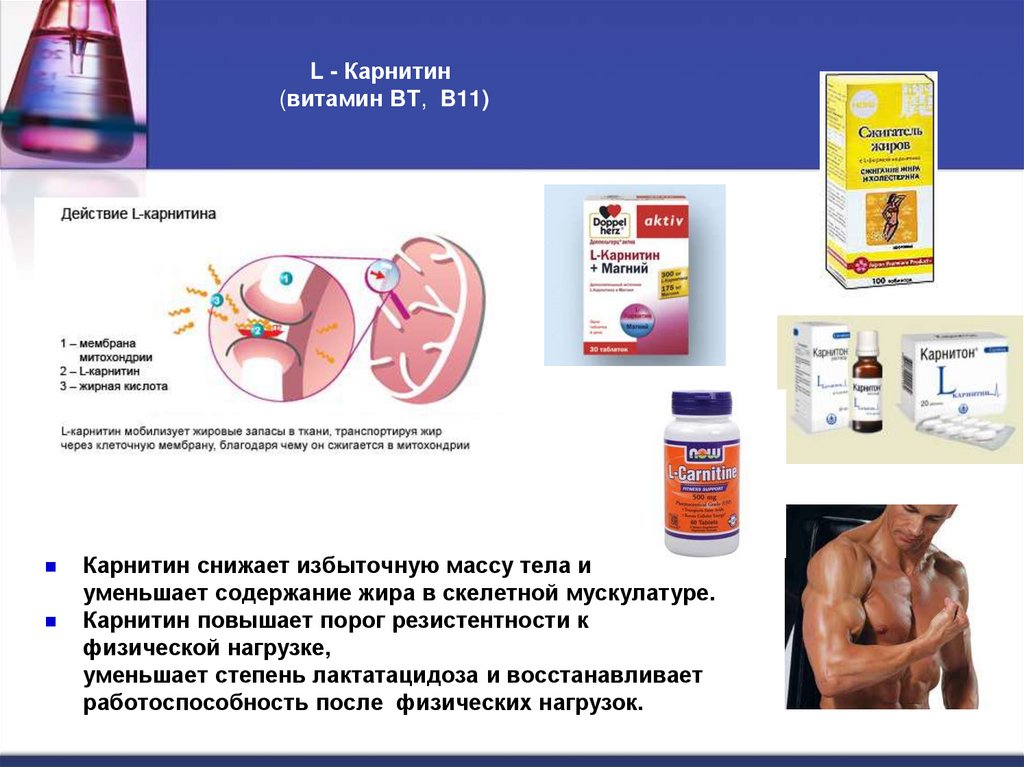
25. L - Карнитин (витамин BT, B11)
L - Карнитин(витамин BT, B11)
Карнитин снижает избыточную массу тела и
уменьшает содержание жира в скелетной мускулатуре.
Карнитин повышает порог резистентности к
физической нагрузке,
уменьшает степень лактатацидоза и восстанавливает
работоспособность после физических нагрузок.
26. Определение «β-окисление» реакции получили потому, что окисление в радикале ЖК происходит по β-углеродному атому.
Процесс β-окислениязаканчивается укорочением ЖК
на 2 углеродных атома
(образуется ацетил-КоА).
4 реакции процесса:
- дегидрирование (QH2),
- гидратация,
- дегидрирование (НАДН2),
- отщепление СН3-СО-КоА
называют
«циклом β-окисления»,
так как реакции повторяются
с радикалом ЖК до тех пор,
пока вся жирная кислота
не превратится в ацетил-КоА.
27.
Полное окисление ЖК включает 3 этапа:1.
2.
3.
β–окисление ЖК с образованием ацетил-КоА.
Утилизация ацетил-КоА в цикле Кребса (ЦТК).
Окисление ФАДН2 и НАДН2 в ЦПЭ с образованием Н2О и АТФ.
Энергетический баланс окисления ЖК
с четным количеством атомов углерода (С16:0)
За 1 цикл β-окислении образуются:
1 ФАДН2 → ЦПЭ → 2 АТФ
1 НАДН2 → ЦПЭ → 3 АТФ
Количество циклов (N : 2) –1
1 ацетил-КоА → ЦТК→ 12 АТФ
Количество ацетил-КоА (N : 2)
При активации ЖК затрачивается 1 АТФ.
Формула для подсчета выхода АТФ:
5 АТФ х(16:2-1) + 12 АТФ х(16:2) –1 АТФ =131 АТФ
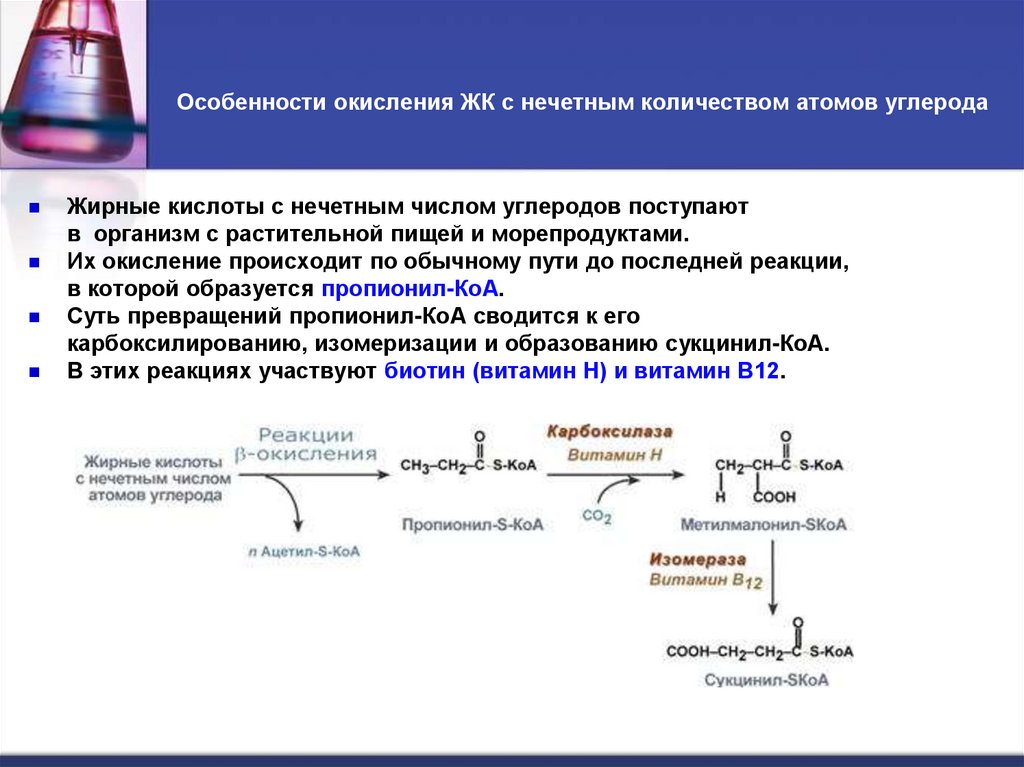
28. Особенности окисления ЖК с нечетным количеством атомов углерода
Жирные кислоты с нечетным числом углеродов поступаютв организм с растительной пищей и морепродуктами.
Их окисление происходит по обычному пути до последней реакции,
в которой образуется пропионил-КоА.
Суть превращений пропионил-КоА сводится к его
карбоксилированию, изомеризации и образованию сукцинил-КоА.
В этих реакциях участвуют биотин (витамин Н) и витамин В12.
29. Особенности окисления ненасыщенных ЖК (ПНЖК)
При окислении ненасыщенных ЖКтребуются дополнительные
ферменты (изомеразы), которые
перемещают двойные связи
из γ-положения в β-положение
и переводят природные двойные
связи из цис- в транс-положение.
Таким образом, уже имеющаяся
двойная связь готовится к
β-окислению и пропускается
первая реакция цикла,
в которой участвует QH2.
30. Регуляция скорости процесса β-окисления ЖК
Скорость процесса β-окисления зависит от ряда факторов:состояния голодания или сытости (соотношения инсулин/глюкагон);
активности регуляторного фермента карнитинацилтрансферазы I;
доступности жирных кислот;
потребности клетки в энергии;
доступности кислорода.
β-окисление становится источником энергии для мышц
только через 10-20 минут после начала физической нагрузки
(аэробные нагрузки), когда приток кислорода к тканям увеличивается.
31. «Жиры горят в пламени углеводов!»
При голодании в жировой ткани активирует распад ТАГ.Жирные кислоты выделяются в кровь и транспортируются в печень.
В печени возрастает скорость β-окисления и в митохондриях
образуется большое количество молекул ацетил-КоА.
Для утилизации молекул ацетил-КоА необходима высокая емкость цикла Кребса
(адекватное количество оксалоацетата, который синтезируется из глюкозы).
Активность цикла Кребса (ЦТК) снижается при:
голодании,
сахарном диабете,
физической нагрузке.
Так как компоненты (кислоты) цикла Кребса синтезируются из глюкозы,
справедливо выражение: «Жиры горят в пламени углеводов!»
При дефиците углеводов образующиеся в большом количестве молекулы
ацетил-КоА утилизируются в печени другим путем (синтез кетоновых тел).
32. Синтез кетоновых тел происходит в митохондриях гепатоцитов.
К кетоновым телам относятся:1. β-оксибутират (β-оксимасляная кислота)
2. ацетоацетат
(ацетоуксусная кислота)
3. ацетон (образуется в крови неферментативно)
Регуляторный фермент синтеза
кетоновых тел ГМГ- КоА-синтетаза:
- индуцируют высокие концентрации ЖК,
- ингибируют высокие концентрации НS-КоА.
33. Кетоновые тела транспортируются кровью из печени и активно окисляются во многих тканях (в том числе, в нервной ткани).
Преимущество окисления кетоновых тел по сравнению с ЖК:1. кетоновые тела водорастворимы, а ЖК – нет (нужен альбумин);
2. ЖК разобщают тканевое дыхание и окислительное фосфорилирование,
а кетоновые тела – нет!
34. Биологическая роль окисления кетоновых тел.
КТ окисляются в аэробных тканях,обеспечивая синтез АТФ.
Окисление β-оксибутирата
обеспечивает синтез 24 АТФ.
Окисление кетоновых тел
сберегает глюкозу,
что имеет большое значение в
энергоснабжении аэробных
тканей (ЦНС) при голодании и
физических нагрузках.
Ацетон не утилизируется тканями,
выделяется с выдыхаемым воздухом
(мочой, слюной, потом), что позволяет
организму избавляться от избытка
кетоновых тел, которые не успели
вовремя окислится.
35. В норме концентрация кетоновых тел в крови составляет около ~ 0,2 ммоль/л, но может значительно увеличиваться. Кетоацидоз.
При длительном голодании и особеннопри сахарном диабете в крови существенно
возрастает концентрация кетоновых тел
и организм не успевает их утилизировать.
Увеличение концентрации кетоновых тел
в крови получило определение как кетонемия.
Следствием кетонемии является кетонурия выделение кетоновых тел с мочой.
При накоплении кетоновых тел
развивается кетоацидоз, т. к. ацетоацетат и
β-гидроксибутират - легко диссоцирующие кислоты:
36. Ацидоз достигает опасных величин при сахарном диабете
Тяжёлая форма ацидоза — одна из основных причин смерти присахарном диабете (кетонемическая кома).
37. Липогенез. Биосинтез жирных кислот.
В организме человека постоянно протекает биосинтез заменимых ЖК.Насыщенные ЖК образуются быстро и в большом количестве из
ацетил–КоА.
Любое вещество, способное давать ацетил-КоА,
является потенциальным источником для синтеза ЖК:
- избыточное количество глюкозы,
- некоторые аминокислоты (кетогенные).
Организм может накапливать жир при содержании на безжировой диете!
Основные органы, синтезирующие ЖК:
печень, жировая ткань, слизистая кишечника, молочная железа, легкие.
Синтез ЖК происходит в цитозоле клеток.
Субстратами для синтеза ЖК являются продукты катаболизма глюкозы,
поэтому процесс происходит при высокой концентрации глюкозы
в крови в абсорбтивный период.
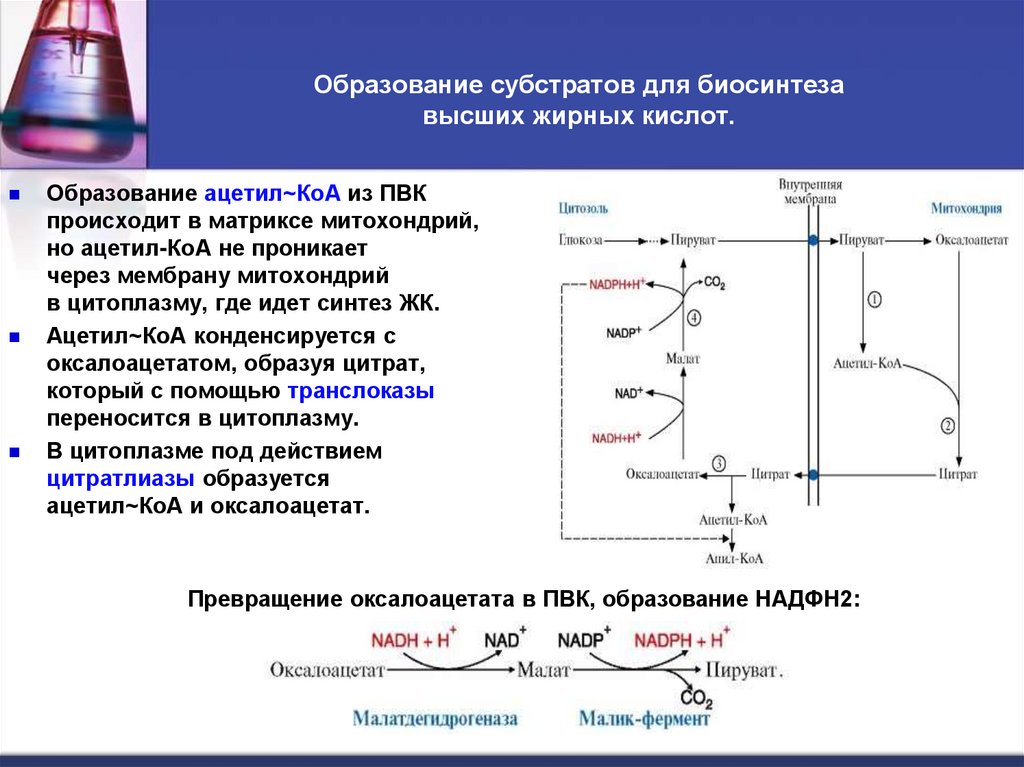
38. Образование субстратов для биосинтеза высших жирных кислот.
Образование субстратов для биосинтезавысших жирных кислот.
Образование ацетил~КоА из ПВК
происходит в матриксе митохондрий,
но ацетил-КоА не проникает
через мембрану митохондрий
в цитоплазму, где идет синтез ЖК.
Ацетил~КоА конденсируется с
оксалоацетатом, образуя цитрат,
который с помощью транслоказы
переносится в цитоплазму.
В цитоплазме под действием
цитратлиазы образуется
ацетил~КоА и оксалоацетат.
Превращение оксалоацетата в ПВК, образование НАДФН2:
39. Реакции синтеза ЖК катализируются пальмитатсинтазой (синтез С16:0)
Пальмитатсиназа - полифункциональный фермент, состоящий из2 идентичных полипептидных цепей, каждая из которых имеет
7 активных центров и ацилпереносящий белок, который переносит
растущую цепь ЖК из одного активного центра в другой.
Каждый из белков имеет 2 центра связывания, содержащих SHгруппы.
Первая реакция синтеза ЖК превращение ацетил-КоА в малонил-КоА.
Фермент ацетил–КоА-карбоксилаза
(Класс VI: Лигазы. Кофермент – биотин или витамин Н).
Фермент является регуляторным в биосинтезе ЖК
(активатор – инсулин, ингибитор – глюкагон)
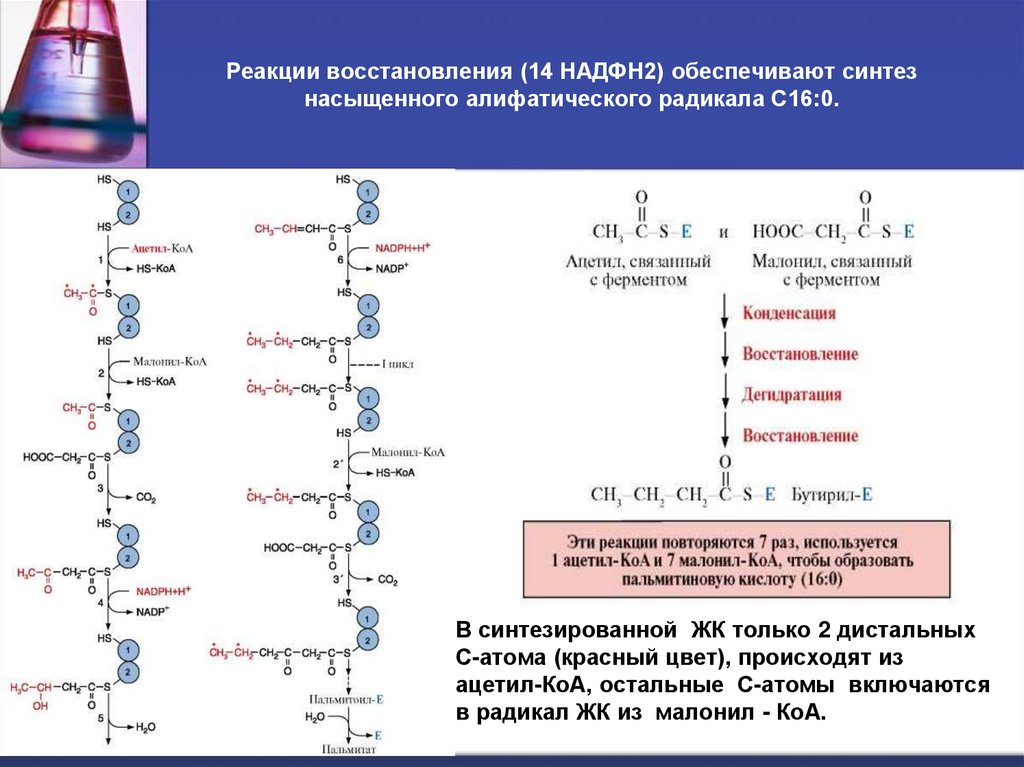
40. Реакции восстановления (14 НАДФН2) обеспечивают синтез насыщенного алифатического радикала С16:0.
В синтезированной ЖК только 2 дистальныхС-атома (красный цвет), происходят из
ацетил-КоА, остальные С-атомы включаются
в радикал ЖК из малонил - КоА.
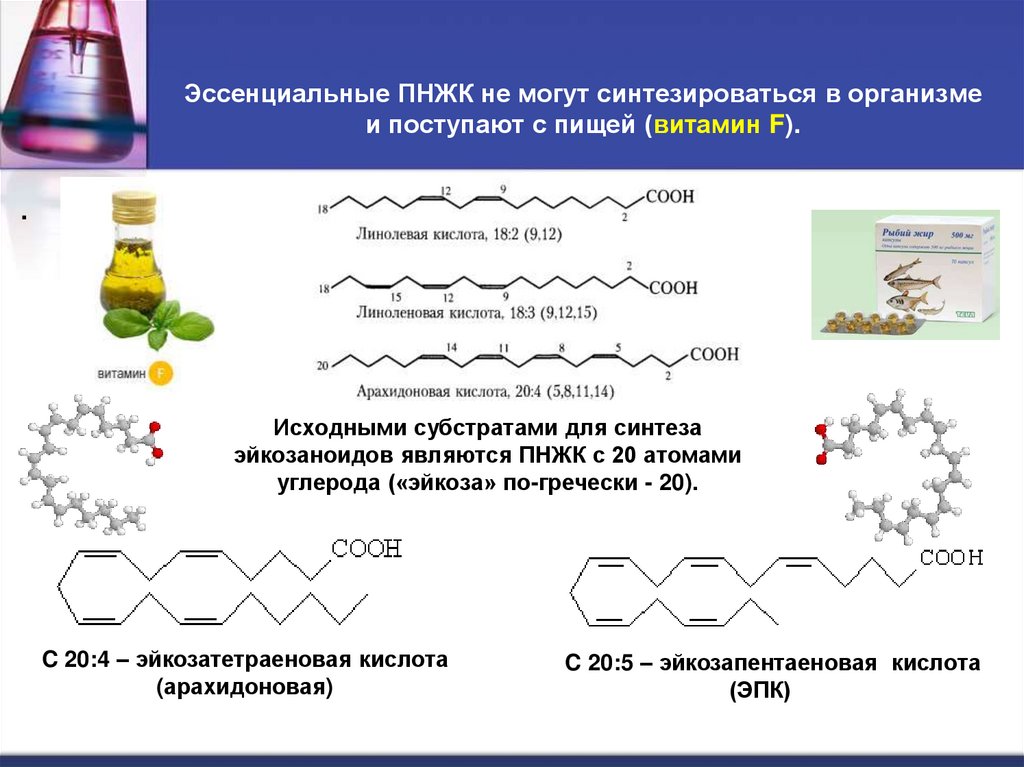
41. Эссенциальные ПНЖК не могут синтезироваться в организме и поступают с пищей (витамин F).
.Исходными субстратами для синтеза
эйкозаноидов являются ПНЖК с 20 атомами
углерода («эйкоза» по-гречески - 20).
C 20:4 – эйкозатетраеновая кислота
(арахидоновая)
C 20:5 – эйкозапентаеновая кислота
(ЭПК)
42. Эйкозаноиды – окисленные производные ПНЖК (С20)
Эйкозаноиды - это большая группа веществ, которые синтезируютсявсеми клетками (кроме эритроцитов!).
Эйкозаноиды как гормоны местного действия оказывают эффекты
по паракринному или аутокринному механизму через специфические
рецепторы.
Главные биологические эффекты эйкозаноидов:
участвуют в регуляции сокращений гладкой мускулатуры
(вызывают вазоконстрикцию или вазодилатацию,
бронхоконстрикцию или бронходилатацию);
регулируют экскрецию воды и Na+ почками и артериальное давление;
участвуют в развитии воспаления;
регулируют свертываемость крови.
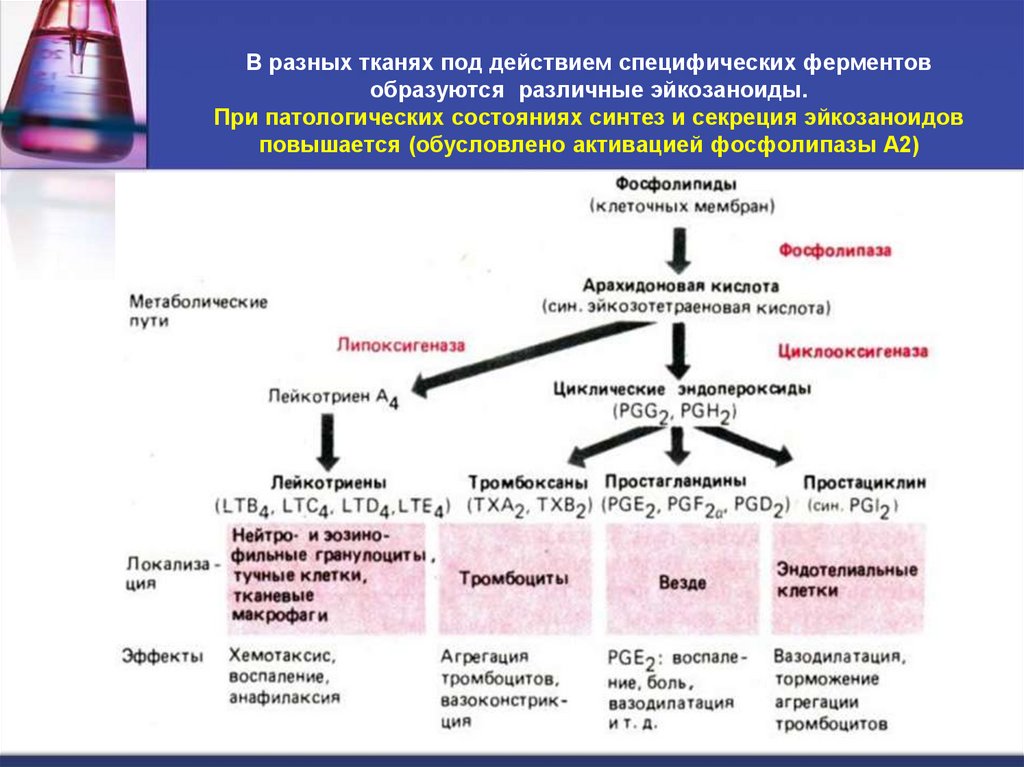
Основные классы эйкозаноидов:
Простагландины PG (включая простациклины);
Тромбоксаны (Tx) ;
Лейкотриены (LT).
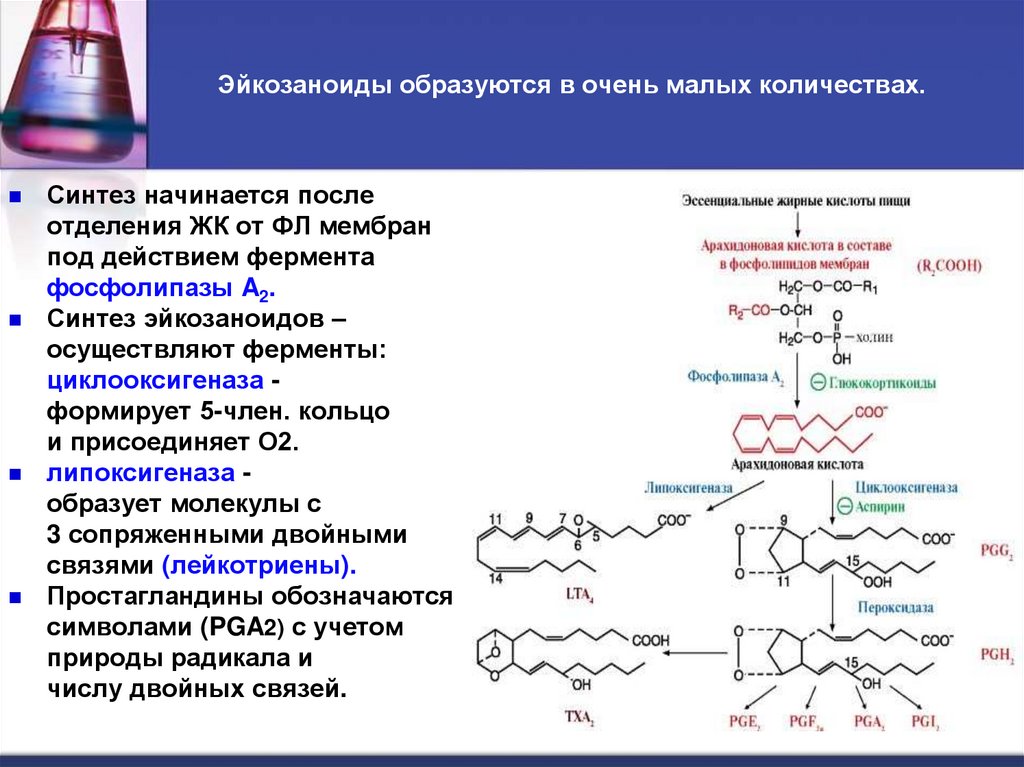
43. Эйкозаноиды образуются в очень малых количествах.
Синтез начинается послеотделения ЖК от ФЛ мембран
под действием фермента
фосфолипазы A2.
Синтез эйкозаноидов –
осуществляют ферменты:
циклооксигеназа формирует 5-член. кольцо
и присоединяет О2.
липоксигеназа образует молекулы с
3 сопряженными двойными
связями (лейкотриены).
Простагландины обозначаются
символами (PGA2) с учетом
природы радикала и
числу двойных связей.
44. В разных тканях под действием специфических ферментов образуются различные эйкозаноиды. При патологических состояниях синтез и
В разных тканях под действием специфических ферментовобразуются различные эйкозаноиды.
При патологических состояниях синтез и секреция эйкозаноидов
повышается (обусловлено активацией фосфолипазы А2)
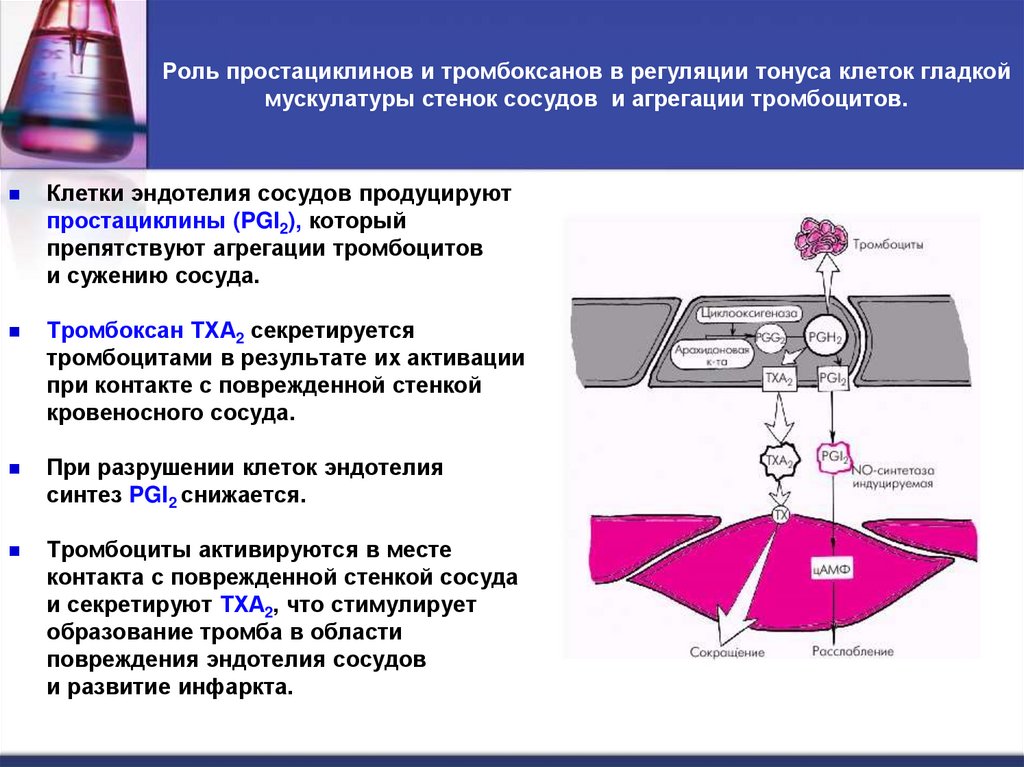
45. Роль простациклинов и тромбоксанов в регуляции тонуса клеток гладкой мускулатуры стенок сосудов и агрегации тромбоцитов.
Клетки эндотелия сосудов продуцируютпростациклины (PGI2), который
препятствуют агрегации тромбоцитов
и сужению сосуда.
Тромбоксан ТХА2 секретируется
тромбоцитами в результате их активации
при контакте с поврежденной стенкой
кровеносного сосуда.
При разрушении клеток эндотелия
синтез PGI2 снижается.
Тромбоциты активируются в месте
контакта с поврежденной стенкой сосуда
и секретируют ТХА2, что стимулирует
образование тромба в области
повреждения эндотелия сосудов
и развитие инфаркта.
46. Влияние факторов питания на синтез эйкозаноидов.
При преобладании в рационе арахидоновой кислоты (С20:4 ω-6)образуются ТХА2, стимулирующий агрегацию тромбоцитов.
Если в рационе преобладают ω-3-ПНЖК, то в клетках эндотелия образуются
более сильные ингибиторы тромбообразования, что снижает риск образования
тромба и развития инфаркта миокарда.
47. Противовоспалительные препараты, снижающие синтез эйкозаноидов
Стероидные гормоны(или их аналоги)
стимулируют синтез белков –
липокортинов, ингибирующих
фосфолипазу А2.
Нестероидные
противовоспалительные
препараты ингибиторы ЦОГ (аспирин и др.).
W-3 ПНЖК (ЭПК) –
рыбий жир, морепродукты
































 Химия
Химия








