Похожие презентации:
Термодинамика. Лекция 1
1. литература
1-ХЗА-8С (ХВА-19С)1-ХЗА-8С
литература
Пособия и справочники
1.
Холохонова Л.И. и др. «Законы термодинамики и химическое
Методическое пособие.
равновесие».
2. « Справочник физико-химических величин» под ред. Равделя А.А.
Учебники
• Ерёмин В. В. и др. « Основы физической химии», т1, т2.
• П. Эткинс, Дж. де Паула «Физическая химия»
• (т.1. Равновесная термодинамика), 2007
Адреса ОБЛАКОВ
https://cloud.mail.ru/public/ks36/hdpXgnSiR
курсовая раб для 2-ХВА-22,7
https://cloud.mail.ru/public/EhpE/Jf815Btp3
ХЗА-8С (ХВА-19С)
2. Для 1-ого аудиторного занятия
Принести на занятие
литературу 1, 4, 5.
тетрадь (48 листов в твёрдой обложке),
тетрадь (12 листов в мягкой обложке),
калькулятор,
флешку,
ноутбук,
лабораторный халат.
3. Основные разделы курса
ТермодинамикаХимическая кинетика
Фазовые
равновесия и
растворы
Электрохимия
4. От тепловых двигателей до космологии
Изобретение парового двигателя породило новую науку –ТЕРМОДИНАМИКУ
Как из теплоты возникает
движение?
Карно Сади
1824
Сейчас термодинамика превратилась
в одну из важнейших теорий
современного естествознания,
описывающую в обобщённом виде
любые изменения состояния
вещества во Вселенной
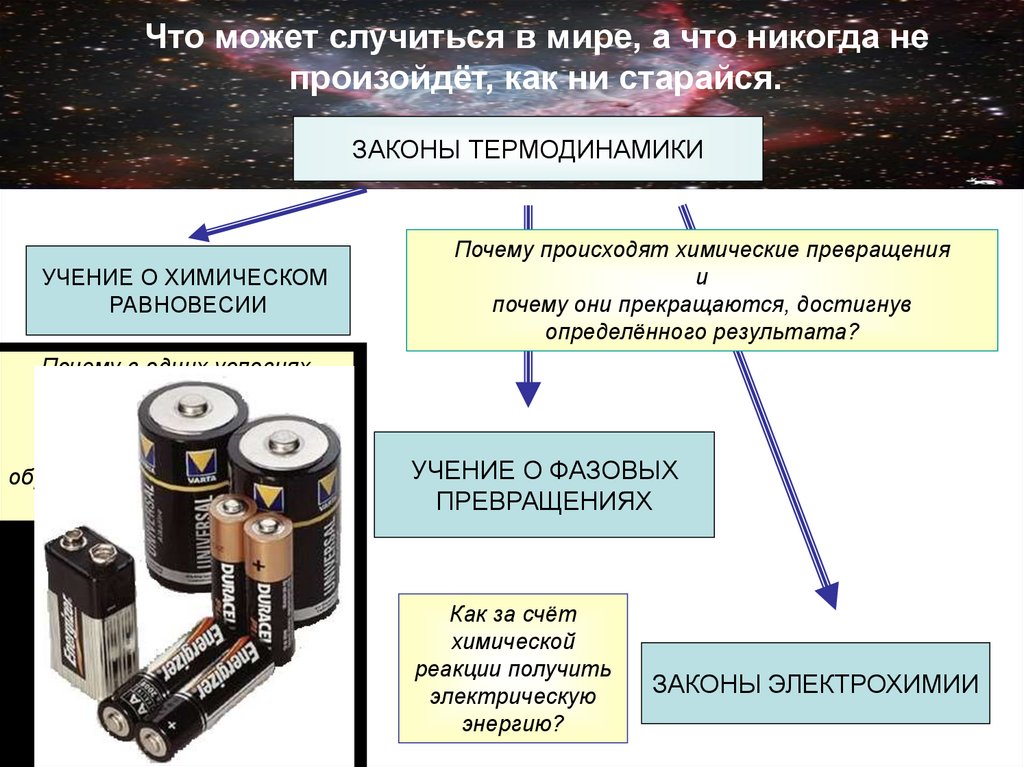
5. Что может случиться в мире, а что никогда не произойдёт, как ни старайся.
ЗАКОНЫ ТЕРМОДИНАМИКИУЧЕНИЕ О ХИМИЧЕСКОМ
РАВНОВЕСИИ
Почему в одних условиях
вещество предпочитает
находиться
в жидкой фазе, а в других
образовывать кристаллы или
превращаться в газ?
Почему происходят химические превращения
и
почему они прекращаются, достигнув
определённого результата?
УЧЕНИЕ О ФАЗОВЫХ
ПРЕВРАЩЕНИЯХ
Как за счёт
химической
реакции получить
электрическую
энергию?
ЗАКОНЫ ЭЛЕКТРОХИМИИ
6. Химическая термодинамика
ГерманГельмгольц
Рудольф Иванович Гесс
Джозайя У.Гиббс
Рудольф Клаузис
7. Термодинамическая система - часть Вселенной, которую мы собираемся изучать. Всё остальное – окружающая среда.
8. ЗАПОМНИ ГЛАВНОЕ
Термодинамическаясистема
может находиться
в равновесном состоянии
(пока система находится в
равновесном состоянии её
свойства никак и никогда не
меняются, т.е. не происходят
никакие термодинамические
процессы)
в неравновесном состоянии
в состоянии
близком к равновесному
в сильно
неравновесной
состоянии
( самопроизвольно
идут процессы, приводящие
систему к равновесию)
(могут
происходить
совершенно
потрясающие
вещи!)
То, что невозможно реализовать в равновесных состояниях,
9. Колебательные реакции
Реакция Белоусова - Жаботинского и биокомпьютеры10. Лауреат Нобелевской премии по химии - Даниэль Шехтманн
Лауреат Нобелевской премии по химии Даниэль ШехтманнВ декабре 1984 года появилось сообщение о
получении кристаллоподобного сплава с
необычными свойствами.
С этого момента стало бурно развиваться
новое направление физики
конденсированного состояния - область
некристаллографических структур,
принципиально отличающаяся от области
не только кристаллов, но и аморфных тел и
жидкостей.
исследование образований с икосаэдрической симметрией привело к пересмотру
многих представлений ученых о структуре и свойствах веществ
Квазикристаллы, плитки Пенроуза,
пентагональная симметрия,
додекаэдры, икосаэдры
11. ЗАПОМНИ ГЛАВНОЕ
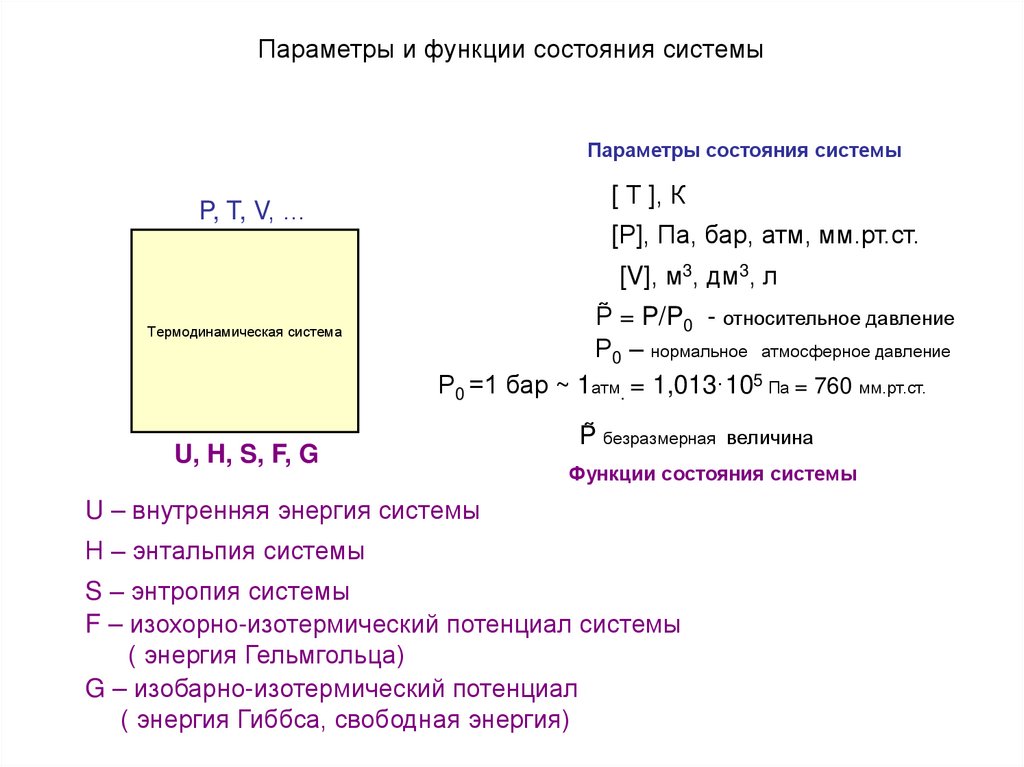
Каждая система обладает энергией и знтропией12. Параметры и функции состояния системы
Параметры состояния системы[ Т ], К
P, T, V, …
[Р], Па, бар, атм, мм.рт.ст.
[V], м3, дм3, л
Термодинамическая система
P̃ = P/P0 - относительное давление
Р0 – нормальное атмосферное давление
Р0 =1 бар ~ 1атм. = 1,013·105 Па = 760 мм.рт.ст.
U, H, S, F, G
P̃ безразмерная величина
Функции состояния системы
U – внутренняя энергия системы
Н – энтальпия системы
S – энтропия системы
F – изохорно-изотермический потенциал системы
( энергия Гельмгольца)
G – изобарно-изотермический потенциал
( энергия Гиббса, свободная энергия)
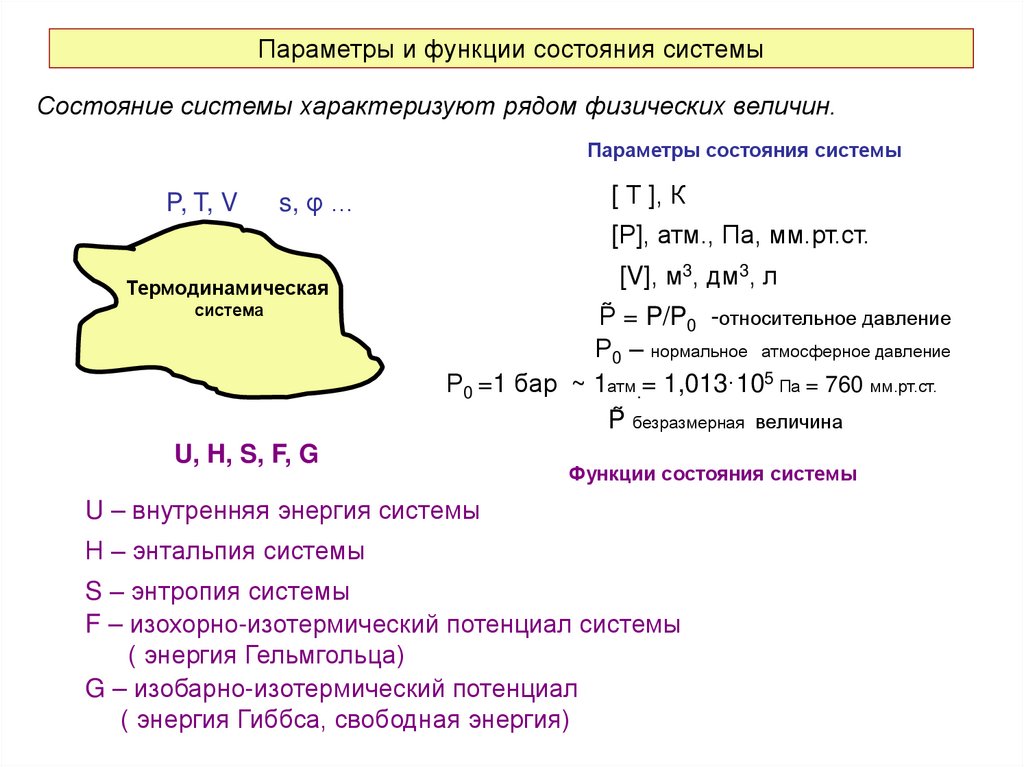
13. Параметры и функции состояния системы
Состояние системы характеризуют рядом физических величин.Параметры состояния системы
P, T, V
[ Т ], К
s, φ …
[Р], атм., Па, мм.рт.ст.
[V], м3, дм3, л
Термодинамическая
система
P̃ = P/P0 -относительное давление
Р0 – нормальное атмосферное давление
Р0 =1 бар ~ 1атм.= 1,013·105 Па = 760 мм.рт.ст.
P̃ безразмерная величина
U, H, S, F, G
Функции состояния системы
U – внутренняя энергия системы
Н – энтальпия системы
S – энтропия системы
F – изохорно-изотермический потенциал системы
( энергия Гельмгольца)
G – изобарно-изотермический потенциал
( энергия Гиббса, свободная энергия)
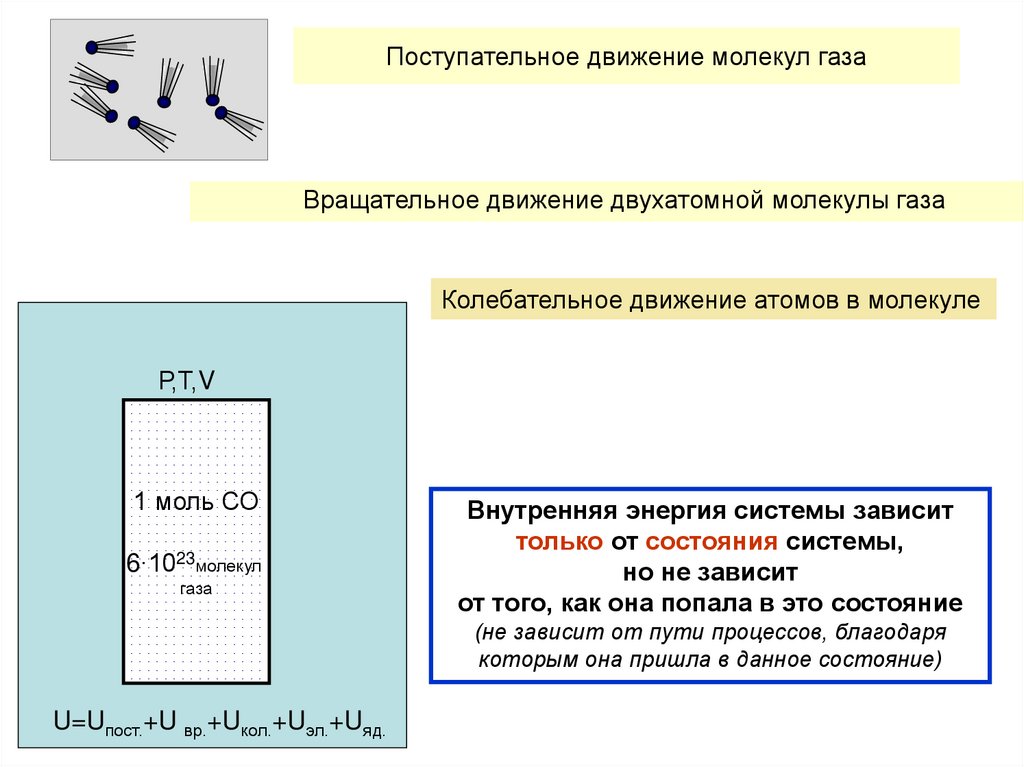
14. Внутренняя энергия системы - совокупность всех видов энергии, которыми обладает система, за исключением кинетической и
потенциальной энергии системы в целом.пример
Система: 1 моль ( 6·1023 молекул ) двухатомного газа, например СО
СО
1 моль
U
15. Поступательное и вращательное движение молекул газа
16. Колебательное движение атомов двухатомной молекулы
CОC=О
17. Поступательное движение молекул газа
Вращательное движение двухатомной молекулы газаКолебательное движение атомов в молекуле
Р,Т,V
1 моль СО
6∙1023молекул
газа
Внутренняя энергия системы зависит
только от состояния системы,
но не зависит
от того, как она попала в это состояние
(не зависит от пути процессов, благодаря
которым она пришла в данное состояние)
U=Uпост.+U вр.+Uкол.+Uэл.+Uяд.
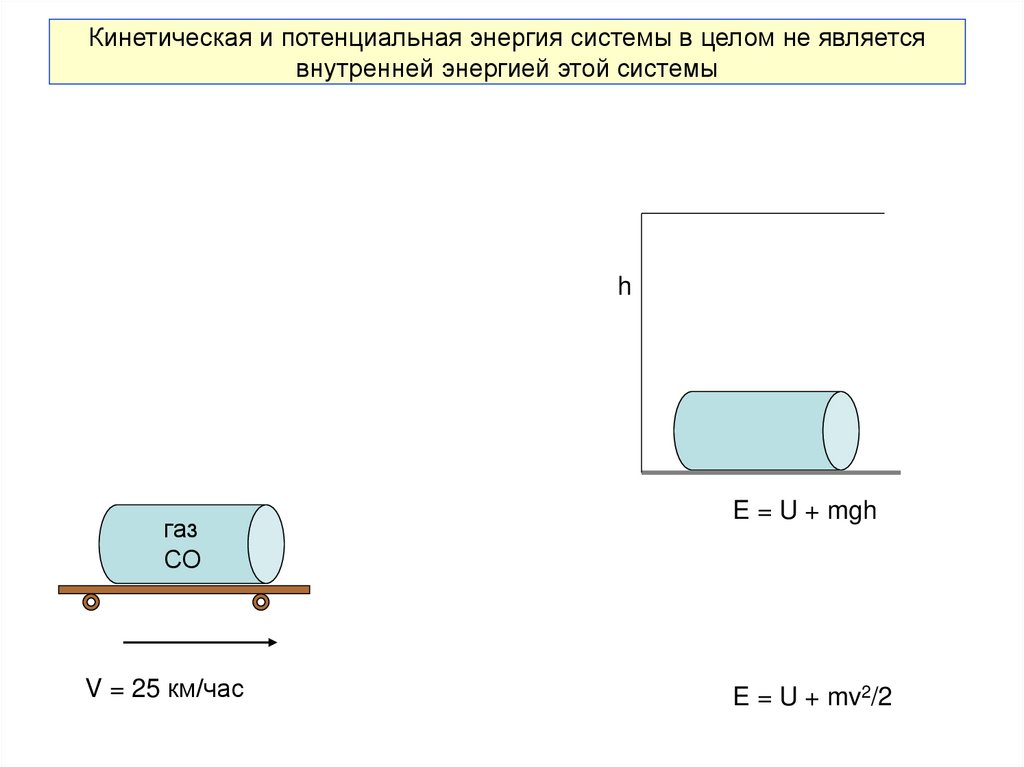
18. Кинетическая и потенциальная энергия системы в целом не является внутренней энергией этой системы
hгаз
СО
V = 25 км/час
E = U + mgh
E = U + mv2/2
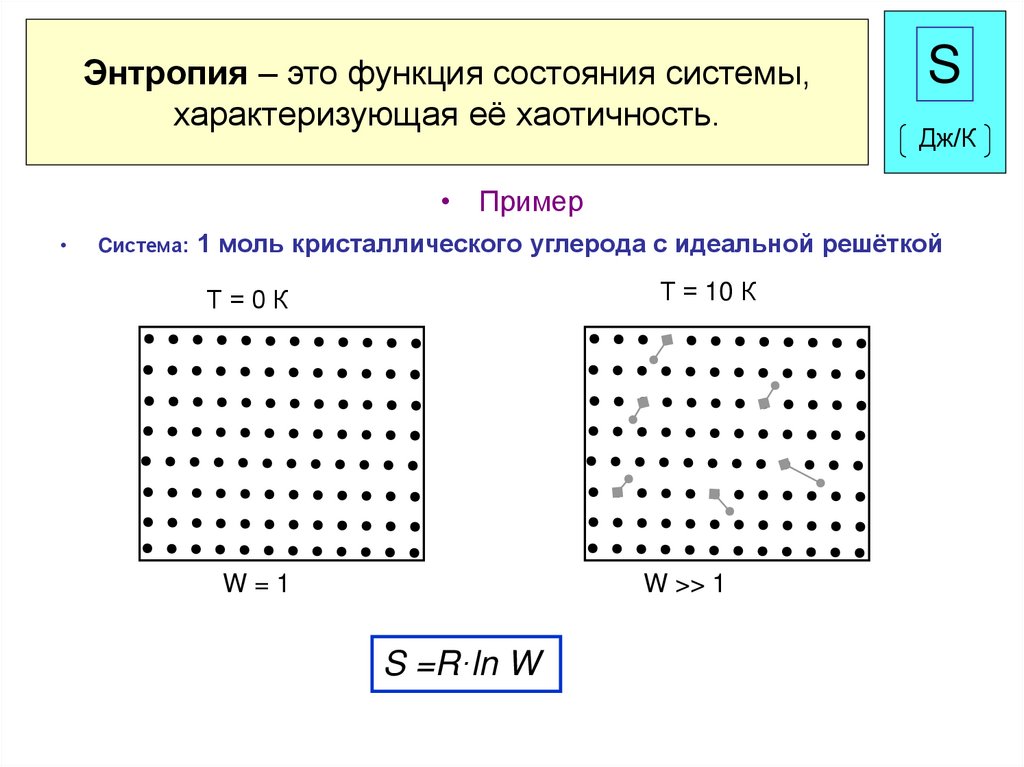
19. Энтропия – это функция состояния системы, характеризующая её хаотичность.
SДж/К
• Пример
Cистема: 1 моль кристаллического углерода с идеальной решёткой
Т=0К
Т = 10 К
W=1
W >> 1
S =R·ln W
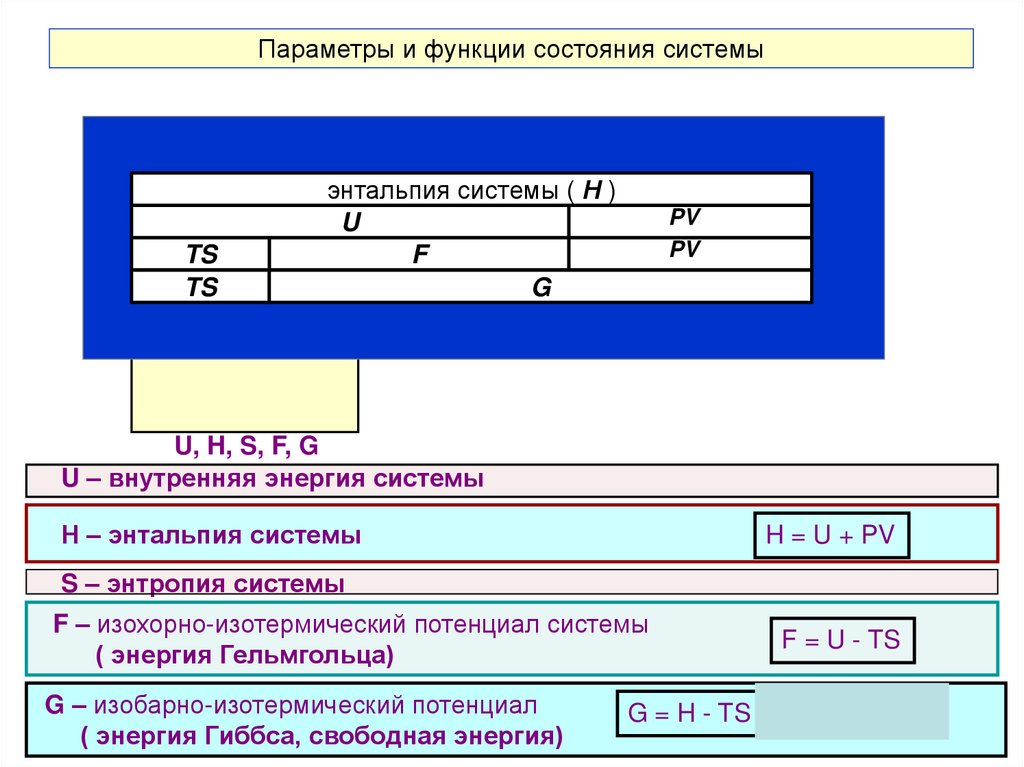
20. Параметры и функции состояния системы
P, T, VTS
TS
энтальпия системы ( Н )
U
F
G
PV
PV
Термодинамическая
система
U, H, S, F, G
U – внутренняя энергия системы
Н – энтальпия системы
H = U + PV
S – энтропия системы
F – изохорно-изотермический потенциал системы
( энергия Гельмгольца)
G – изобарно-изотермический потенциал
( энергия Гиббса, свободная энергия)
F = U - TS
G = H - TS = U + PV - TS
21. Теплота и работа термодинамического процесса
В результате контакта системы сокружающей средой энергия системы
может измениться.
КАК
система
может
изменить свою
энергию?
обменяться
тепловой
энергией
преодолеть
какие-то
внешние
силы:
изменить
себя и
окружающую
среду, т.е.
совершить
работу
против
внешних сил
22. Что нужно знать о теплоте и работе процессов
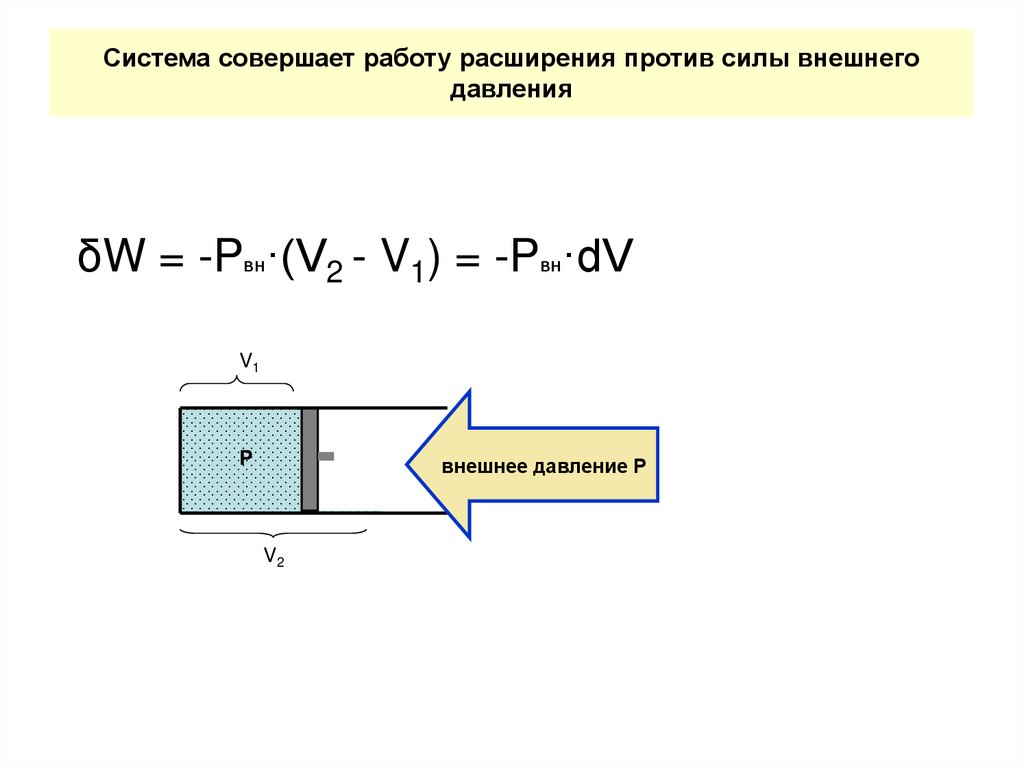
23. Система совершает работу расширения против силы внешнего давления
δW = -Pвн·(V2 - V1) = -Pвн·dVV1
P
внешнее давление Р
V2
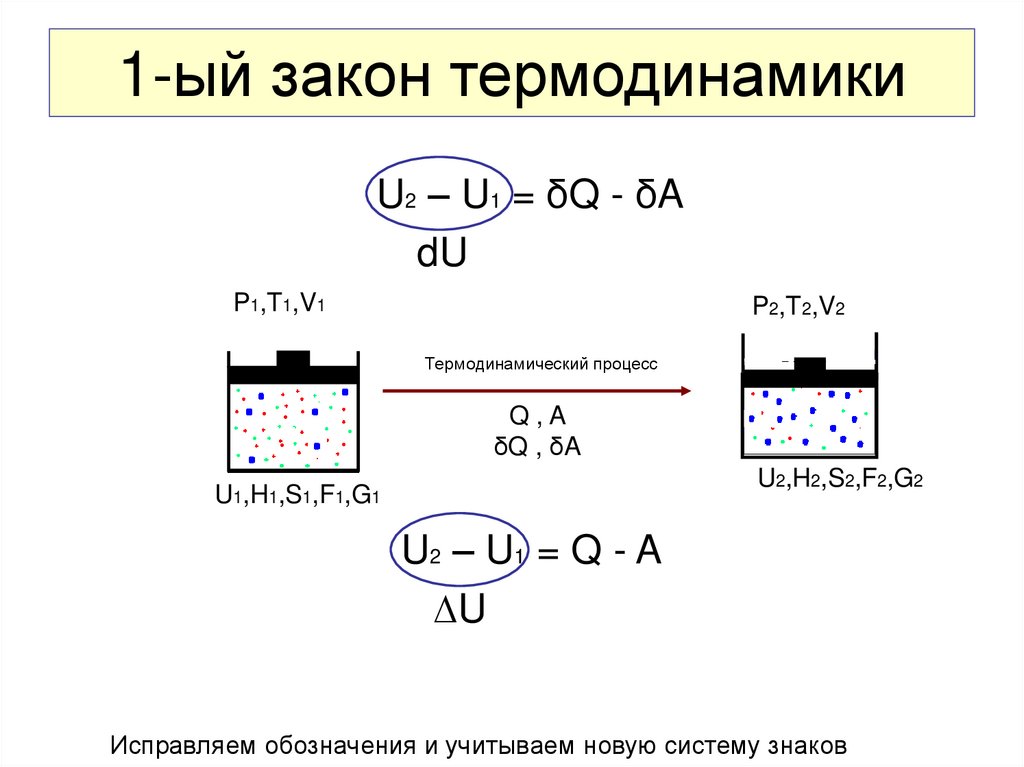
24. 1-ый закон термодинамики
U2 – U1 = δQ - δAdU
P1,T1,V1
P2,T2,V2
Термодинамический процесс
Q,A
δQ , δA
U2,H2,S2,F2,G2
U1,H1,S1,F1,G1
U2 – U1 = Q - A
∆U
Исправляем обозначения и учитываем новую систему знаков
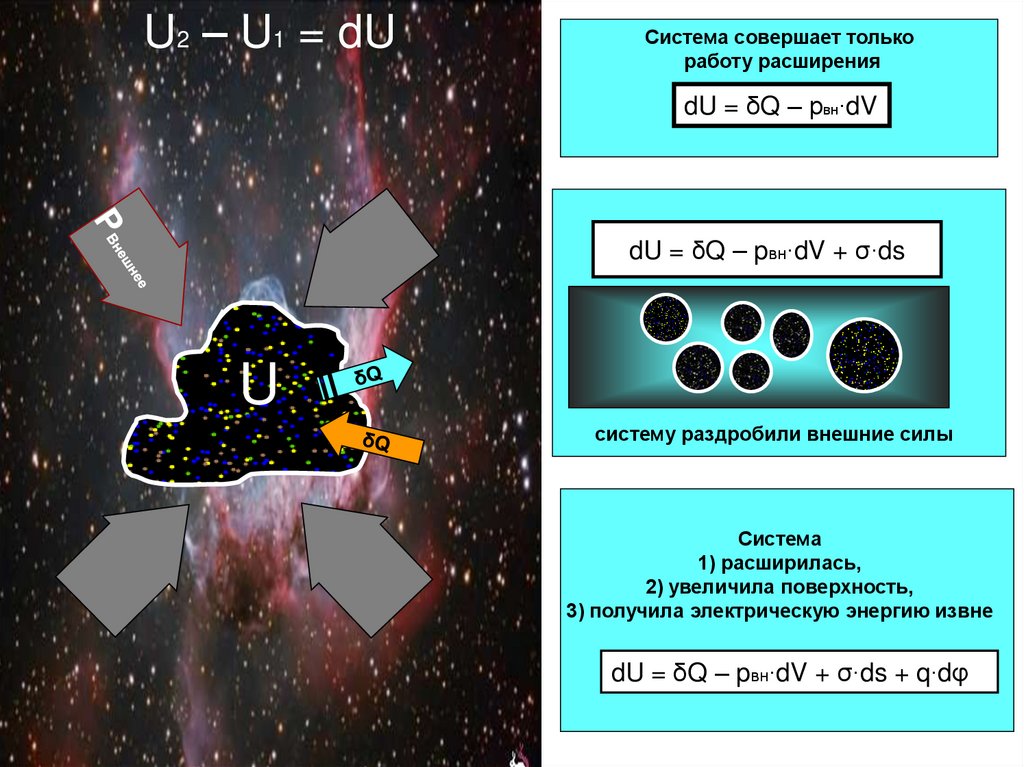
25. dU = δQ – pвн∙dV + σ∙ds
U2 – U1 = dUСистема совершает только
работу расширения
dU = δQ – рвн∙dV
dU = δQ – pвн∙dV + σ∙ds
U
систему раздробили внешние силы
Система
1) расширилась,
2) увеличила поверхность,
3) получила электрическую энергию извне
dU = δQ – pвн∙dV + σ∙ds + q∙dφ
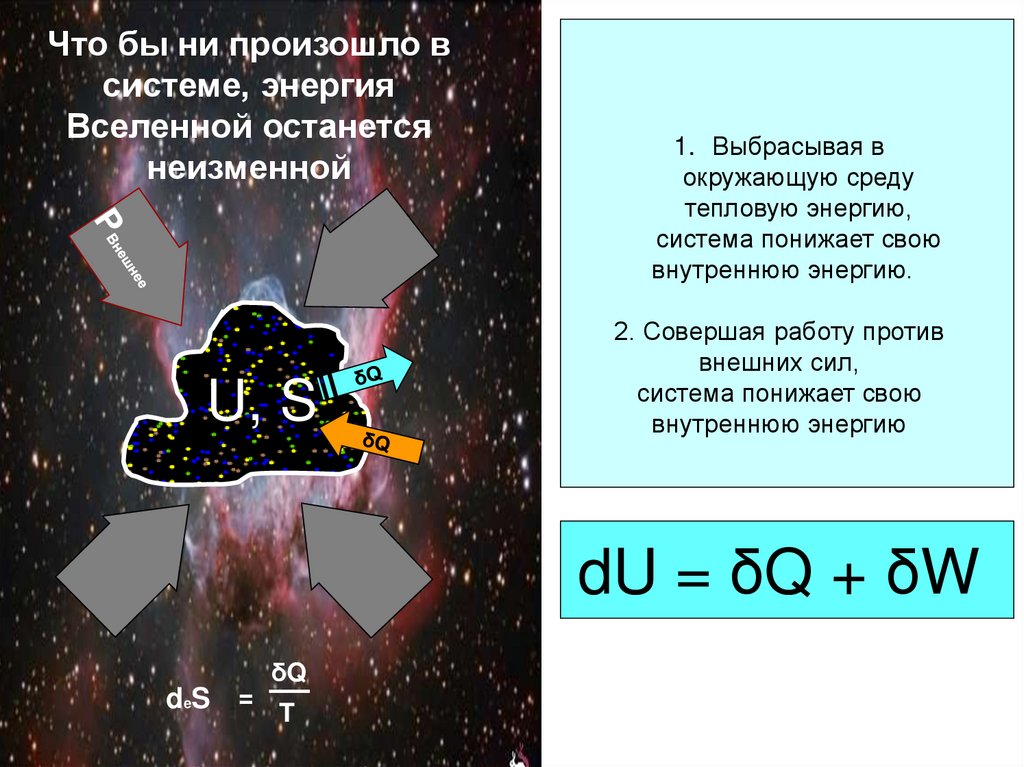
26. Что бы ни произошло в системе, энергия Вселенной останется неизменной
U, S1. Выбрасывая в
окружающую среду
тепловую энергию,
система понижает свою
внутреннюю энергию.
2. Совершая работу против
внешних сил,
система понижает свою
внутреннюю энергию
dU = δQ + δW
δQ
deS = T
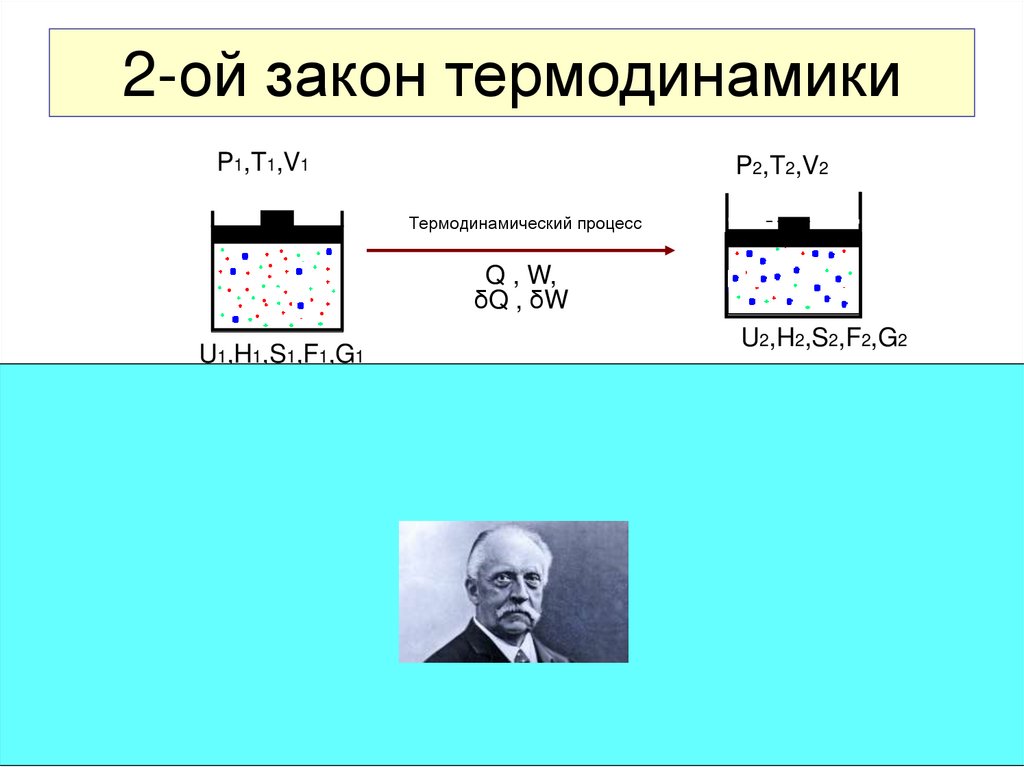
27. 2-ой закон термодинамики
P1,T1,V1P2,T2,V2
Термодинамический процесс
Q , W,
δQ , δW
U2,H2,S2,F2,G2
U1,H1,S1,F1,G1
для любого
самопроизвольного процесса
протекающего неравновесным путём
(необратимо)
S2 – S1
dS
>
протекающего равновесным путём
(обратимо)
δQ
T
S2 – S1
знаменитое
неравенство Клаузиуса
dS
=
δQ
T
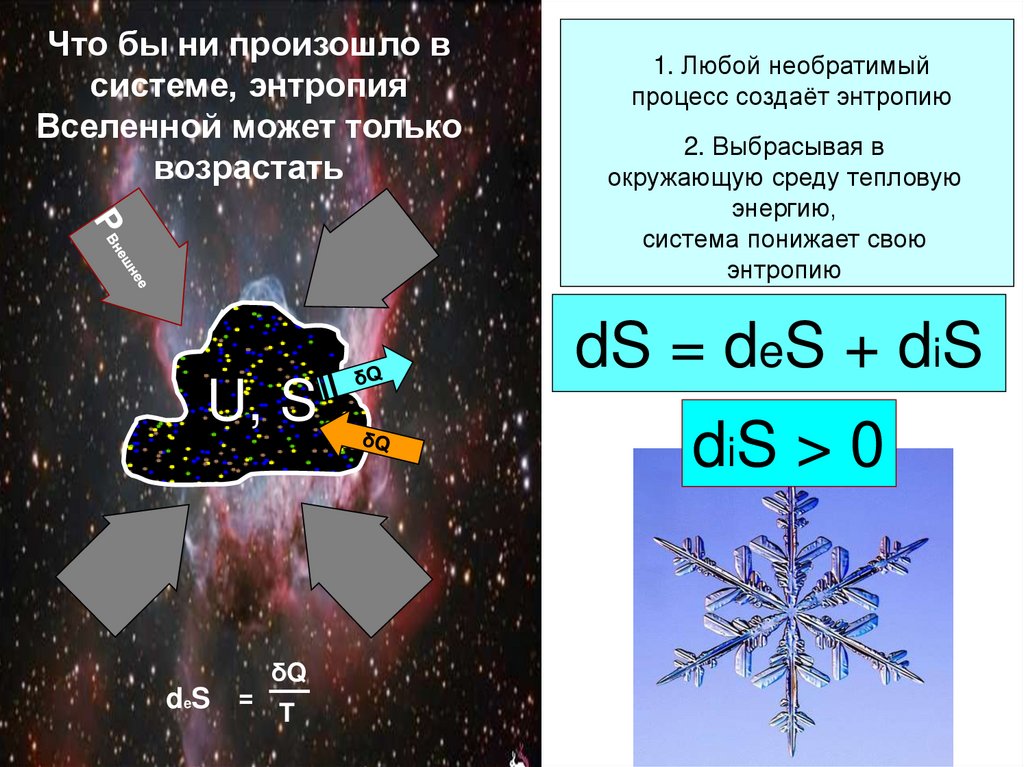
28. Что бы ни произошло в системе, энтропия Вселенной может только возрастать
U, SδQ
deS = T
1. Любой необратимый
процесс создаёт энтропию
2. Выбрасывая в
окружающую среду тепловую
энергию,
система понижает свою
энтропию
dS = deS + diS
diS > 0
29. 2-ой закон термодинамики
Неразбериха в обществе постоянно возрастает.Только очень упорным трудом можно несколько ее
уменьшить. Однако сама эта попытка приведет к
росту совокупной неразберихи
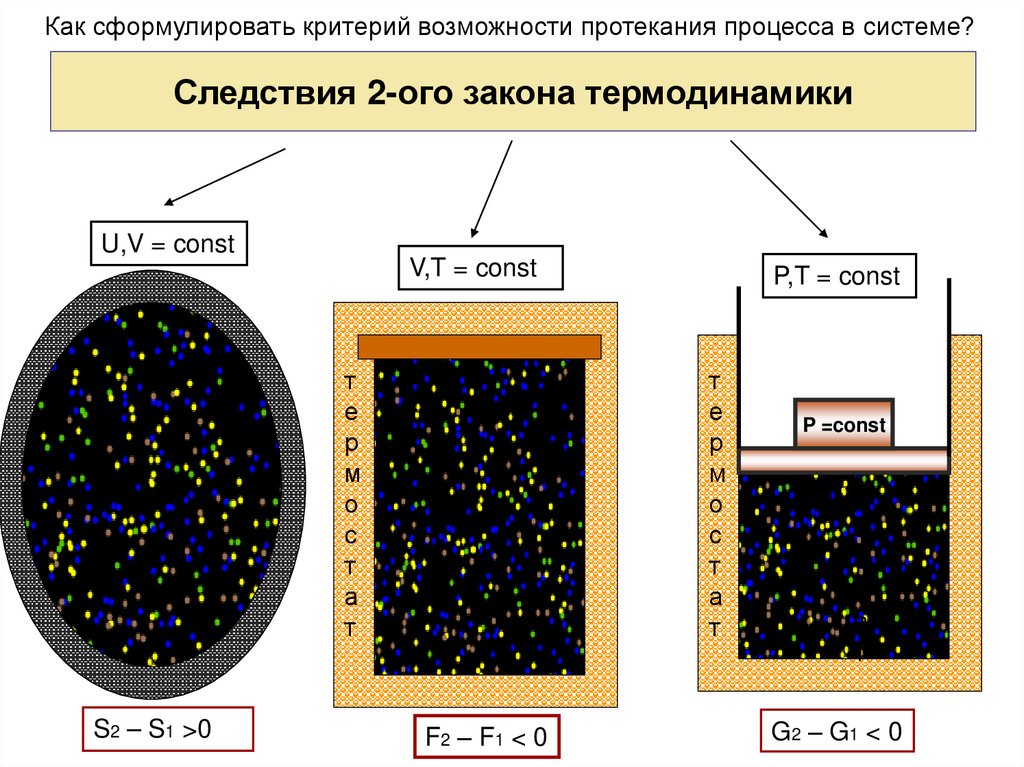
30. Следствия 2-ого закона термодинамики
Как сформулировать критерий возможности протекания процесса в системе?Следствия 2-ого закона термодинамики
U,V = const
V,T = const
т
е
р
м
о
с
т
а
т
S2 – S1 >0
P,T = const
т
е
р
м
о
с
т
а
т
F2 – F1 < 0
т
е
р
м
о
с
т
а
т
P =const
G2 – G1 < 0
31. доказательства
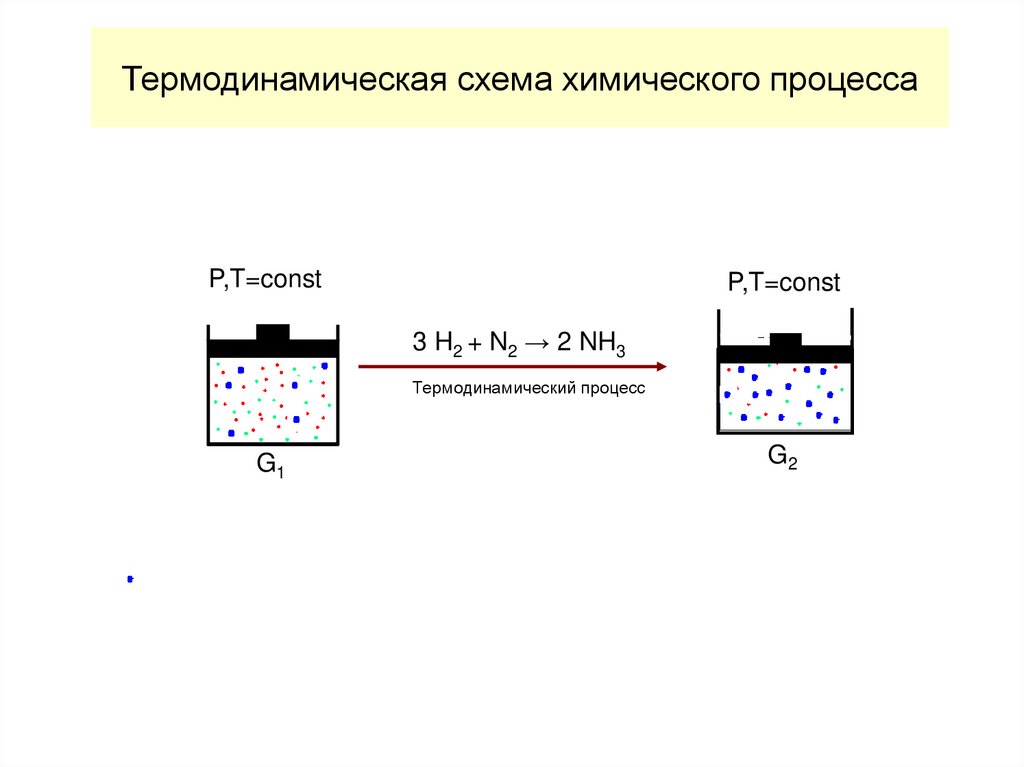
Перейти к другому файлу32. Термодинамическая схема химического процесса
P,T=constP,T=const
3 H2 + N2 → 2 NH3
Термодинамический процесс
G1
G2
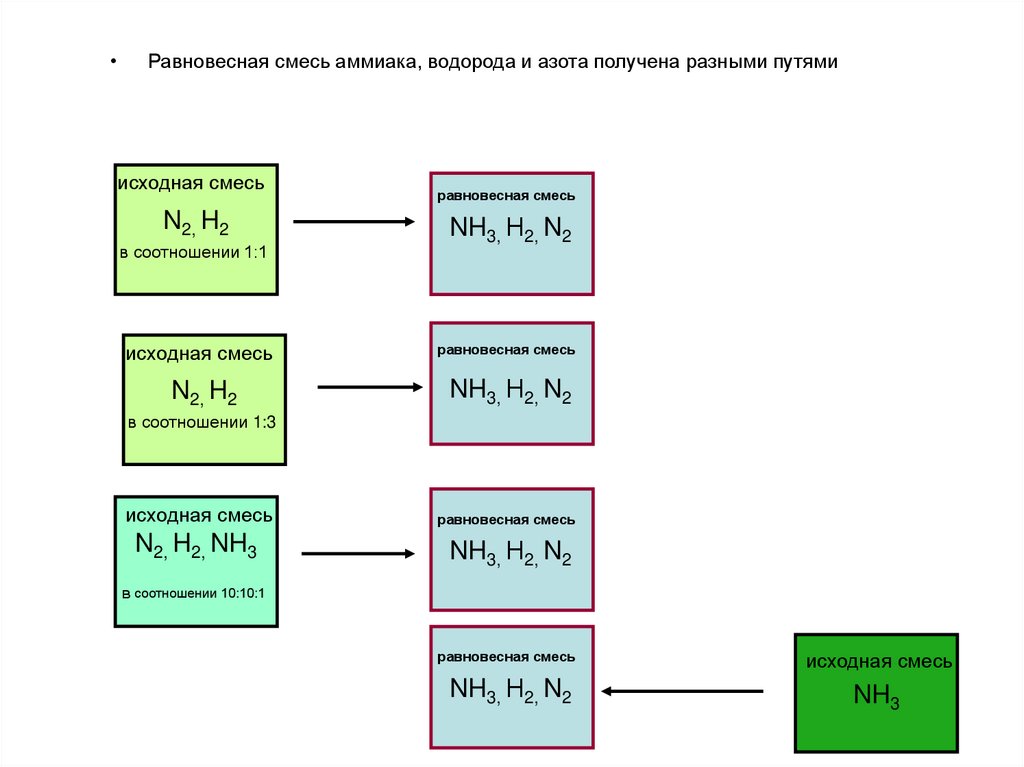
33.
Равновесная смесь аммиака, водорода и азота получена разными путями
исходная смесь
N2, H2
в соотношении 1:1
равновесная смесь
NH3, Н2, N2
исходная смесь
равновесная смесь
N2, H2
NH3, Н2, N2
в соотношении 1:3
исходная смесь
равновесная смесь
N2, H2, NH3
NH3, Н2, N2
в соотношении 10:10:1
равновесная смесь
исходная смесь
NH3, Н2, N2
NH3
34.
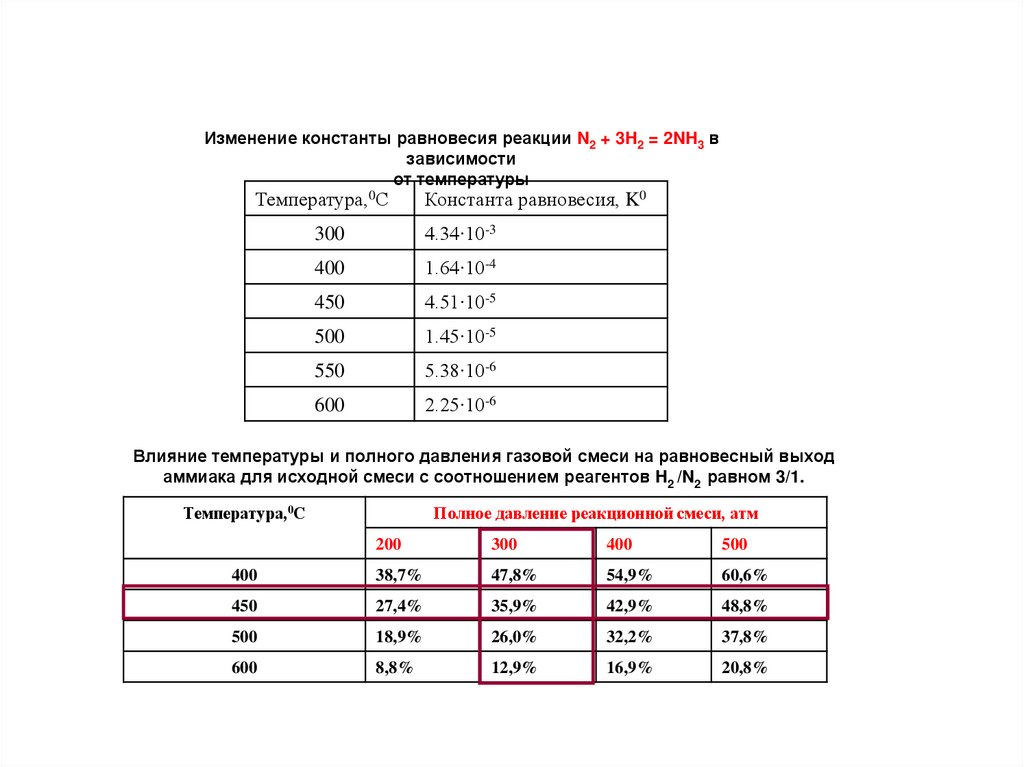
Изменение константы равновесия реакции N2 + 3H2 = 2NH3 взависимости
от температуры
Температура,0С
Константа равновесия, K0
300
4.34∙10-3
400
1.64∙10-4
450
4.51∙10-5
500
1.45∙10-5
550
5.38∙10-6
600
2.25∙10-6
Влияние температуры и полного давления газовой смеси на равновесный выход
аммиака для исходной смеси с соотношением реагентов H2 /N2 равном 3/1.
Температура,0С
Полное давление реакционной смеси, атм
200
300
400
500
400
38,7%
47,8%
54,9%
60,6%
450
27,4%
35,9%
42,9%
48,8%
500
18,9%
26,0%
32,2%
37,8%
600
8,8%
12,9%
16,9%
20,8%
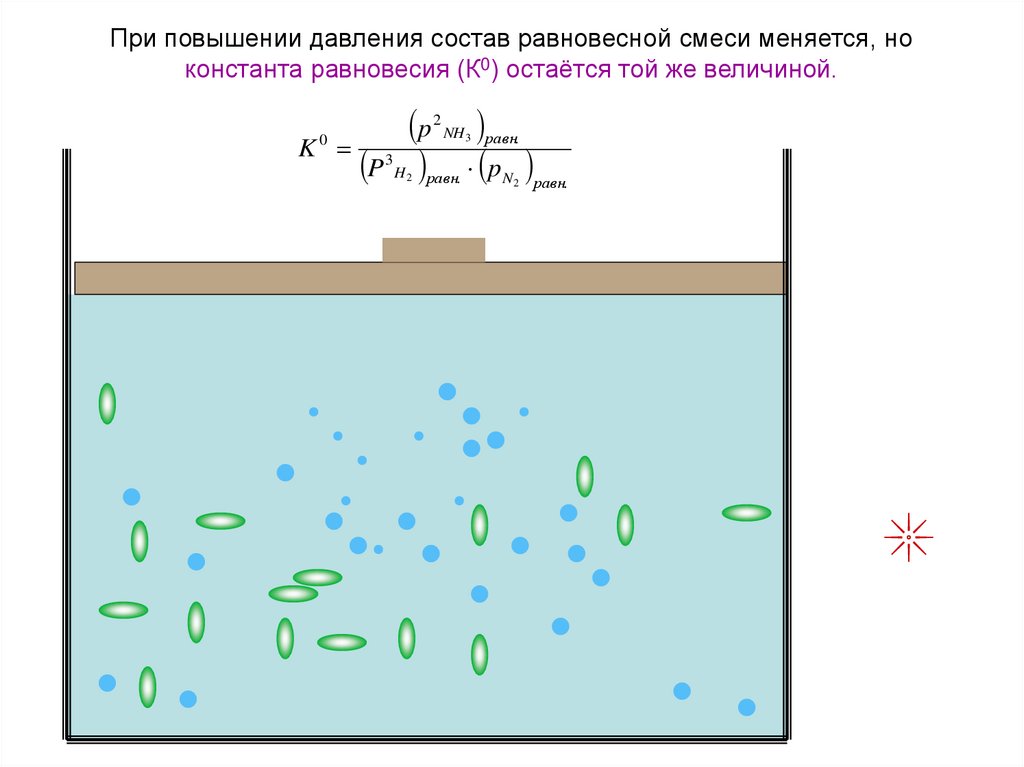
35. При повышении давления состав равновесной смеси меняется, но константа равновесия (К0) остаётся той же величиной.
pK
P
0
3
2
p
NH 3 равн.
H 2 равн.
N 2 равн.
36.
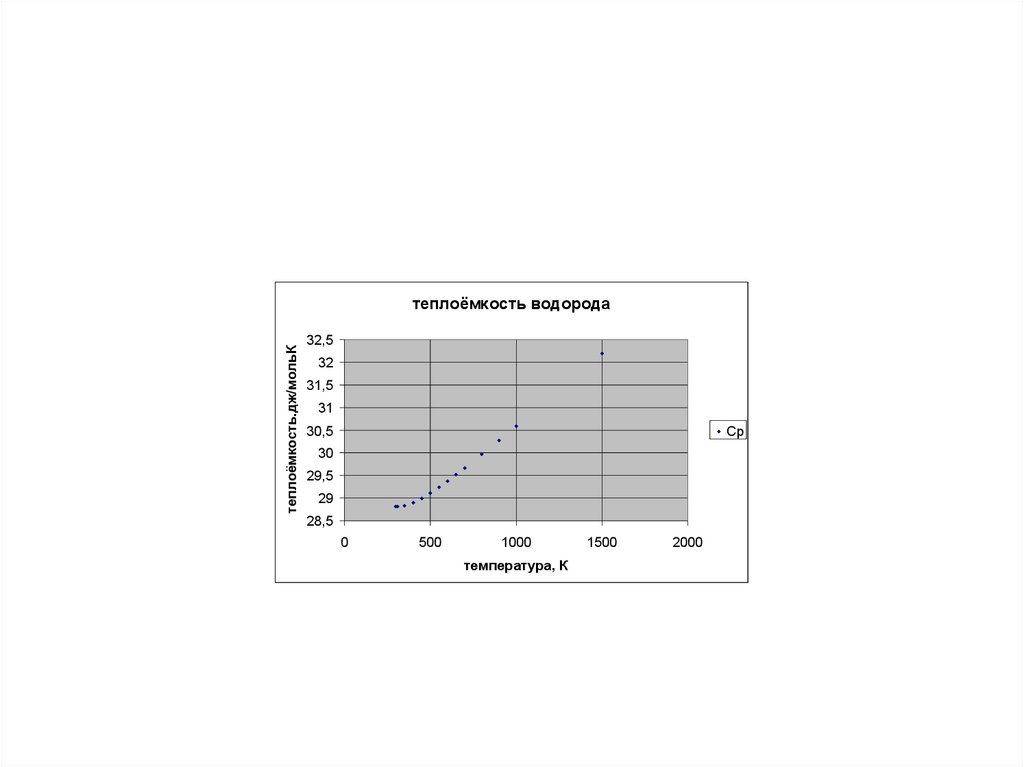
теплоёмкость.дж/мольКтеплоёмкость водорода
32,5
32
31,5
31
30,5
Cp
30
29,5
29
28,5
0
500
1000
температура, К
1500
2000
37.
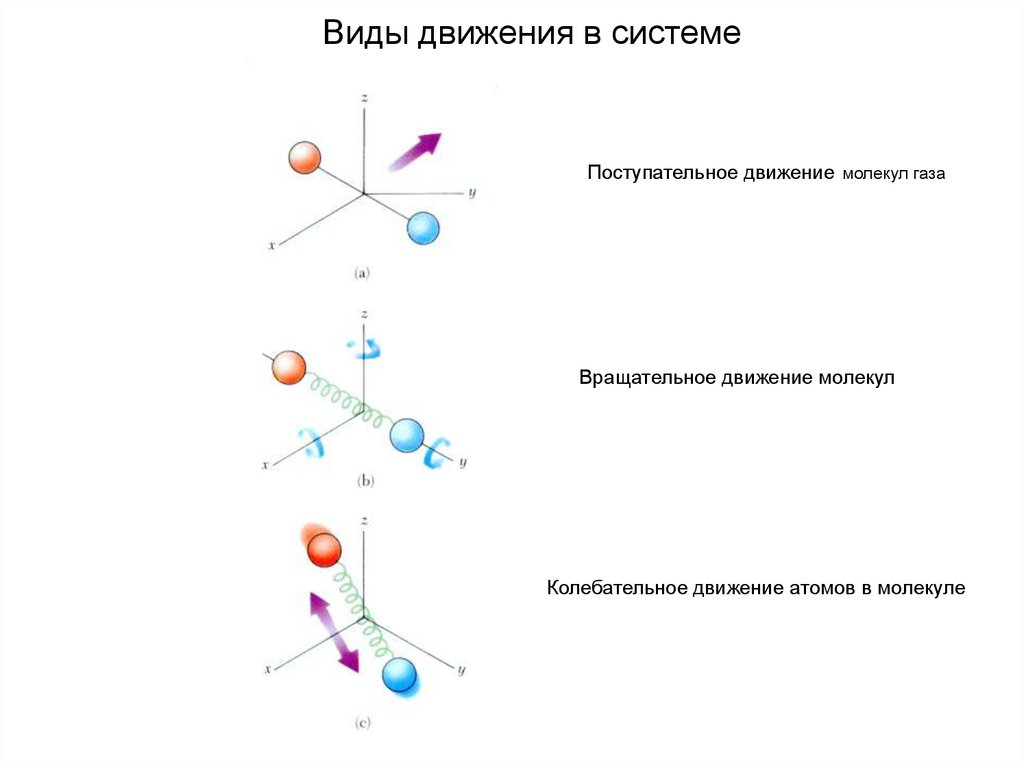
38. Виды движения в системе
Поступательное движение молекул газаВращательное движение молекул
Колебательное движение атомов в молекуле

















 Физика
Физика Химия
Химия








