Похожие презентации:
Химическая термодинамика
1. Химическая термодинамика
Лекцияк.х.н., доцента Мартыновой Т.В.
Химическая термодинамика
Длительность лекции 4 часа
2. Химическая термодинамика
изучает закономерности превращенияэнергии из одной формы в другую
• Объект исследования термодинамики:
Система – тело или группа тел,
находящихся во взаимодействии, и
мысленно или с помощью поверхности
выделенных из окружающей среды.
3. Основные понятия и определения
• Система, внутри которой нет поверхностираздела, и одинаковая по свойствам во всех
своих точках - гомогенная.
• Система, внутри которой есть поверхность
раздела - гетерогенная (например, лед – вода).
• По характеру обмена с окружающей средой
веществом и энергией система может быть:
1)изолированная – не обменивающаяся с
окружающей средой веществом и энергией;
2)закрытая – обменивающаяся только энергией,
3)открытая – обменивающаяся с окружающей
средой веществом и энергией.
4. Состояние системы
• определяется термодинамическими параметрами:1) экстенсивные параметры (пропорциональные
количеству вещества) – объем, масса, плотность,
концентрация, заряд, площадь поверхности;
2) интенсивные параметры (аналоги сил) –
температура, давление, электрический потенциал,
поверхностное натяжение.
• может быть: равновесное и неравновесное
Равновесное состояние - параметры системы не
изменяются во времени при отсутствии внешних
воздействий.
5. Процесс – изменение параметров состояния
• Виды процессов:1) изотермический (Т = const);
2) изобарный (р = const);
3) изохорный (V = const);
4) адиабатический (без обмена теплотой между
системой и внешней средой);
5) изобарно-изотермический (р=const и Т=const);
6) изохорно-изотермический(V=const и Т=const);
7) круговой процесс (цикл).
6. Процессы могут быть
• обратимыми, протекающими бесконечномедленно, при бесконечно малом различии
интенсивных параметров, допускающими
возвращение системы в исходное состояние без
затраты энергии;
• необратимыми, неудовлетворяющими
условиям обратимости.
• Свойство равновесных обратимых процессов:
работа, совершаемая системой при переходе из
начального состояния в конечное – максимальна,
а затрачиваемая на обратный процесс –
минимальна.
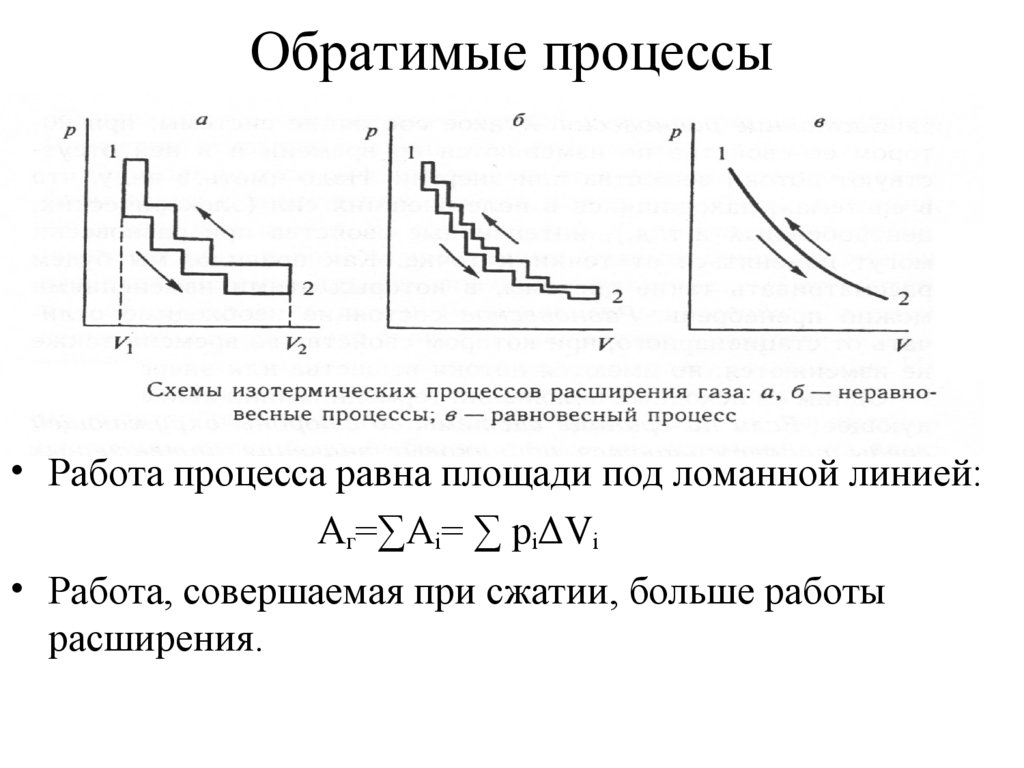
7. Обратимые процессы
• Работа процесса равна площади под ломанной линией:Aг=∑Ai= ∑ piΔVi
• Работа, совершаемая при сжатии, больше работы
расширения.
8. Термодинамические свойства системы
описываются функциями состояния :• 1) Внутренняя энергия (U) - энергии всех
видов движения и взаимодействия частиц
системы (молекул, атомов, ядер, электронов,
протонов, нейтронов и т. д.) кроме
кинетической энергии движения самой системы
и потенциальной энергии положения ее в поле
тяготения.
• Изменение внутренней энергии ( U) в процессе
перехода системы из одного состояние в другое
можно измерить.
9. Первый закон термодинамики
• Поглощаемая системой теплота (q) расходуется наувеличение внутренней энергии ( U) и совершение
работы против внешних сил (A) :
q = U + A.
• Теплота – форма передачи энергии путем столкновения
молекул (микрочастиц) соприкасающихся тел (+q –
поглощение, -q – выделение)
• Работа – макроскопическая форма передачи энергии,
преодоление внешних сил, нарушавших равновесие в
системе, согласованным, однонаправленным движением
частиц.
(+А – работа системы против внешних сил, -А – работа над системой).
10. Термохимические уравнения:
• При V=constZn(к)+H2SO4(р-р)= ZnSO4(р-р)+H2(г)+165,7 (кДж)
• При p=const
Zn(к)+H2SO4(р-р)= ZnSO4(р-р)+H2(г)+162,2 (кДж)
___________
3,5 кДж
11. Реакция при постоянном объеме
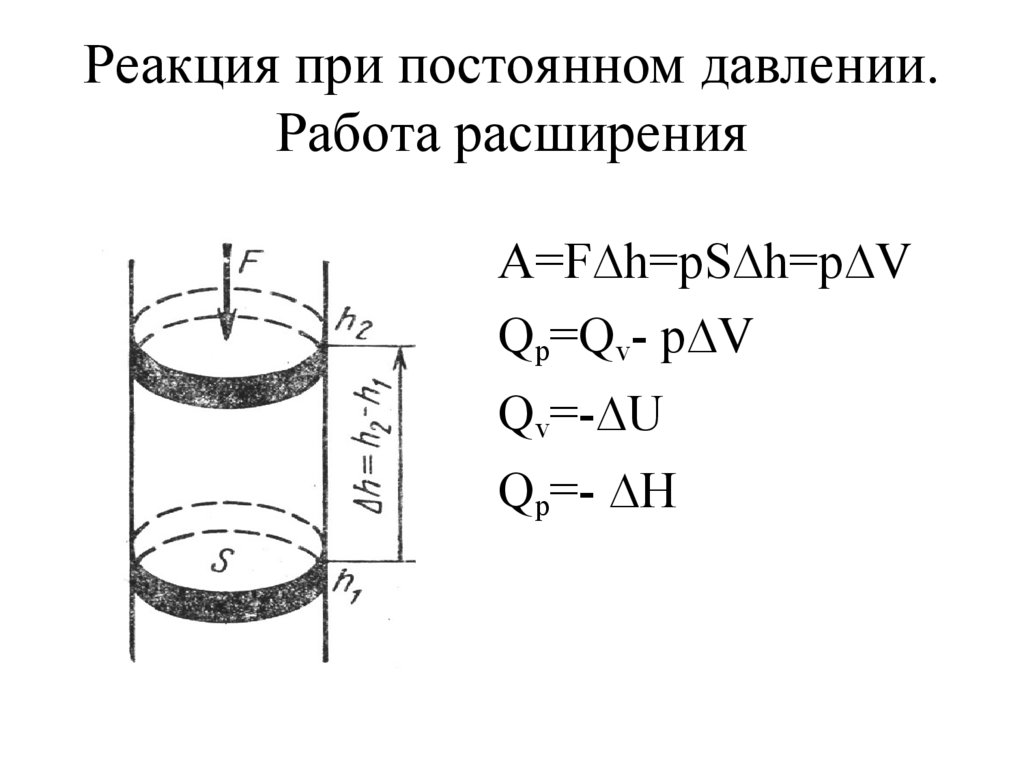
12. Реакция при постоянном давлении. Работа расширения
A=F∆h=pS∆h=p∆VQp=Qv- p∆V
Qv=-∆U
Qp=- ∆H
13. 2) Энтальпия (∆Н)
- функция состояния, характеризующаяизменение общей энергии системы при
p=const.
Н = U + p V
• Тепловой эффект реакции при р = const
равен изменению энтальпии : Нр
Нр 0 – экзотермическая реакция,
Нр 0 – эндотермическая реакция.
14. Стандартная энтальпия образования -тепловой эффект образования 1 моль вещества из простых веществ, устойчивых при стандартных
Стандартная энтальпия образования тепловой эффект образования 1 мольвещества из простых веществ,
устойчивых при стандартных условиях.
Ноf,298 или Нообр,298.
• Ноf,298(простых в-в) = 0
• Стандартные условия: р=101 кПа, t=25оС (298 К)
15. Энтальпийная диаграмма образования воды
ход реакции• H2(г)+1/2O2(г) =H2O(ж); Нр=-285,85 кДж
• H2(г) +1/2O2(г)=H2O(г); Нр=-241,84 кДж
Н конденсации = - 44,01 кДж/моль
16. Закон Гесса (1841 г)
• Изменение энтальпии зависит только от вида исостояния исходных веществ и продуктов реакции и не
зависит от пути перехода.
Следствия из закона Гесса:
Энтальпия разложения химического соединения равна энтальпии
его образования из тех же продуктов, в том же состоянии, взятой
с противоположным знаком:
Но обр,298 = - Но разл,298
Разность энтальпий реакций образования разных продуктов от
одинаковых исходных веществ равна энтальпии перехода одного
продукта в другой.
Разность энтальпий реакций, приводящих к одному продукту от
разных начальных веществ, равна энтальпии перехода одного
исходного вещества в другое.
Энтальпия реакции равна разности сумм энтальпий образования
продуктов и энтальпий образования исходных веществ:
Нр = Ноf,298 прод- Но f,298 исходн. в-в.
17. II закон термодинамики
определяет направление и предел протеканияпроцессов:
• Невозможна самопроизвольная передача тепла
от холодного тела к горячему, а только от
горячего - к холодному (Клаузиус).
• Невозможно превращение всей передаваемой
теплоты в работу, но вся работа может быть
превращена в теплоту (Томпсон).
• Невозможно создание вечного двигателя
второго рода (без передачи части тепла
холодильнику) (Оствальд).
18. Принцип Каратеодори (принцип адиабатической недостижимости некоторых состояний)
• Поглощая энергию (Q) системапереходит из состояния 1 в 2.
• Возвращение в состояние 1 путем
адиабатического процесса при
превращении всей поглощенной
энергии в работу невозможно, т.к.
это противоречит II закону.
• Сообщенная теплота меняет
состояние системы и функцию
состояния системы –
ЭНТРОПИЮ.
19. 3) Энтропия (S)
• Была введена Клаузиусом в 1865 г., какфункция, характеризующая любые
самопроизвольные изменения (приведенная
теплота):
Qобр
dS
T
• Л.Больцман связал ее с хаосом,
интерпретируя как меру
неупорядоченности системы.
20. Макросостояние системы – реализуется большим числом микросостояний, т.е. энергией и координатами каждой молекулы.
• Вероятность каждого макросостояния пропорциональначислу w микросостояний, которыми оно
осуществляется. Число микросостояний –
термодинамическая вероятность (W).
• Л.Больцман: процесс бывает самопроизвольным в тех
случаях, когда конечное состояние более вероятно, чем
начальное, т.е. может быть реализовано большим
числом микросостояний.
(направление)
• Равновесное – наиболее вероятное состояние системы,
состояние наибольшего беспорядка с максимальной
энтропией.
(предел протекания)
21.
• При объединении двух систем:W=W1W2
• При огромном числе микросостояний в системе
логарифмирование вероятностей дает небольшие
значения функций, которые будут складываться
при объединении систем:
S = R lnW, [Дж/моль К]
• Для оценки энергетических эффектов в
уравнение введена универсальная газовая
постоянная R - работа по расширению 1 моль газа
при нагревании на 1 градус, с размерностью [Дж/
моль К].
22. Второе начало термодинамики
• В изолированных системах самопроизвольно идуттолько такие процессы, которые сопровождаются
возрастанием энтропии: Sр 0 .
• Энтропия вещества в стандартном состоянии стандартная энтропия (So298)
S р S
о
продуктов
S
о
исходн .в в
23. Третье начало термодинамики
• При абсолютном нуле энтропия всех тел равнанулю.
• По мере повышения температуры растет скорость
различных видов движения частиц, т.е. число их
микросостояний, термодинамическая вероятность и
энтропия вещества возрастают. Особенно резко - при
переходе из жидкого в газообразное состояние.
• Т S (Дж/моль) – энтропийный фактор.
• Возрастание энтропии происходит при увеличении
количества вещества, объемов газов, увеличении числа
атомов в молекуле, порядкового номера элемента.
24. Движущие силы химического процесса
• 2NО(г) + О2(г) = 2NО2(г) ; −ΔH, Sр <0Вопрос: Почему данная реакция идет
самопроизвольно?
• Химические процессы имеют две движущие
силы:
1) понижение энергии системы (при
возрастании энтропии окружающей среды),
2) возрастание энтропии системы.
25. 4) Энергия Гиббса (∆G)
- критерий самопроизвольногопротекания реакции при изобарноизотермических условиях (P, T – const)
G = Н - Т S, [кДж/моль]
• ( Gоf, 298 ) - стандартная энергия Гиббса
образования вещества
• Gр= Gоf,298 прод- Gоf,298 исходн. в-в
Gр<0 – самопроизвольное протекание
реакции
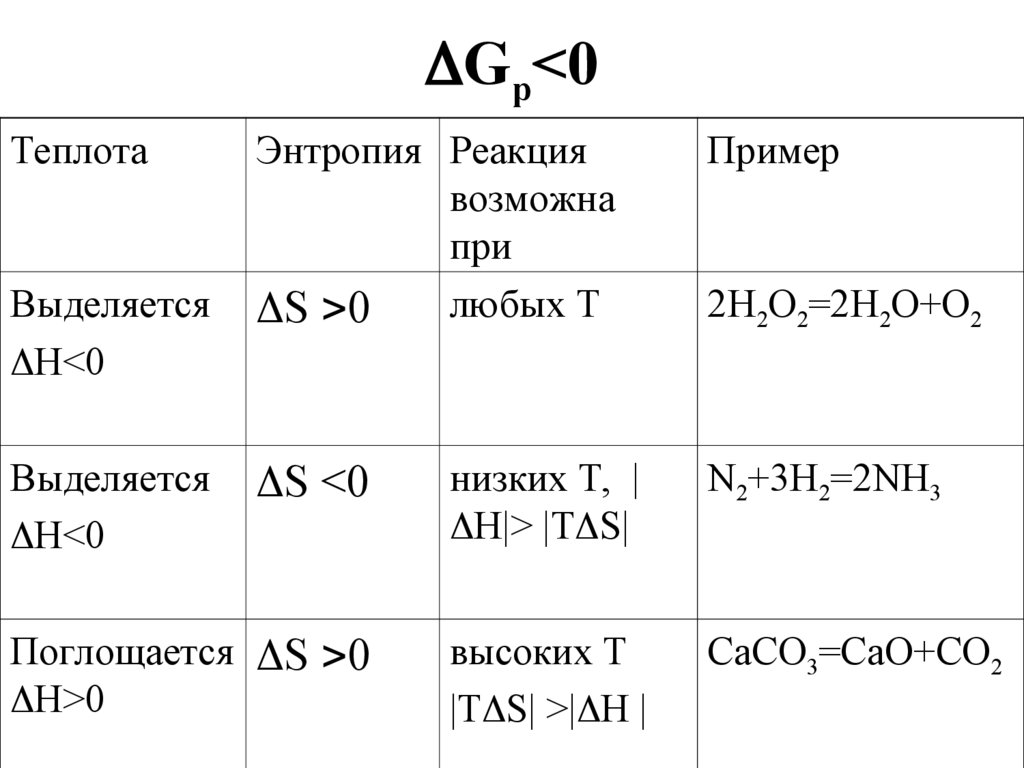
26. Gр<0
Gр<0Теплота
Выделяется
Н<0
Выделяется
Н<0
Энтропия Реакция
возможна
при
любых Т
S 0
Пример
2Н2О2=2Н2О+О2
S <0
низких Т, |
Н|> |Т S|
N2+3H2=2NH3
Поглощается S 0
Н>0
высоких Т
|Т S| >| Н |
CaCO3=CaO+CO2
27. Состояние равновесия
Gр=0Из уравнения: G = Н - Т S следует, что в
состоянии равновесия:
Н = Травн S ,
тогда
Травн = Н/ S ,
где Травн – температура равновесия прямой и
обратной реакции.
28. 5) Потенциал Гельмгольца (F)
5) Потенциал Гельмгольца ( F)– критерий самопроизвольного протекания реакций
при постоянных V и T.
F = U - T S
• Из I закона: dU = dq + dA
• Для изотермической, обратимо изменяющейся
системы: dF = dq + dA - TdS
• При обратимом течении процесса TdS = dq, поэтому
dF = dA.
F – свободная энергия системы, часть
внутренней энергии, которая может быть
изотермически превращена в работу при изохорноизотермических условиях:
- F=Av.
29. Свободная и связанная энергии
Нр= Gр + Т Sр• Энергия системы может быть израсходована на
увеличение энтропии за счет рассеивания тепла,
это связанная энергия - Т Sр.
• Часть энергии, которую можно превратить в
работу - свободная энергия - Gр .
- G = Ap,
где Ap – работа системы при p=const
30. Диаграмма основных термодинамических величин
31. Химический потенциал
• I закон термодинамики для открытых систем :dU=δQ-δA+dEM,
где dEM- изменение энергии системы при изменении
массы, (+) - для продуктов, (-) - для исходных в-в.
• Химический потенциал – μi характеризует изменение
внутренней энергии при добавлении к системе i-го
компонента при постоянстве S,V и масс остальных
компонентов (nJ).
U
H
F
G
i ( )V , S ,n j ( ) p , S ,n j ( )V ,T ,n j ( ) p ,T ,n j
ni
ni
ni
ni
32.
• μi – парциальная мольная энергия Гиббса.• При p,T=const:
dG=∑ μi dni
При увеличении масс компонентов, изобарный
потенциал увеличивается во столько же раз.
• Химический потенциал показывает вклад моля
данного вещества в изобарный потенциал системы,
определяет направление и предел самопроизвольного
перехода данного компонента из одной фазы в другую.
Для индивидуального вещества:
G
n
33. Максимальная работа и химическое сродство
• Равновесная, гомогенная газовая реакция припостоянном давлении и температуре:
mA+nB pC+qD
• Константа равновесия :
р ср p Dq
Кр m n
p A pB
• pi=niRT/V, где pi – парциальное давление компонента
идеального газа, которое бы он оказывал, если бы один
занимал объем всей смеси.
• При n=1 из А=р V
:
V2
V2
RT
Amax
dV RT ln
V
V1
V1
34.
• Amax=RTln(p2/p1) =RT(lnp2 – lnp1)где р2 – равновесное, р1- исходное давление в
системе.
Выражая состав системы через парциальные
давления (при р и T = const) для указанной
реакции находим:
pCp pDq
pCp1 pDq 1
Ap RT (ln m n ln m n )
p A pB
p A1 pB1
pCp1 p Dq 1
Ap RT (ln K p ln m n )
p A1 p B1
где pA1, pB1, pC1, pD1- исходные парциальные давления
Уравнение изотермы химической реакции Вант-Гоффа
35. Уравнения изотермы химической реакции Вант-Гоффа
• Для растворов T,V = const, работу выражаемчерез концентрацию:
p
C1
m
A1
q
D1
n
B1
C C
AV RT (ln K C ln
)
C C
– где CA1, СВ1, СС1, СD1 - исходные парциальные концентрации
реагирующих веществ.
36.
• Если исходные концентрации веществ или их давленияравны 1, а условия стандартные, то перейдя к
десятичному логарифму получим:
• Ap=RTlnKp=2,3RTlgKp
• Av=RTlnKc=2,3RTlgKc
• - Go298=2,3RTlgKp
• - Fo298=2,3RTlgKc;
• Для растворов - F= - G, поэтому
• - Go298=5,7lgKс [кДж/моль].
• Максимальная работа в условиях, когда концентрация
или парциальные давления реагирующих веществ
равны единице, служит мерой химического сродства –
способности веществ химически взаимодействовать
между собой. Реакция совершается самопроизвольно
только тогда, когда максимальная работа положительна.
Пределом течения реакции является состояние
равновесия, соответствующее условию: Av=0 или Ap=0.
































 Химия
Химия








