Похожие презентации:
Электролитическая диссоциация. Реакции в растворах электролитов
1. Электролитическая диссоциация. Реакции в растворах электролитов
2.
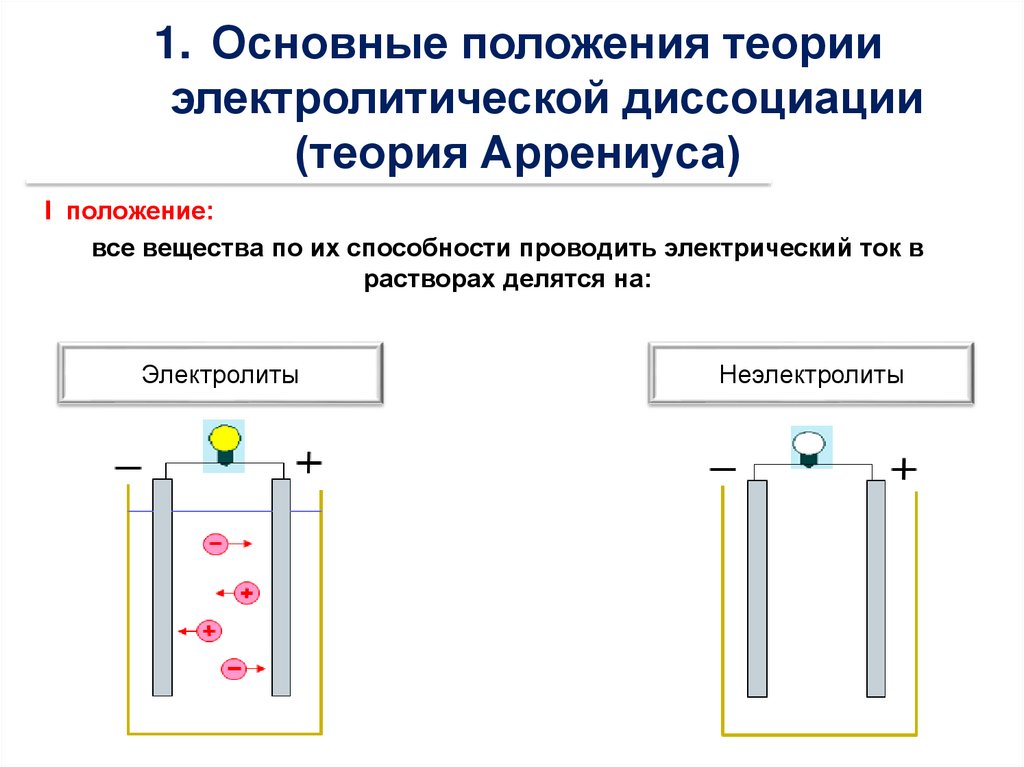
1. Основные положения теорииэлектролитической диссоциации
(теория Аррениуса)
I положение:
все вещества по их способности проводить электрический ток в
растворах делятся на:
Электролиты
Неэлектролиты
3.
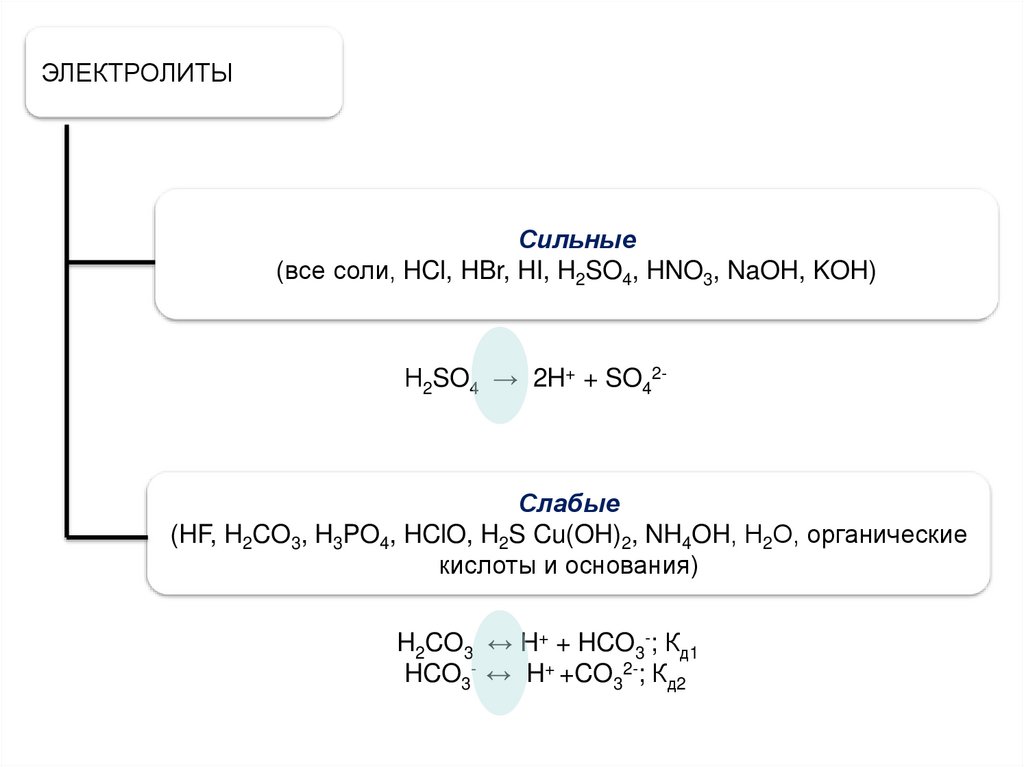
ЭЛЕКТРОЛИТЫСильные
(все соли, HCl, HBr, HI, H2SO4, HNO3, NaOH, KOH)
Н2SO4 → 2H+ + SO42-
Слабые
(HF, H2CO3, H3PO4, HClO, H2S Cu(OH)2, NH4OH, Н2О, органические
кислоты и основания)
H2CO3 ↔ H+ + HCO3-; Кд1
HCO3- ↔ H+ +CO32-; Кд2
4.
II положение:диссоциация количественно оценивается величиной степени
диссоциации (α).
Степень диссоциации – это отношение числа диссоциированных
молекул к их общему числу в растворе.
Для сильных электролитов:
α=1
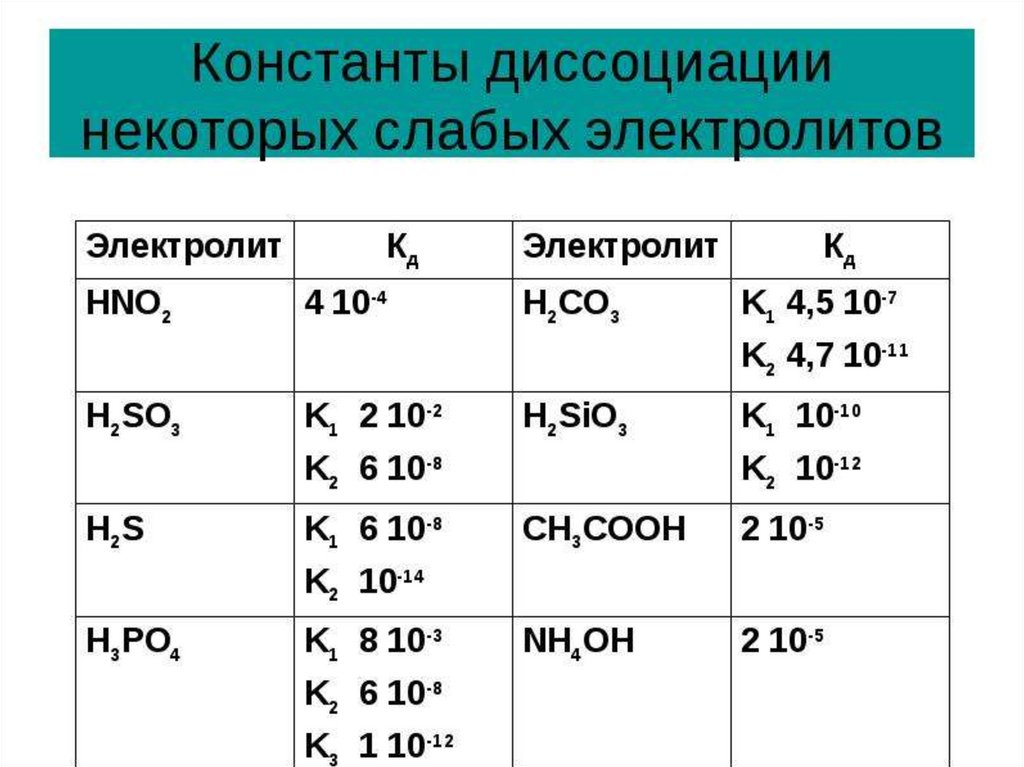
Для слабых электролитов:
0<α<1
Степень диссоциации зависит:
• от температуры
• присутствия других электролитов в растворе
• концентрации
5.
III положение:к процессу диссоциации применим закон действующих масс,
позволяющий записать выражение для константы диссоциации.
Для электролита АВ равновесие при диссоциации имеет вид:
+
АВ<═> А + В
Выражение для константы равновесия (Кд):
[A ][B ]
Кд
[AB]
«Закон разведения» Оствальда:
C
Кд
(1- )
или
Кд С
2
для слабых электролитов
6.
Константа диссоциации - это величина, характеризующаяданный электролит.
КД ˃ 1 - электролит сильный
КД ˂ 1 - электролит слабый
Кд не зависит от концентрации раствора.
Формула для расчета степени диссоциации слабого электролита
при заданной концентрации раствора и известной Кд:
Кд
С
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18. Реакции обмена в растворах электролитов
Обменные реакции (реакции обмена) – реакции в растворахэлектролитов, в ходе которых не изменяются степени окисления
элементов
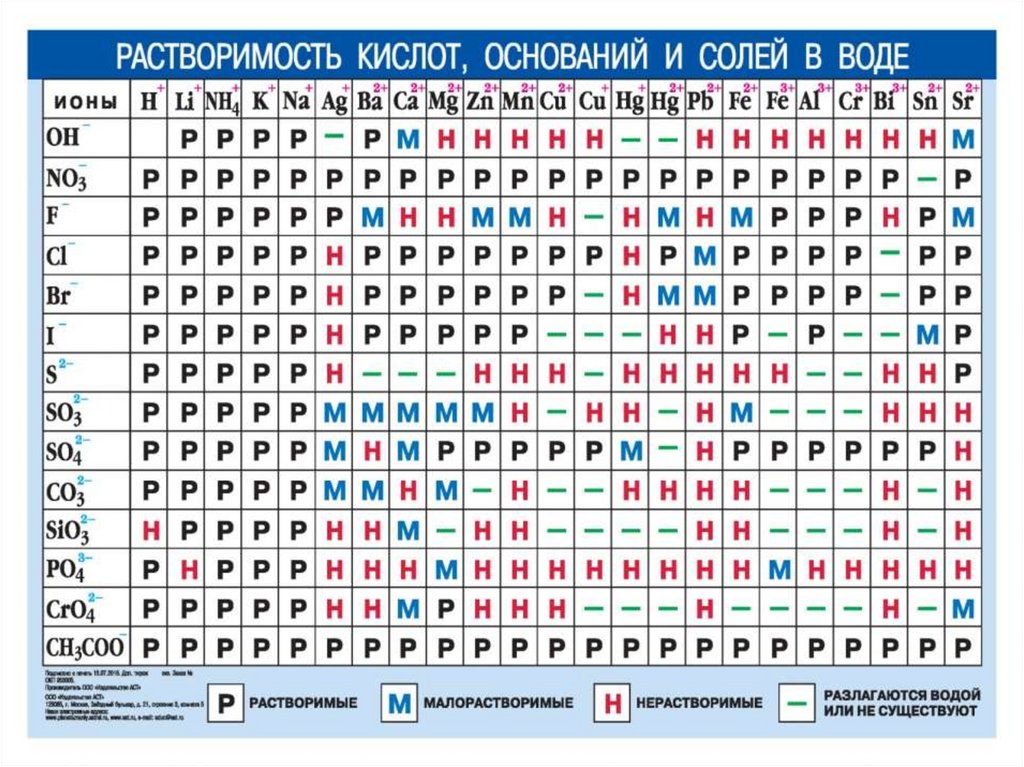
Сущность происходящих в растворе процессов выражают ионными
уравнениями. В ионных уравнениях учитывают растворимость и
относительную степень диссоциации электролитов
При составлении ионных уравнений в виде ионов записывают
только растворимые сильные электролиты. Все остальные
вещества (неэлектролиты, слабые или малорастворимые
электролиты) записывают в молекулярной форме
19.
20.
21. Примеры необратимых реакций обмена
Образование малорастворимого вещества (осадка)Pb(NO3)2 + 2KI = PbI2 + 2KNO3
Pb2+ + 2I- = PbI2
Na2S + 2HCl = H2S + 2NaCl
Образование слабых электролитов
S2- + 2H+ = H2S
Образование газообразного вещества
CH3COONa + HCl = CH3COOH + NaCl
CH3COO- + H+ = CH3COOH
Образование соединения, которое распадается на газообразное
вещество и слабый электролит
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
CO32- + 2H+ = CO2 + H2O
Образование комплексного соединения
Zn(OH)2 + 2NaOH = Na2 Zn(OH)4
Zn(OH)2 + 2OH- = Zn(OH)4 2-
22. Обратимые реакции обмена
Реакции, в которых исходные веществаи продукты реакции содержат
малорастворимые соединения, должны
быть обратимыми, например
AgCl(к) + KI
AgI(к) + KCl
Направление смещения равновесия
определяют путём:
- сравнения произведения растворимости
- расчёта константы равновесия
23. Произведение растворимости
Гетерогенное равновесие в насыщенном водномрастворе малорастворимого электролита KmAn между
осадком электролита и его ионами в растворе
KmAn(к)
mKn+ + nAm-
осадок
ионы в растворе
Константа данного равновесия – произведение
растворимости (ПР)
ПР = Kn+ m Am- n
Kn+ m, Am- n – равновесные концентрации ионов, моль/л
m и n – стехиометрические коэффициенты
В справочных таблицах приведены значения ПР
при Т = 298К (250С)
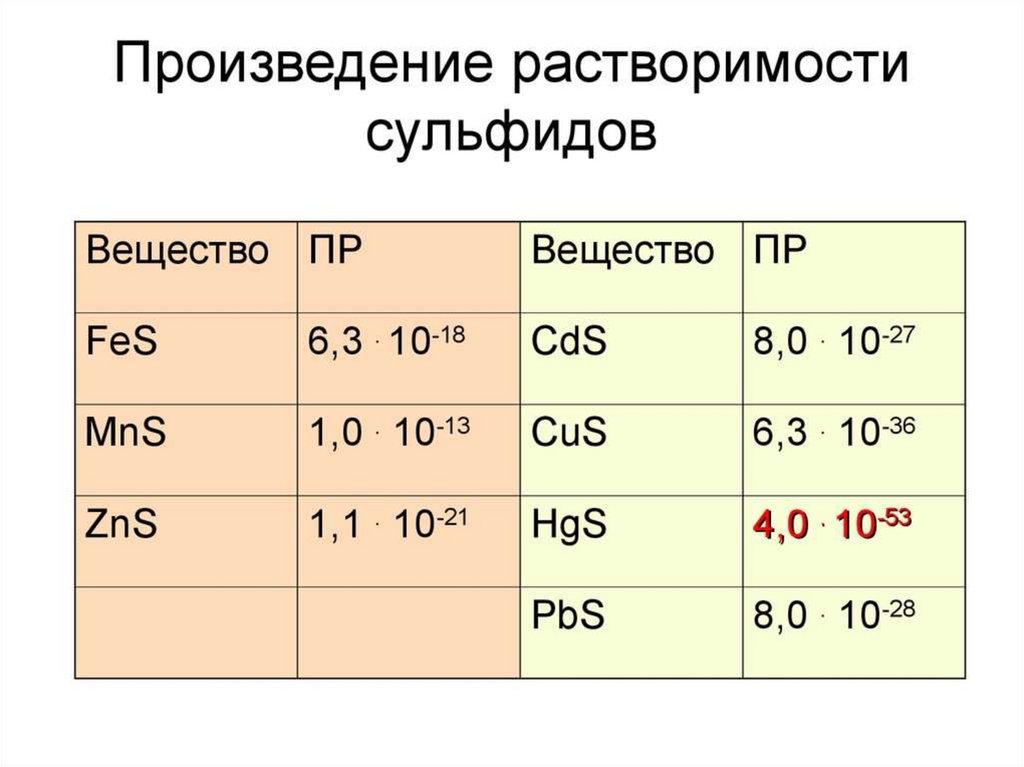
24. Значения ПР малорастворимых электролитов при 250С
В насыщенном растворе малорастворимого электролитапроизведение равновесных молярных концентраций катионов и
анионов в степенях, равных стехиометрическим коэффициентам,
при постоянной температуре есть величина постоянная.
Для фосфата бария
Ba3(PO4)2(к)
3Ba2+ + 2PO43-
ПР [Ba 2 ]3 [PO 34 ]2 6,0 10 39
Для сульфида серебра (I)
Ag2S(к)
2Ag+ + S2-
ПР [ Ag ]2 [S 2 ] 7,2 10 50
Меньше значение ПР
меньше растворимость вещества
25.
26. Обратимые реакции обмена
Направление реакции можно определить путём сравнения величинпроизведения растворимости
AgCl(к) + KI
ПР AgCl 1,8 10 10 ˃
AgI(к) + KCl
ПР AgI 2,3 10 16 , значит
Направление реакции можно определить по значению константы
равновесия
AgCl(к)
+ I-
AgI(к)
+ Cl-
KC
[Cl ]
[I ]
Умножаем числитель и знаменатель на Ag+
KC
[ Ag ][Cl ]
[ Ag ][I ]
ПР AgCl
ПР AgI
1,8 10 10
2,3 10 16
7,8 105
Кс 1
данная реакция практически необратимо протекает
в прямом направлении
AgCl(к) + KI = AgI(к) + KCl
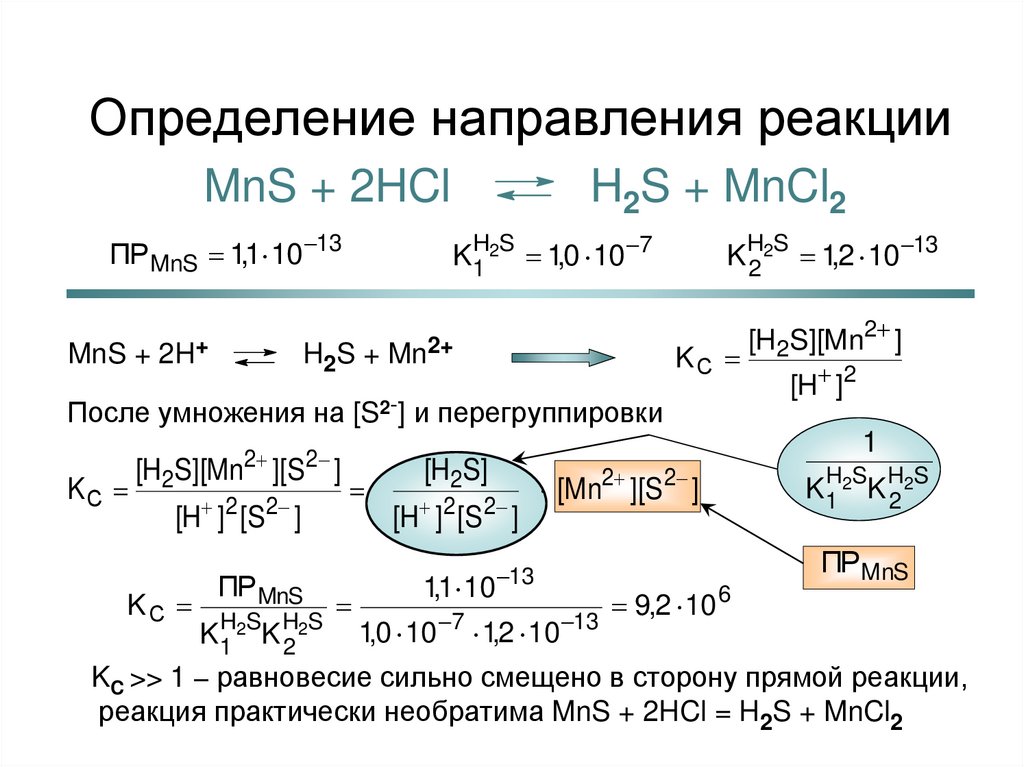
27. Определение направления реакции
MnS + 2HClПР MnS 1,1 10 13
MnS + 2H+
H2S + MnCl2
K1 2 1,0 10 7
K 2 2 1,2 10 13
HS
H2S + Mn2+
HS
KС
После умножения на [S2-] и перегруппировки
KС
2
2
KС
ПР MnS
H S H S
K1 2 K 2 2
[H ]2
1
[H2S][Mn ][S ]
[H ]2 [S 2 ]
[H2S][Mn2 ]
[H2S]
[H ]2 [S 2 ]
1,1 10
[Mn2 ][S 2 ]
13
1,0 10 7 1,2 10 13
H S H S
K1 2 K 2 2
ПРMnS
9,2 10 6
KC >> 1 – равновесие сильно смещено в сторону прямой реакции,
реакция практически необратима MnS + 2HCl = H2S + MnCl2
28. Определение направления реакции
CuS + 2HClПР CuS 6,3 10 36
H2S + CuCl2
HS
CuS + 2H+
KС
ПР CuS
H S H S
K1 2 K 2 2
K 2 2 1,2 10 13
K1 2 1,0 10 7
HS
H2S + Cu2+
6,3 10 36
1,0 10 7 1,2 10 13
5,3 10 16
KC << 1 – равновесие сильно смещено в сторону обратной реакции,
которая идет практически необратимо
H2S + CuCl2 = CuS + 2HCl
Реакции, в которых исходные вещества и продукты реакции содержат
малорастворимые или слабые электролиты, идут в сторону
образования более слабых и менее растворимых электролитов
29. Условие выпадения и растворения осадка
Используя значение ПР, можно определить возможностьобразования или растворения осадка в растворе заданного состава
Произведение молярных концентраций ионов
малорастворимого сильного электролита
в заданном
растворе – ПК
в насыщенном
растворе – ПР
ПК>ПР – раствор пересыщенный – образуется осадок
ПК<ПР – раствор ненасыщенный – осадок не образуется
Когда система уже содержит осадок, и создают условия, при
которых ПК<ПР (например, разбавляют раствор), осадок частично
или полностью растворяется
30. Пример: Определение возможности образования осадка BaSO4
Определите, образуется ли осадок BaSO4 при сливанииравных объемов 0,001 М растворов Ba(NO3)2 и Na2SO4
ПР BaSO4 1,1 10 10
Ba(NO3)2 = Ba2+ + 2NO3-
Na2SO4 = 2Na+ + SO42-
Концентрации ионов
в исходных растворах
после сливания (V в 2 раза)
0,001
CBa2 CBa(NO 3 )2 0,001моль / л C Ba 2
0,0005 моль / л
2
0,001
CSO 2 CNa 2SO 4 0,001 моль / л
C SO2
0,0005 моль / л
4
4
2
ПК C Ba 2 C SO 2 0,0005 0,0005 2,5 10 7
ПК ПРBaSO4
2,5 10-7 1,1 10-10
4
осадок сульфата бария образуется
























 Химия
Химия