Похожие презентации:
Гетерогенное ионное равновесие. Реакции обмена
1.
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЛекция 8
ГЕТЕРОГЕННОЕ ИОННОЕ РАВНОВЕСИЕ.
РЕАКЦИИ ОБМЕНА
2. Содержание
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСодержание
Гетерогенное равновесие в насыщенном растворе
малорастворимого сильного электролита. Произведение
растворимости
Влияние
на растворимость
одноименных ионов
электролита
Условие образования и растворения осадка
Реакции обмена в растворах электролитов
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
введения
3. Произведение растворимости
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАПроизведение растворимости
Гетерогенное равновесие в насыщенном водном
растворе малорастворимого сильного электролита
KmAn между осадком электролита и его ионами в
растворе
KmAn(к)
mKn+ + nAmосадок
ионы в растворе
Константа данного равновесия – произведение
растворимости (ПР)
ПР = Kn+ m Am- n
Kn+ m, Am- n – равновесные концентрации ионов, моль/л
m и n – стехиометрические коэффициенты
В справочных таблицах приведены значения ПР
при Т = 298К (250С)
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
4. Значения ПР малорастворимых электролитов при 250С
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗначения ПР малорастворимых
электролитов при 250С
В насыщенном растворе сильного малорастворимого электролита
произведение равновесных молярных концентраций катионов и
анионов в степенях, равных стехиометрическим коэффициентам,
при постоянной температуре есть величина постоянная
Для фосфата бария
Ba3(PO4)2(к)
3Ba2+ + 2PO43-
ПР [Ba 2 ]3 [PO 34 ]2 6,0 10 39
Для сульфида серебра (I)
Ag2S(к)
2Ag+ + S2-
ПР [ Ag ]2 [S 2 ] 7,2 10 50
Меньше значение ПР
меньше растворимость вещества
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
5. Расчет растворимости СаСО3
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет растворимости СаСО3
Обозначим S – растворимость карбоната кальция , моль/л
S – растворимость карбоната кальция , г/л
Равновесие в насыщенном растворе карбоната кальция
СаСО3(к)
ПР CaCO3
Са2+ + СО32-
[Ca2 ] [CO32 ] S
[Ca2 ][CO32 ] S 2
ПР CaCO3 4,4 10 9
S ПР CaCO3 4,4 10 9 6,6 10 5 моль / л.
Сa2+ = СО32- = 6,6 10 5 моль/л.
Растворимость S (г/л) связана с растворимостью S (моль/л)
S S MCaCO 3
MCaCO3 100 г / моль
S 6,6 10 5 100 6,6 10 3 г / л
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
6. Соотношение растворимости и ПР
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСоотношение растворимости и ПР
Для малорастворимого электролита KmAn,
растворимость которого S
KmAn(к)
mKn+ + nAm-
Концентрации ионов (моль/л)
Kn+ = mS
Am- = nS
Произведение растворимости
ПР = Kn+ m Am- n = (mS)m(nS)n = mmnnSm+n
Растворимость (моль/л)
S m n
ПР
m mnn
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
7. Расчет растворимости Сa3(PO4)2 и Ag2S
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет растворимости
Сa3(PO4)2 и Ag2S
Растворимость Сa3(PO4)2 (m = 3, n = 2)
29
ПР
2
,
0
10
S 3 2
5
5
7,1 10 7 моль / л
108
108
33 22
ПР
Растворимость Ag2S (m = 2, n = 1)
50
ПР
7
,
2
10
S 2 1
3
3
2,6 10 17 моль / л
4
4
22
ПР
Для однотипных по составу веществ по значениям ПР можно
сравнивать растворимость
ПР Ag2SO4 1,2 10 5 >>
ПР Ag2S 7,2 10 50
сульфат серебра (I), растворим значительно лучше, чем
сульфид серебра (I)
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
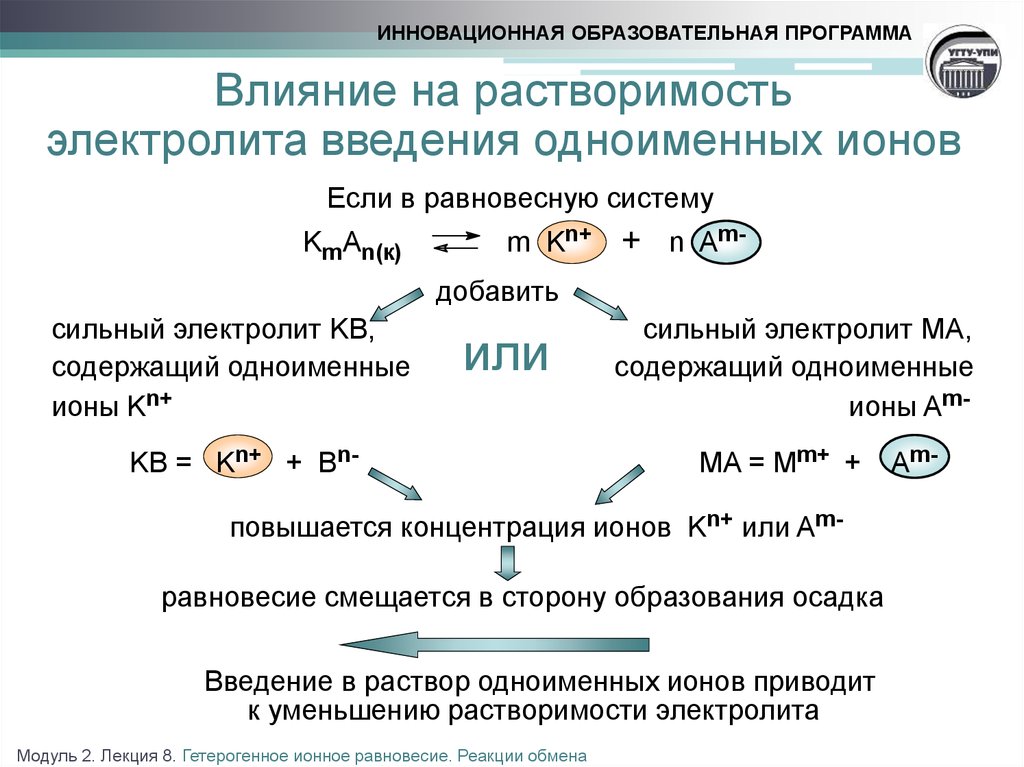
8. Влияние на растворимость электролита введения одноименных ионов
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВлияние на растворимость
электролита введения одноименных ионов
Если в равновесную систему
KmAn(к)
m Kn+
+ n Am-
добавить
сильный электролит KB,
содержащий одноименные
ионы Kn+
или
KB = Kn+ + Bn-
сильный электролит MA,
содержащий одноименные
ионы AmMA = Mm+ +
повышается концентрация ионов Kn+ или Amравновесие смещается в сторону образования осадка
Введение в раствор одноименных ионов приводит
к уменьшению растворимости электролита
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
Am-
9. Расчет растворимости CdCO3
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет растворимости CdCO3
СdСО3(к)
Сd2+ + СО32-
ПР CdCO 3 5,2 10 12
Растворимость карбоната кадмия
S ПР CdCO 3 5,2 10 12 2,28 10 6 моль / л
Расчет растворимости карбоната кадмия в 0,1М растворе Na2CO3
Концентрация карбонат-ионов
в насыщенном растворе карбоната кадмия
СО32- = S = 2,28 10 6 моль/л
в присутствии карбоната натрия
[CO32 ] 2,28 10 6 0,1 0,1моль / л
Концентрация ионов кадмия в присутствии карбоната натрия
5,2 10 12
2 ПР CdCO 3
[Cd ]
5,2 10 11 моль / л
0,1
[CO32 ]
Растворимость карбоната кадмия в 0,1М растворе Na2CO3
S [Cd2 ] 5,2 10 11 моль / л
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
10. Условие выпадения и растворения осадка
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАУсловие выпадения
и растворения осадка
Используя значение ПР, можно определить возможность
образования или растворения осадка в растворе заданного состава
Произведение молярных концентраций ионов
малорастворимого сильного электролита
в заданном
растворе – ПК
в насыщенном
растворе – ПР
ПК>ПР – раствор пересыщенный – образуется осадок
ПК<ПР – раствор ненасыщенный – осадок не образуется
Когда система уже содержит осадок, и создают условия, при которых
ПК<ПР (например, разбавляют раствор), осадок частично или
полностью растворяется
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
11. Определение возможности образования осадка BaSO4
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОпределение возможности
образования осадка BaSO4
Определите, образуется ли осадок BaSO4 при сливании
равных объемов 0,001 М растворов Ba(NO3)2 и Na2SO4
ПРBaSO4 1,1 10 10
Ba(NO3)2 = Ba2+ + 2NO3-
Na2SO4 = 2Na+ + SO42-
Концентрации ионов
в исходных растворах
после сливания (V в 2 раза)
0,001
CBa2 CBa(NO 3 )2 0,001моль / л C Ba 2
0,0005 моль / л
2
0,001
CSO2 CNa 2SO 4 0,001 моль / л
C SO2
0,0005 моль / л
4
4
2
ПК C Ba 2 C SO2 0,0005 0,0005 2,5 10 7
ПК ПРBaSO4
2,5 10-7
1,1 10-10
4
осадок сульфата бария образуется
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
12. Реакции обмена в растворах электролитов
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРеакции обмена в растворах
электролитов
Обменные реакции (реакции обмена) – реакции в растворах
электролитов, в ходе которых не изменяются степени окисления
элементов
Обменные реакции протекают практически необратимо, если в
результате образуются малорастворимые, газообразные вещества
или слабые электролиты.
Сущность происходящих в растворе процессов выражают ионными
уравнениями. В ионных уравнениях учитывают растворимость и
относительную степень диссоциации электролитов
При составлении ионных уравнений в виде ионов записывают
только растворимые сильные электролиты. Все остальные
вещества (неэлектролиты, слабые или малорастворимые
электролиты) записывают в молекулярной форме
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
13. Примеры необратимых реакций обмена
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАПримеры необратимых реакций обмена
Образование малорастворимого вещества (осадка)
Образование газообразного вещества
Na2S + 2HCl = H2S + 2NaCl
Образование слабых электролитов
Pb2+ + 2I- = PbI2
Pb(NO3)2 + 2KI = PbI2 + 2KNO3
CH3COONa + HCl = CH3COOH + NaCl
S2- + 2H+ = H2S
CH3COO- + H+ = CH3COOH
Образование соединения, которое распадается на газообразное
вещество и слабый электролит
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
CO32- + 2H+ = CO2 + H2O
Образование комплексного соединения
Zn(OH)2 + 2NaOH = Na2 Zn(OH)4
Zn(OH)2 + 2OH- = Zn(OH)4 2Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
14. Направление реакций обмена
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАНаправление реакций обмена
Реакции, в которых исходные вещества и продукты реакции
содержат малорастворимые соединения, должны быть обратимыми
AgCl(к) + KI
AgI(к) + KCl
ПР AgCl 1,8 10 10
ПР AgI 2,3 10 16
Направление реакции можно определить по значению константы
равновесия
[Cl ]
AgCl(к) + I
AgI(к) + Cl
KC
[I ]
Умножаем числитель и знаменатель на Ag+
KC
[ Ag ][Cl ]
[ Ag ][I ]
ПР AgCl
ПР AgI
1,8 10 10
2,3 10 16
7,8 10 5
Кс 1
данная реакция практически необратимо протекает
в прямом направлении
AgCl(к) + KI = AgI(к) + KCl
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
15. Определение направления реакции
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОпределение направления реакции
MnS + 2HCl
ПРMnS 1,1 10 13
MnS +
2H+
H2S + MnCl2
K1 2 1,0 10 7
K 2 2 1,2 10 13
HS
H 2S +
Mn2+
HS
KС
После умножения на [S2-] и перегруппировки
KС
2
2
KС
ПР MnS
H S H S
K1 2 K 2 2
[H ]2
1
[H2S][Mn ][S ]
[H ]2 [S 2 ]
[H2S][Mn2 ]
[H2S]
[H ]2 [S 2 ]
1,1 10
[Mn2 ][S 2 ]
13
1,0 10 7 1,2 10 13
H S H S
K1 2 K 2 2
ПРMnS
9,2 10 6
KC >> 1 – равновесие сильно смещено в сторону прямой реакции,
реакция практически необратима MnS + 2HCl = H2S + MnCl2
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
16. Определение направления реакции
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОпределение направления реакции
CuS + 2HCl
ПР CuS 6,3 10 36
H2S + CuCl2
HS
CuS + 2H+
KС
ПР CuS
H S H S
K1 2 K 2 2
K 2 2 1,2 10 13
K1 2 1,0 10 7
HS
H2S + Cu2+
6,3 10 36
1,0 10 7 1,2 10 13
5,3 10 16
KC << 1 – равновесие сильно смещено в сторону обратной реакции,
которая идет практически необратимо
H2S + CuCl2 = CuS + 2HCl
Реакции, в которых исходные вещества и продукты реакции содержат
малорастворимые или слабые электролиты, идут в сторону
образования более слабых и менее растворимых электролитов
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
17. Заключение
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗаключение
Константу равновесия в насыщенном растворе
малорастворимого сильного электролита между осадком
электролита и его ионами в растворе называют произведением
растворимости
Обменные реакции (реакциями обмена) - реакции в растворах
электролитов, в ходе которых не изменяются степени окисления
элементов
Обменные реакции протекают практически необратимо, если в
результате образуются малорастворимые, газообразные
вещества или слабые электролиты.
Реакции, в которых исходные вещества и продукты реакции
содержат малорастворимые или слабые электролиты, идут в
сторону образования более слабых и менее растворимых
электролитов
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена
18. Рекомендуемая литература
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия,
2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007
Лидин Р.А. Задачи по общей и неорганической химии. - М.:
ВЛАДОС, 2004
Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах,
формулах, химических реакциях. - СПб.: Лань, 2000
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш. шк.,
1994
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы
неорганической химии. Под ред. Ю. Д. Третьякова. - М.:
Академия, 2004
Модуль 2. Лекция 8. Гетерогенное ионное равновесие. Реакции обмена

















 Химия
Химия








