Похожие презентации:
Гидролиз солей (11 класс)
1.
Гидролиз солей11 класс
2.
Гидролиз солей – это обменная реакция соли сводой, в результате которой образуется слабый
электролит.
В водных растворах соли диссоциируют на катионы
и анионы полностью.
+
В водном растворе всегда присутствуют ионы H и
OH –, которые образуются при диссоциации воды.
+
–
Если ионы Н и ОН при взаимодействии с ионами
соли образуют малодиссоциированное соединение
(слабый электролит), то идёт гидролиз соли.
3.
Факторы, влияющие на гидролизТемпература
При повышении
температуры
гидролиз
усиливается.
↑t → υ гидр ↑
Концентрация
При уменьшении
концентрации соли,
гидролиз
усиливается (для
этого разбавляют
раствор).
↓с → υ гидр ↑
4.
Если соль образована слабым многокислотнымоснованием и сильной кислотой или сильным
основанием и слабой многоосновной кислотой,
гидролиз может проходить ступенчато.
Однако, как правило, на практике он идет
только по первой ступени, т.е. с участием одной
молекулы воды.
5.
ФотосинтезpH = 8 слабощелочная среда
CO2 + H2O
свет
C6H12O6 + O2
6.
Классификация солейВсе соли в зависимости от природы
образующих ее катиона и аниона
можно разделить на четыре группы.
7.
Сильные электролиты (α > 30%)HI, HBr, HCl
HClO4, HMnO4
H2SO4, HNO3
Щелочи: LiOH, NaOH, KOH, Ba(OH)2, Ca(OH)2
Растворимые соли
8.
Соль образована сильнымоснованием и слабой кислотой
NaOH
Сильное основание
H2CO3
Слабая кислота
Na2CO3
Na2CO3 = 2Na
+
2+ CO3
Гидролиз по аниону, среда щелочная (pH>7)
9.
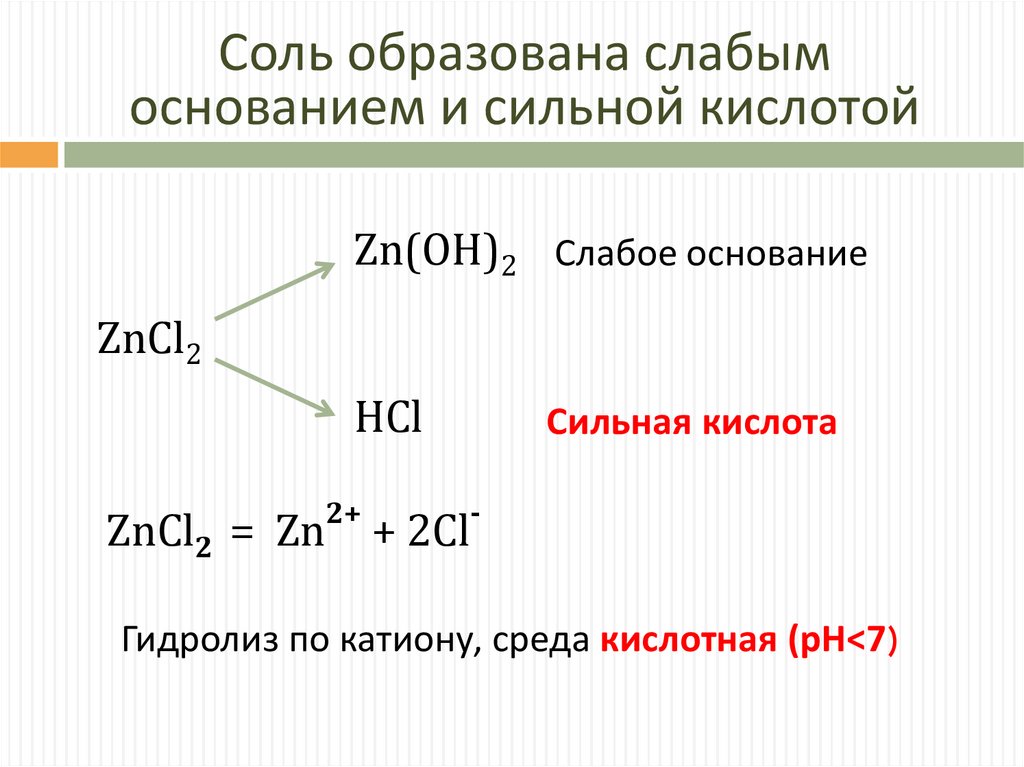
Соль образована слабымоснованием и сильной кислотой
Zn(OH)2 Слабое основание
ZnCl2
HCl
ZnCl2 = Zn
2+
Сильная кислота
-
+ 2Cl
Гидролиз по катиону, среда кислотная (pH<7)
10.
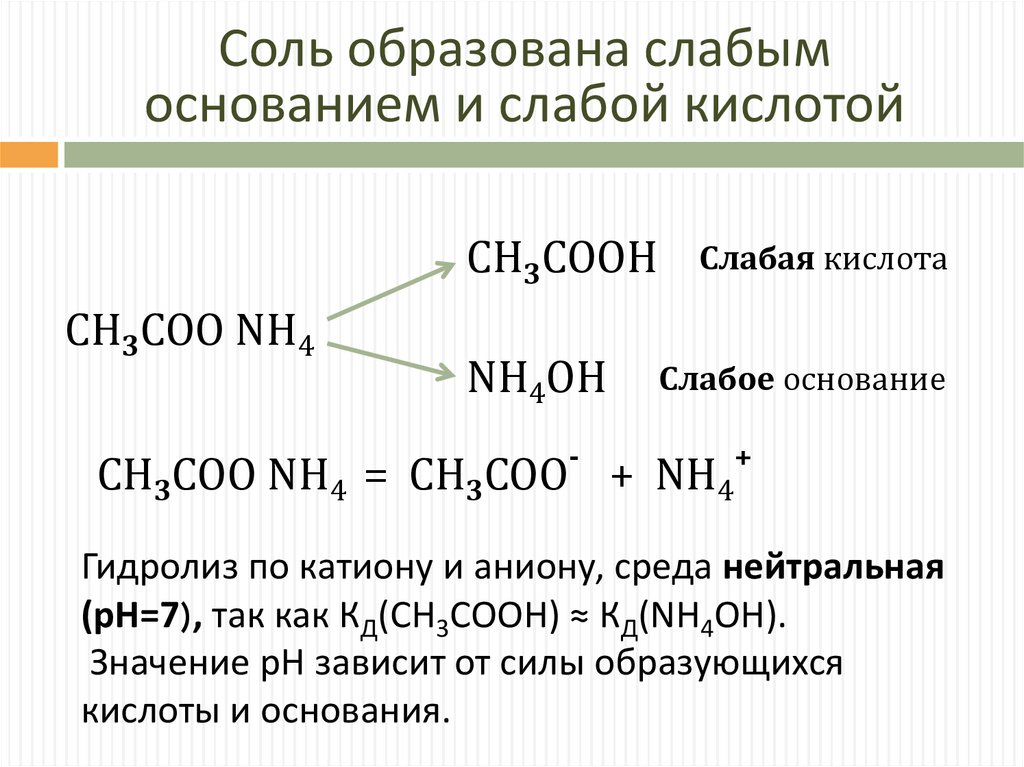
Соль образована слабымоснованием и слабой кислотой
СH3COOH
СH3COO NH4
NH4OH
-
Слабая кислота
Слабое основание
СH3COO NH4 = СH3COO + NH4
+
Гидролиз по катиону и аниону, среда нейтральная
(pH=7), так как КД(CH3COOH) ≈ КД(NH4ОН).
Значение рН зависит от силы образующихся
кислоты и основания.
11.
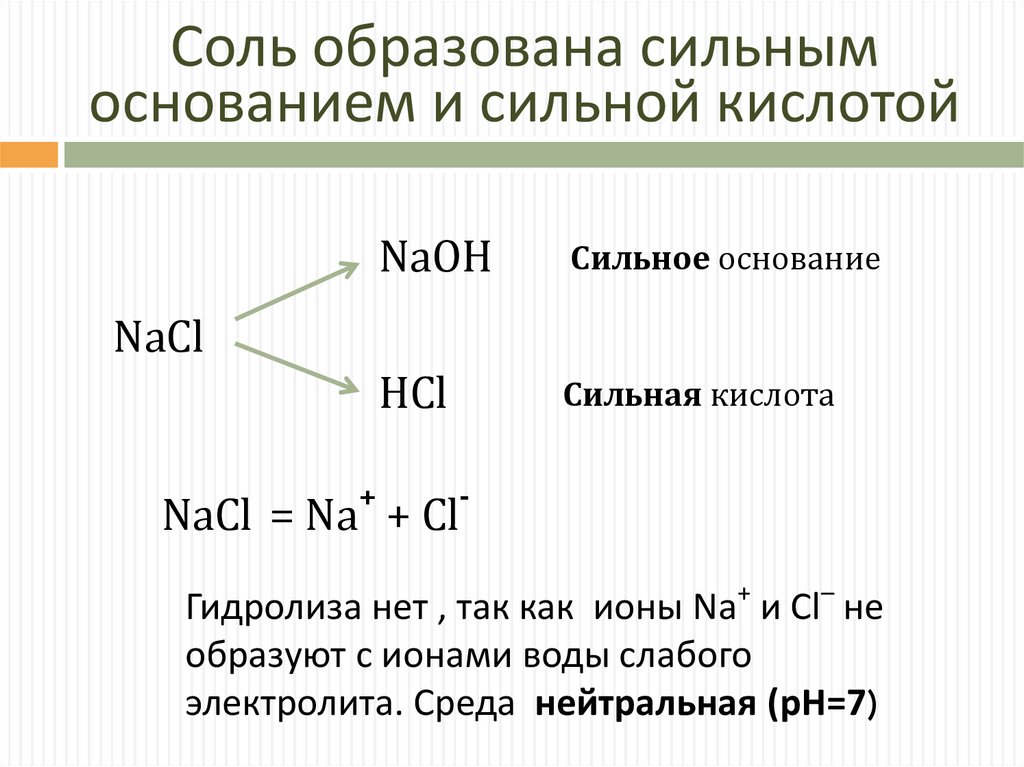
Соль образована сильнымоснованием и сильной кислотой
NaOH
Сильное основание
HCl
Сильная кислота
NaCl
+
-
NaCl = Na + Cl
Гидролиза нет , так как ионы Na+ и Cl– не
образуют с ионами воды слабого
электролита. Среда нейтральная (pH=7)
12.
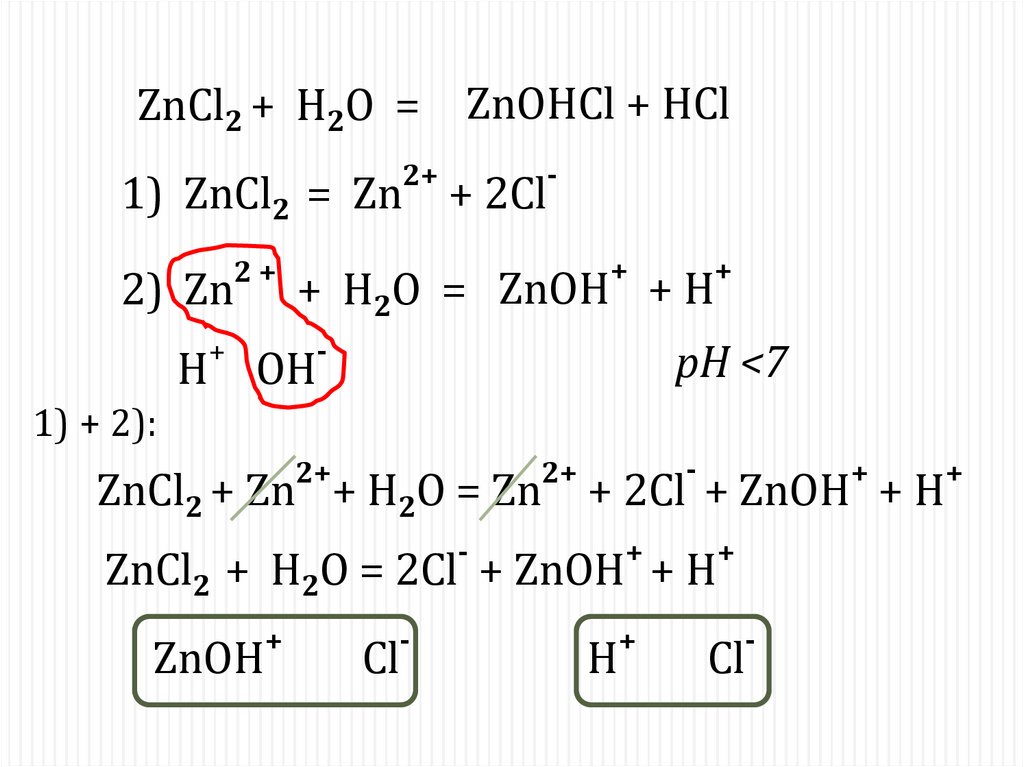
ZnCl2 + H2O =2+
1) ZnCl2 = Zn
2+
2) Zn
+
H
ZnOHCl + HCl
-
+ 2Cl
+
+
+ Н2O = ZnOH + H
-
pH <7
OH
1) + 2):
2+
2+
ZnCl2 + Zn + H2O = Zn
-
+
+ 2Cl + ZnOH + H
-
+
+
ZnCl2 + H2O = 2Cl + ZnOH + H
+
ZnOH
-
Cl
+
H
-
Cl
+
13.
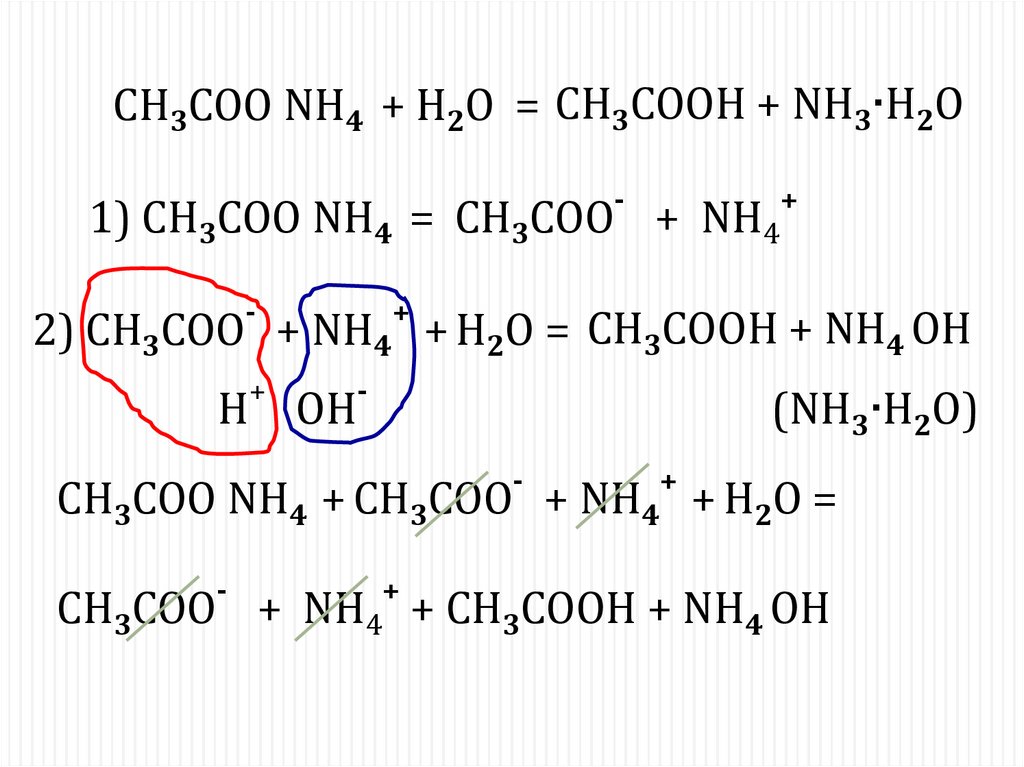
СH3COO NH4 + H2O = CH3COOH + NH3∙H2O-
1) СH3COO NH4 = СH3COO + NH4
+
-
+
2) CH3COO + NH4 + H2O = CH3COOH + NH4 OH
+
H OH
(NH3∙H2O)
-
СH3COO NH4 + CH3COO
-
+
+
+ NH4 + H2O =
СH3COO + NH4 + CH3COOH + NH4 OH
14.
Задание 1Кислотная среда (pH <7) в растворе:
1)Na3PO4
2)KCl
3)Na2CO3
4)ZnSO4
15.
Задание 2Щелочная среда (pH>7) в растворе:
1)CuBr2
2)NaCl
3)K2CO3
4)MgSO4
16.
Задание 3Установите соответствие между составом
соли и типом её гидролиза:
А) Cr2S3
1) по катиону
Б) AlCl3
2) по аниону
В) K2SO4
3) по катиону и аниону
Г) Na3PO4
4) нет гидролиза
17.
Задание 4Кислую среду имеет водный раствор
каждой из двух солей:
1) хлорид бария и фосфат калия
2) сульфат калия и сульфат никеля
3) карбонат натрия и хлорид натрия
4) хлорид железа(II) и сульфат магния












 Химия
Химия








