Похожие презентации:
Гидролиз солей
1. Г и д р о л и з солей
Лёвкин А.Н.Гидролиз
солей
2. Гидролиз солей
CH3COO- + H+ CH3COOHCH3COO- + H2O CH3COOH + OH-
H2O H+ + OH-
CO32- + HOH HCO3- + OHZn2+ + HOH ZnOH+ + H+
Гидролиз солей – обменная реакция солей с водой,
в результате которой происходит
Сольволиз
– процесс диссоциации
взаимодействия
смещение равновесия
воды
растворенного вещества с ионами, образующимися
при ионизации молекул растворителя во время этого
процесса.
3. Соли слабого основания и сильной кислоты
NH4Cl, AlCl3, Zn(NO3)2, Fe2(SO4)3NH4Cl + H2O
NH3 H2O + HCl
NH4+ + Cl- + HOH
NH4OH + Cl- + H+
NH4+ + H2O NH34 OH
H2O++H+H+
AlCl3 + H2O
AlOHCl2 + HCl
Al3+ + 3Cl- + HOH
AlOH2+ + 3Cl- + H+
Al3+ + H2O AlOH2+ + H+
Гидролиз по катиону.
рН < 7
4. Соли сильного основания и слабой кислоты
Na2CO3, K3PO4, CH3COONaCH3COONa + H2O
CH3COOH + NaOH
CH3COO- + Na+ + HOH
CH3COOH + Na+ + OH-
CH3COO- + H2O CH3COOH + OHNa2CO3 + H2O
NaHCO3 + NaOH
2Na+ + CO32- + HOH 2Na+ + HCO3- + OHCO32- + HOH HCO3- + OH-
Гидролиз по аниону.
рН > 7
5. Соли слабого основания и слабой кислоты
CH3COONH4, NH4CN, NH4NO2, (NH4)3PO4NH4NO2 + H2O
NH43OH
H2O +
+ HNO
HNO22
NH4+ + NO2- + HOH
NH34 OH
HNO
NH
H2O++
HNO
2 2
Реакция среды?
Ka (HNO2) = 4 10-4
Kb (NH3 H2O) = 1,8 10-5
pH < 7
Гидролиз
и по аниону, и по катиону
рН зависит от
соотношения сил
электролитов
6. Соли сильного основания и сильной кислоты
NaCl, K2SO4, Ba(NO3)2, CaBr2NaCl + H2O
Na+ + Cl- + HOH
Гидролизу
не подвергаются
7. Взаимное усиление гидролиза
2AlCl3 + 3Na2CO3 = Al2(CO3)3 + 6NaCl2AlCl3 + 3Na2CO3 + 3H2O =
= 2Al(OH)3 + 3CO2 + 6NaCl
2Al3+ + 3CO32- + 3H2O = 2Al(OH)3 + 3CO2
При взаимодействии солей слабых
летучих многоосновных кислот и
слабых многокислотных оснований
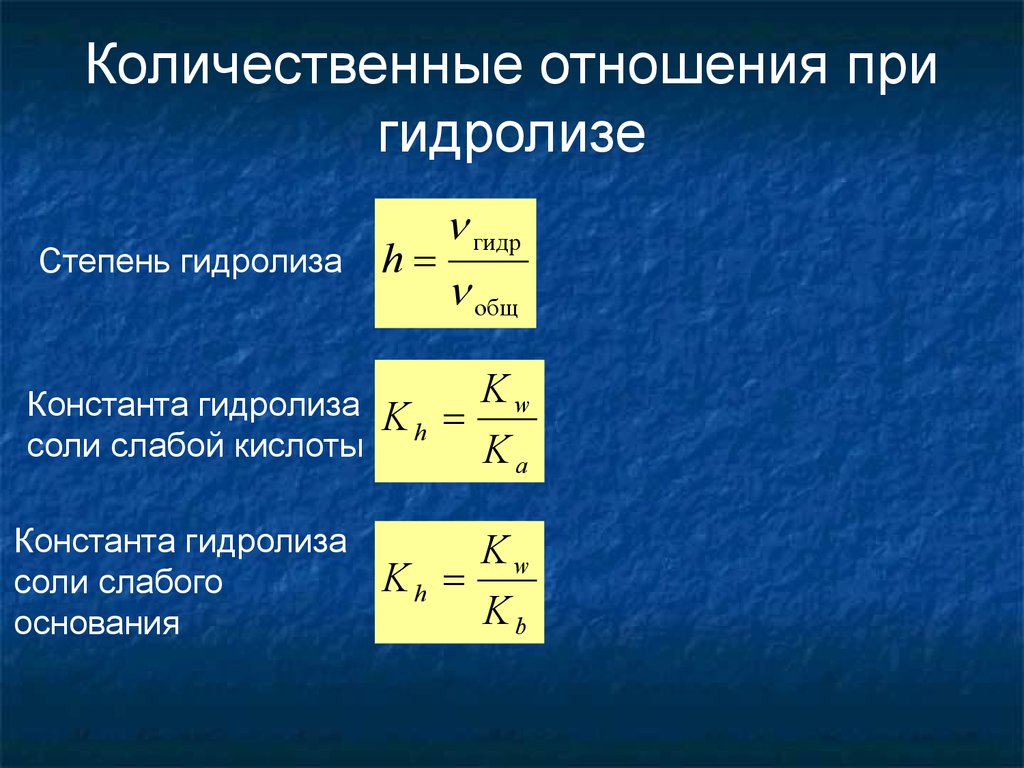
8. Количественные отношения при гидролизе
Степень гидролизаКонстанта гидролиза
соли слабой кислоты
Константа гидролиза
соли слабого
основания
h
гидр
общ
Kw
Kh
Ka
Kw
Kh
Kb








 Химия
Химия