Похожие презентации:
Реализация генетической информации у прокариот и эукариот
1.
«РЕАЛИЗАЦИЯ ГЕНЕТИЧЕСКОЙИНФОРМАЦИИ У ПРОКАРИОТ
И ЭУКАРИОТ»
2.
Актуальность темы: молекулярная биология изучает явления жизни науровне макромолекул в субклеточных структурах, в вирусах, в
клетках, установление роли и механизма функционирования этих
макромолекул на основе знания их структуры и свойств.
Молекулярная биология главное внимание сосредоточивает на
изучении способа хранения наследственной информации, механизма
ее передачи дочерним клеткам и реализации этой информации. Начав
с изучения биологических процессов на атомно-молекулярном уровне,
молекулярная биология перешла к сложным надмолекулярным
клеточным структурам и в настоящее время успешно решает
проблемы генетики, физиологии, эволюции и экологии.
Цель занятия: изучить молекулярные
механизмы процесса трансляции,
определить возможности регуляции на
трансляционном и пострансляционном
уровнях.
3.
Вопросы для самоподготовкиРекогниция – подготовительный этап трансляции:
активация и транспорт аминокислот
Трансляция как матричный процесс: инициация,
элонгация, терминация
Сходство и отличие процесса трансляции у прокариот и
эукариот (строение рибосом про- и эукариот, стартовый
кодон, факторы трансляции)
Механизмы регуляции на уровне трансляции
Пострансляционная модификация белков (фолдинг и
процессинг). Шапероны и шаперонины, их роль в
пострансляционной модификации белка.
Деградация
белков
как
способ
регуляции
на
пострансляционном уровне
4.
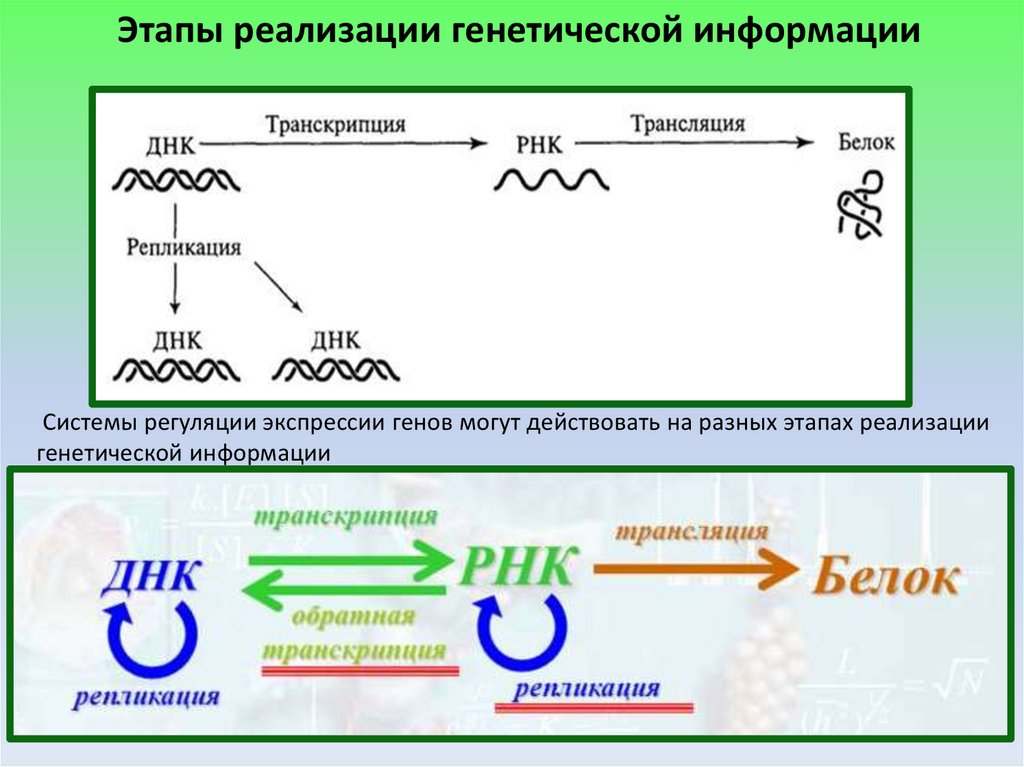
Этапы реализации генетической информацииСистемы регуляции экспрессии генов могут действовать на разных этапах реализации
генетической информации
5.
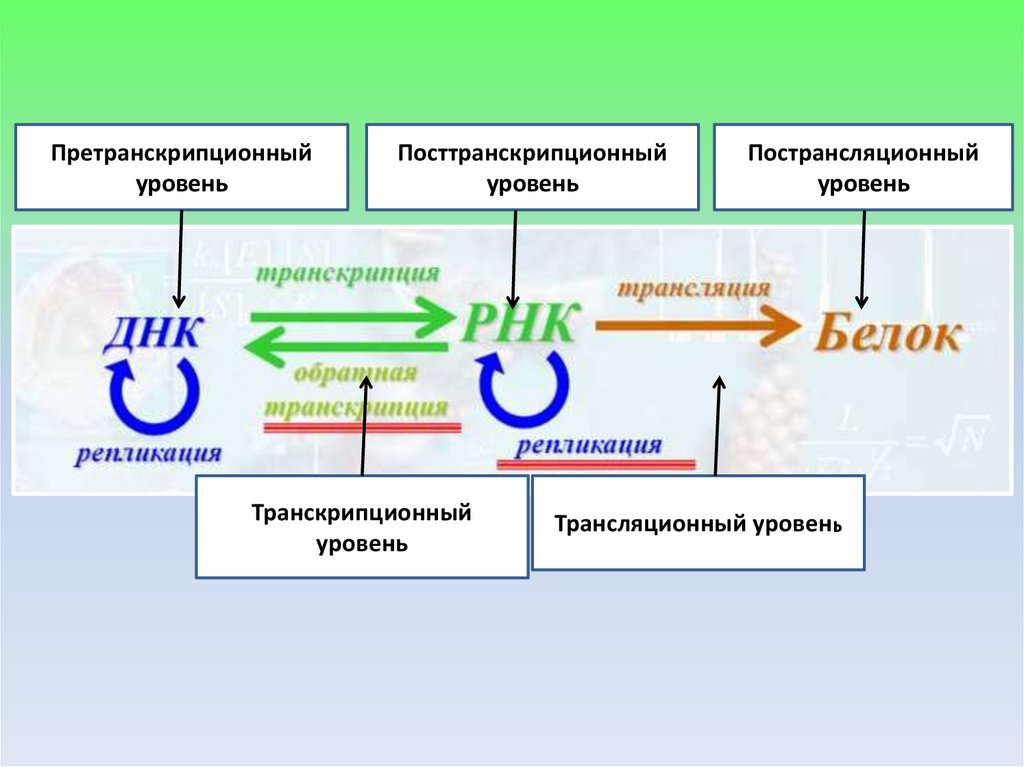
Претранскрипционныйуровень
Посттранскрипционный
уровень
Транскрипционный
уровень
Пострансляционный
уровень
Трансляционный уровень
6.
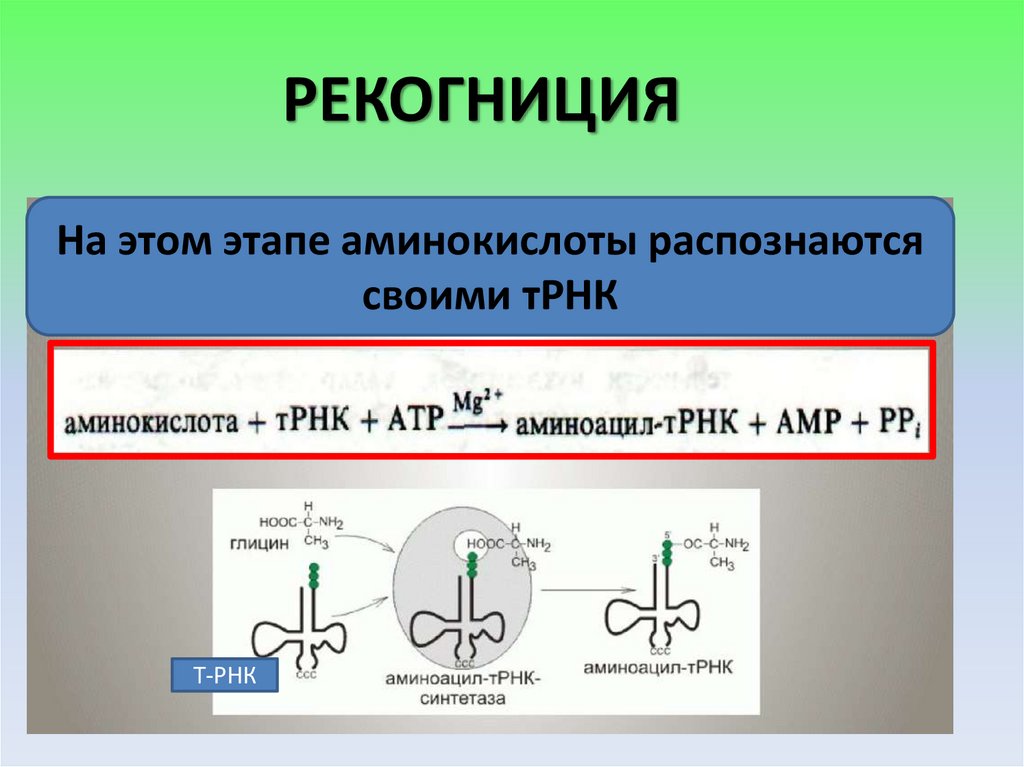
РЕКОГНИЦИЯНа этом этапе аминокислоты распознаются
своими тРНК
Т-РНК
7.
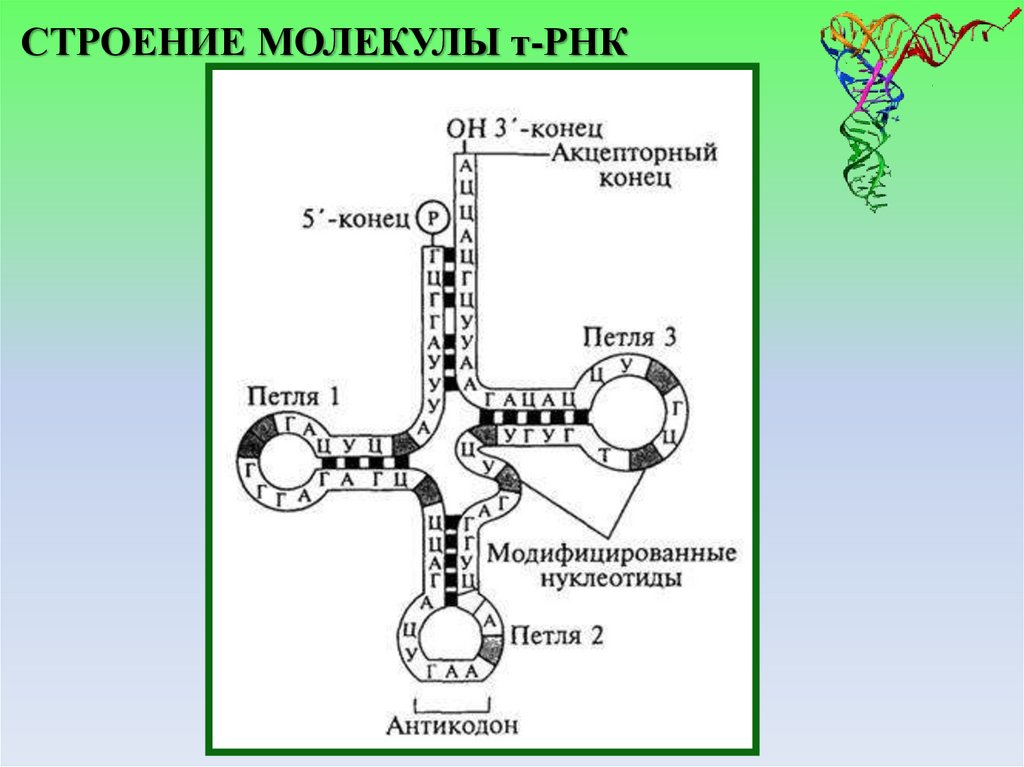
СТРОЕНИЕ МОЛЕКУЛЫ т-РНК8.
Аминоацил-тРНК-синтетазаДля каждой аминокислоты существует своя т-РНК,
20 аминокислот кодирует 61 кодон, значит существует
61 т-РНК
Аминокислота ковалентно присоединяется к 3'концу
молекулы с помощью специфичного для каждого типа
т-РНК фермента – аминоацил-тРНК-синтетазы
Для каждой аминокислоты существует своя
аминоацил-тРНК-синтетаза
9.
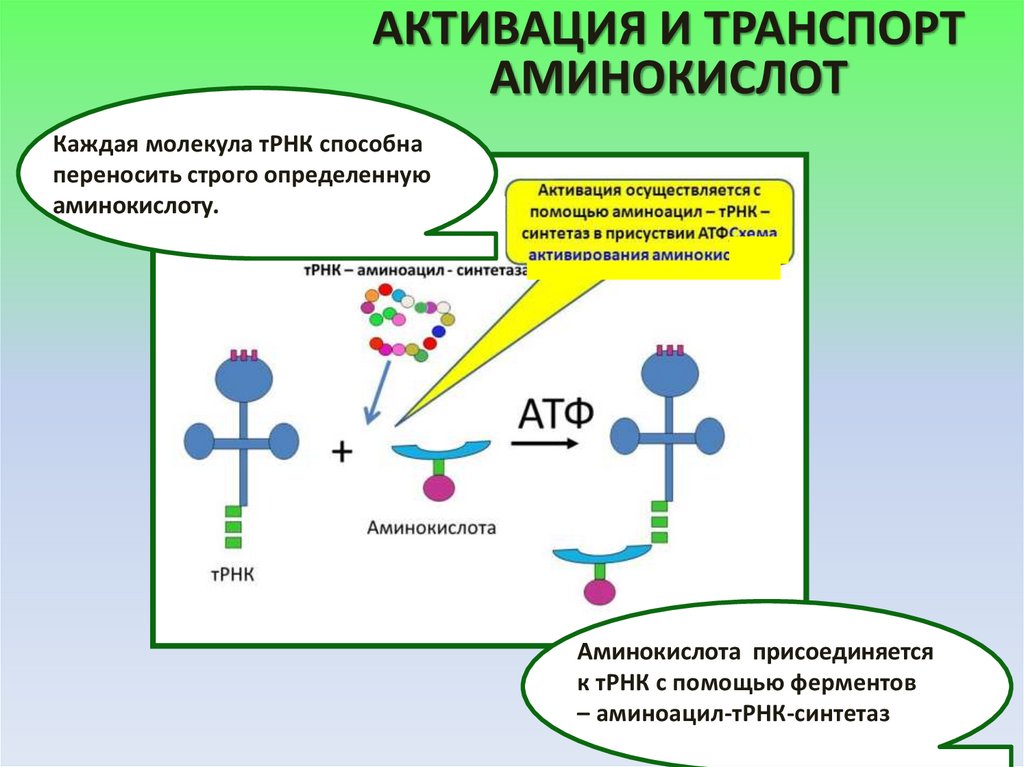
АКТИВАЦИЯ И ТРАНСПОРТАМИНОКИСЛОТ
Каждая молекула тРНК способна
переносить строго определенную
аминокислоту.
Аминокислота присоединяется
к тРНК с помощью ферментов
– аминоацил-тРНК-синтетаз
10.
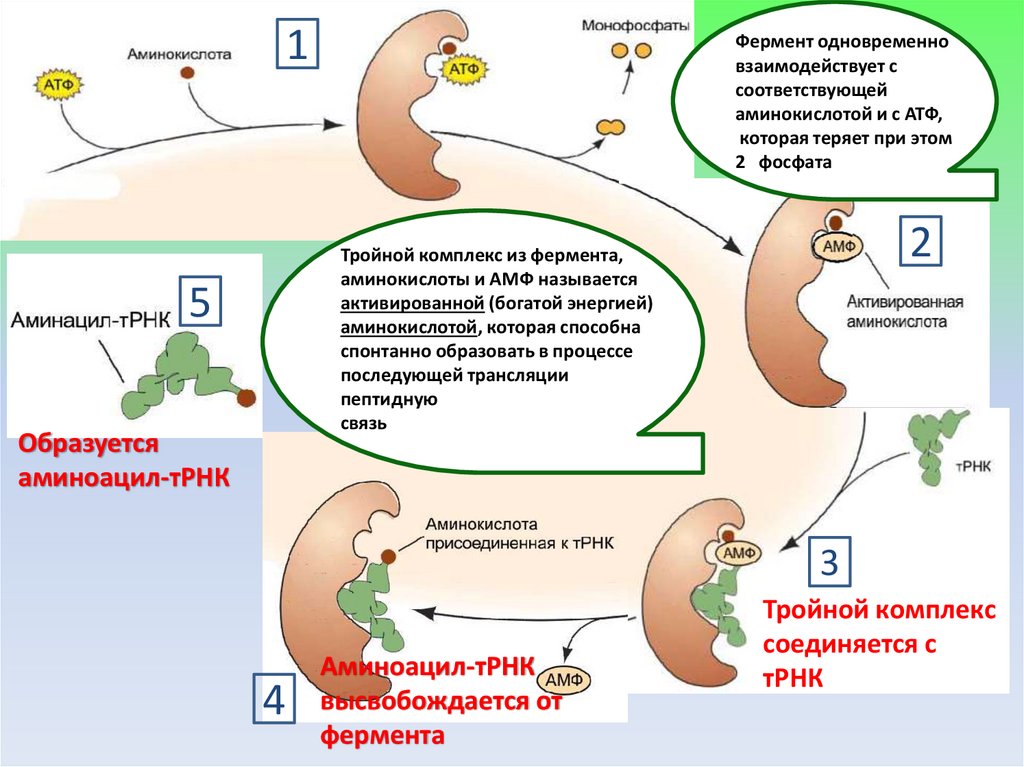
1Фермент одновременно
взаимодействует с
соответствующей
аминокислотой и с АТФ,
которая теряет при этом
2 фосфата
2
Тройной комплекс из фермента,
аминокислоты и АМФ называется
активированной (богатой энергией)
аминокислотой, которая способна
спонтанно образовать в процессе
последующей трансляции
пептидную
связь
5
Образуется
аминоацил-тРНК
3
4
Аминоацил-тРНК
высвобождается от
фермента
Тройной комплекс
соединяется с
тРНК
11.
ТРАНСЛЯЦИЯ – матричный процесс,включающий в себя определенные стадии в
определенной последовательности.
ИНИЦИАЦИЯ
ЭЛОНГАЦИЯ
ТЕРМИНАЦИЯ
12.
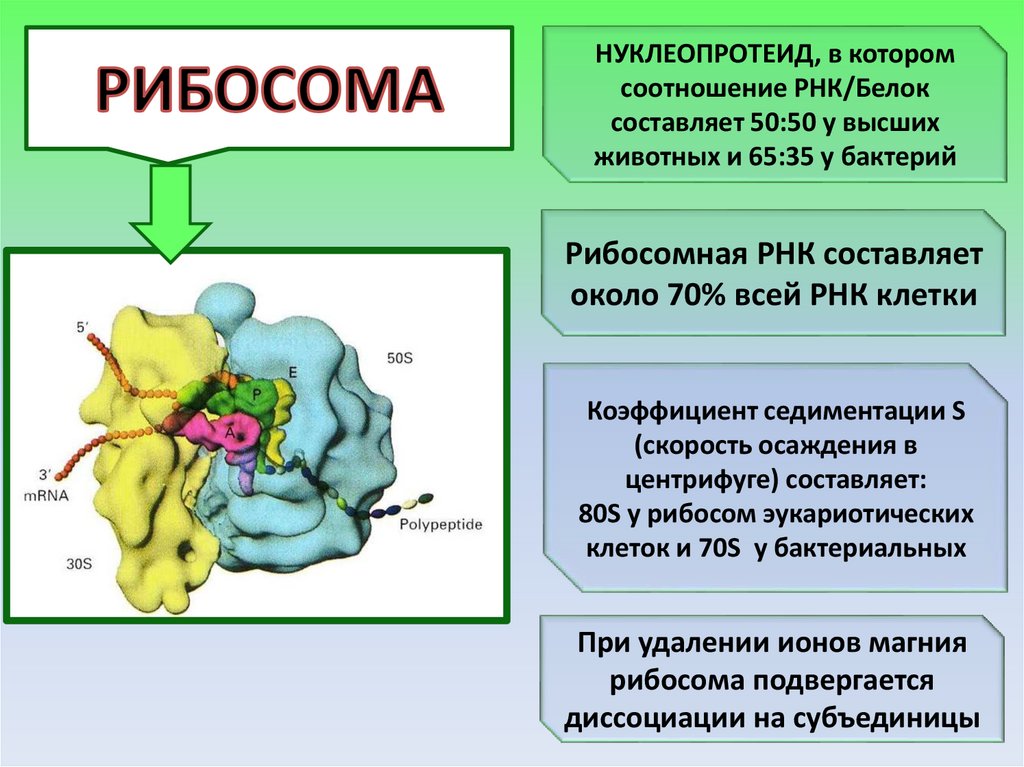
НУКЛЕОПРОТЕИД, в которомсоотношение РНК/Белок
составляет 50:50 у высших
животных и 65:35 у бактерий
Рибосомная РНК составляет
около 70% всей РНК клетки
Коэффициент седиментации S
(скорость осаждения в
центрифуге) составляет:
80S у рибосом эукариотических
клеток и 70S у бактериальных
При удалении ионов магния
рибосома подвергается
диссоциации на субъединицы
13.
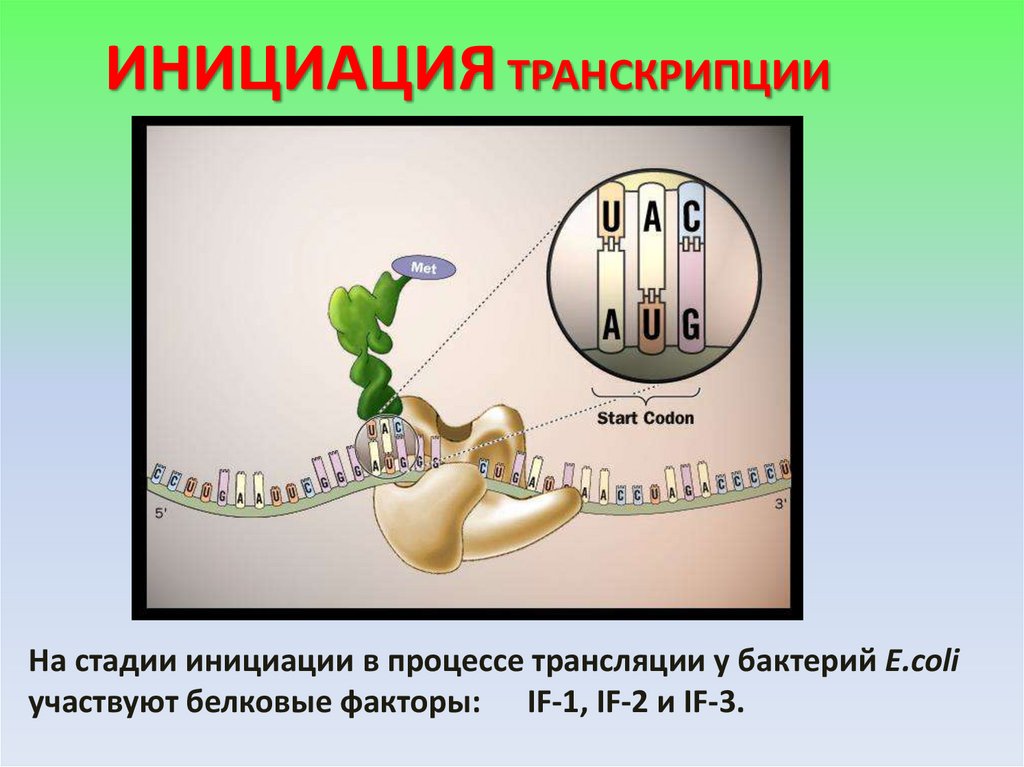
ИНИЦИАЦИЯ ТРАНСКРИПЦИИНа стадии инициации в процессе трансляции у бактерий E.coli
участвуют белковые факторы: IF-1, IF-2 и IF-3.
14.
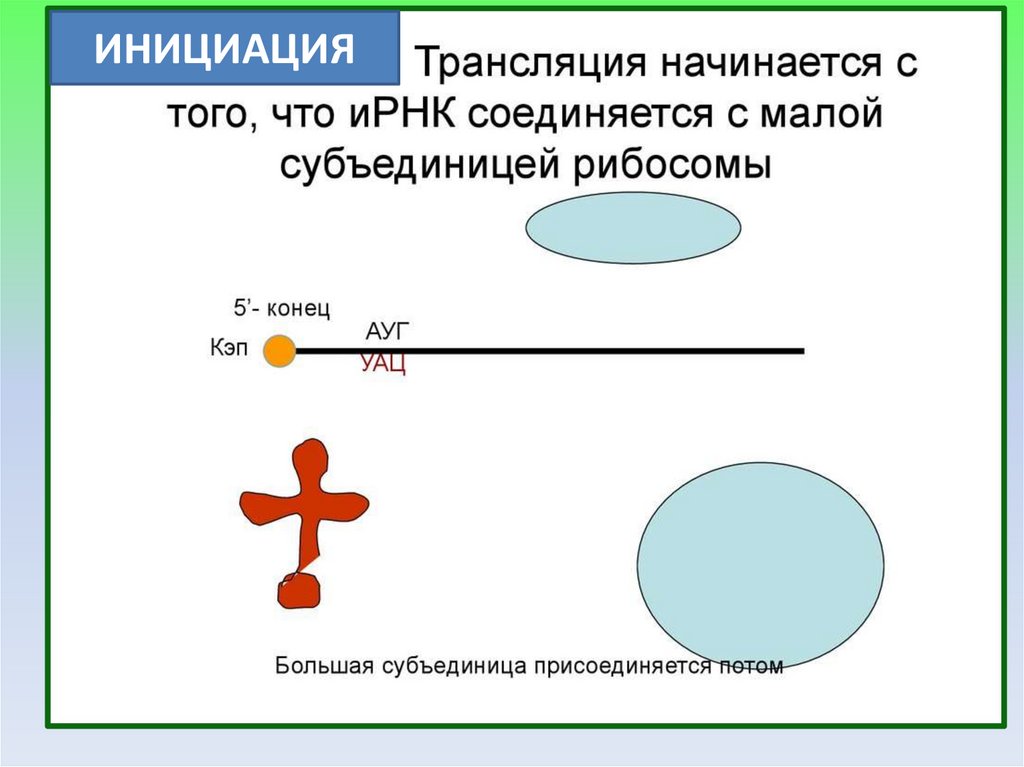
ИНИЦИАЦИЯ15.
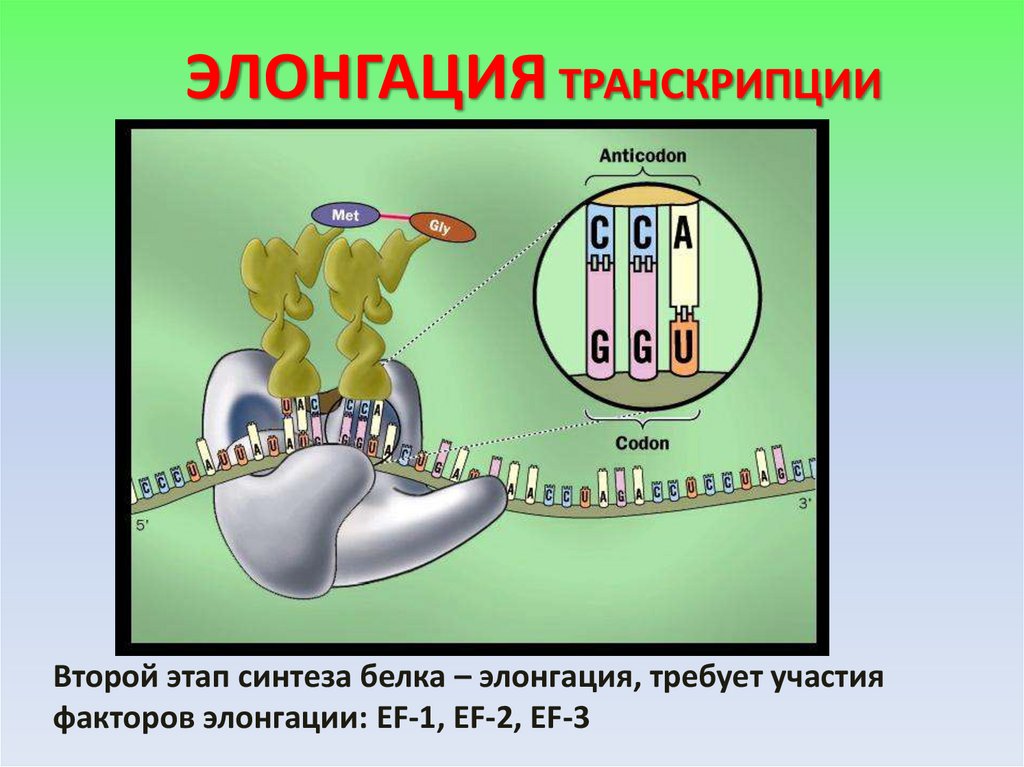
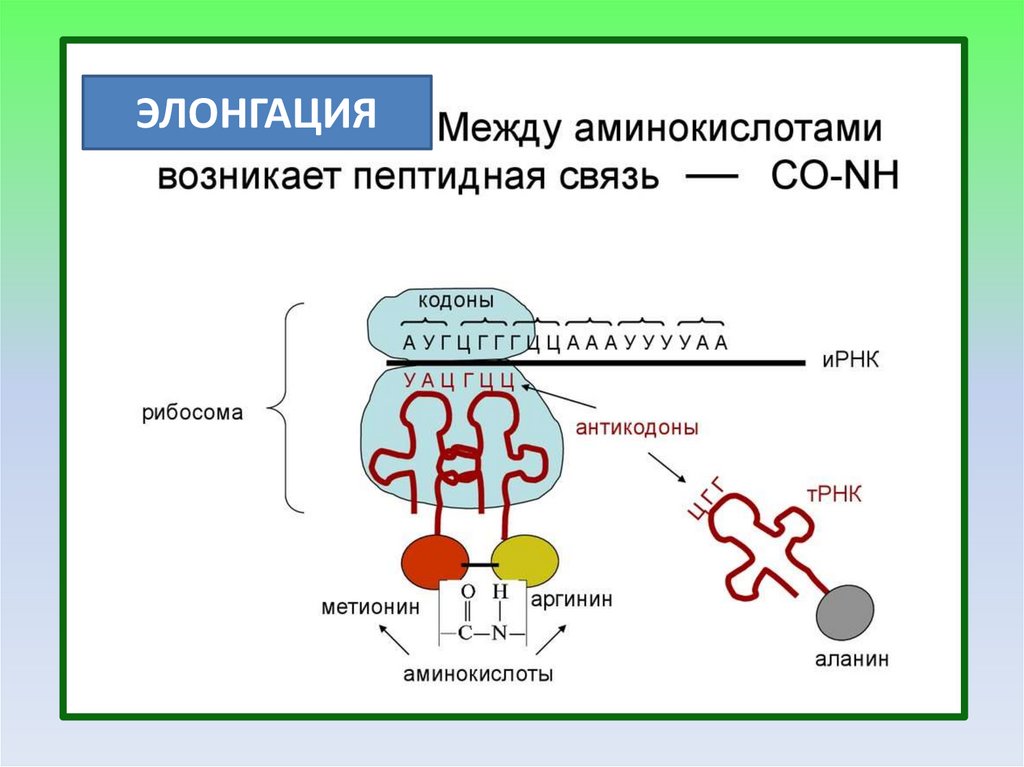
ЭЛОНГАЦИЯ ТРАНСКРИПЦИИВторой этап синтеза белка – элонгация, требует участия
факторов элонгации: EF-1, EF-2, EF-3
16.
ЭЛОНГАЦИЯ17.
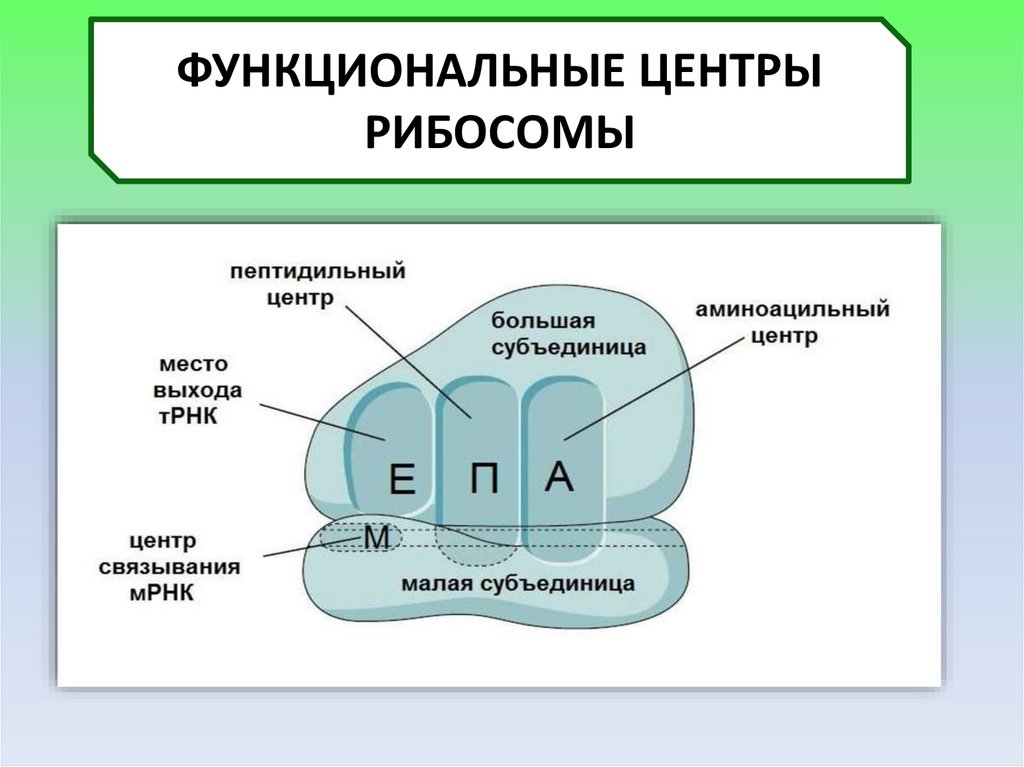
ФУНКЦИОНАЛЬНЫЕ ЦЕНТРЫРИБОСОМЫ
18.
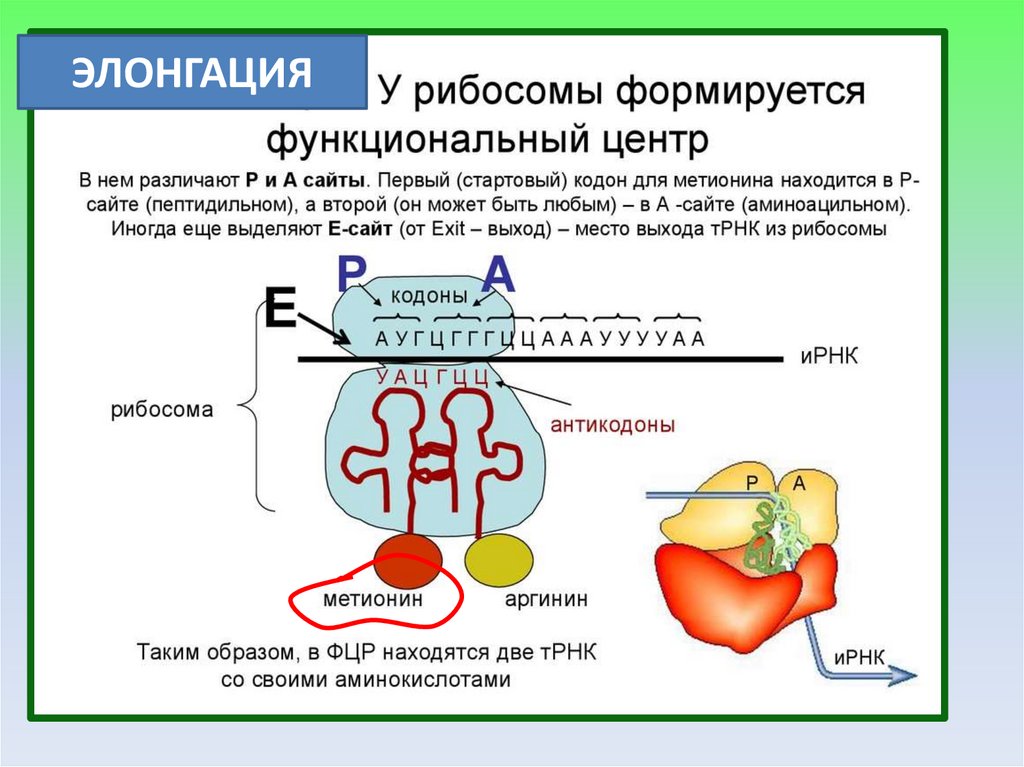
ЭЛОНГАЦИЯ19.
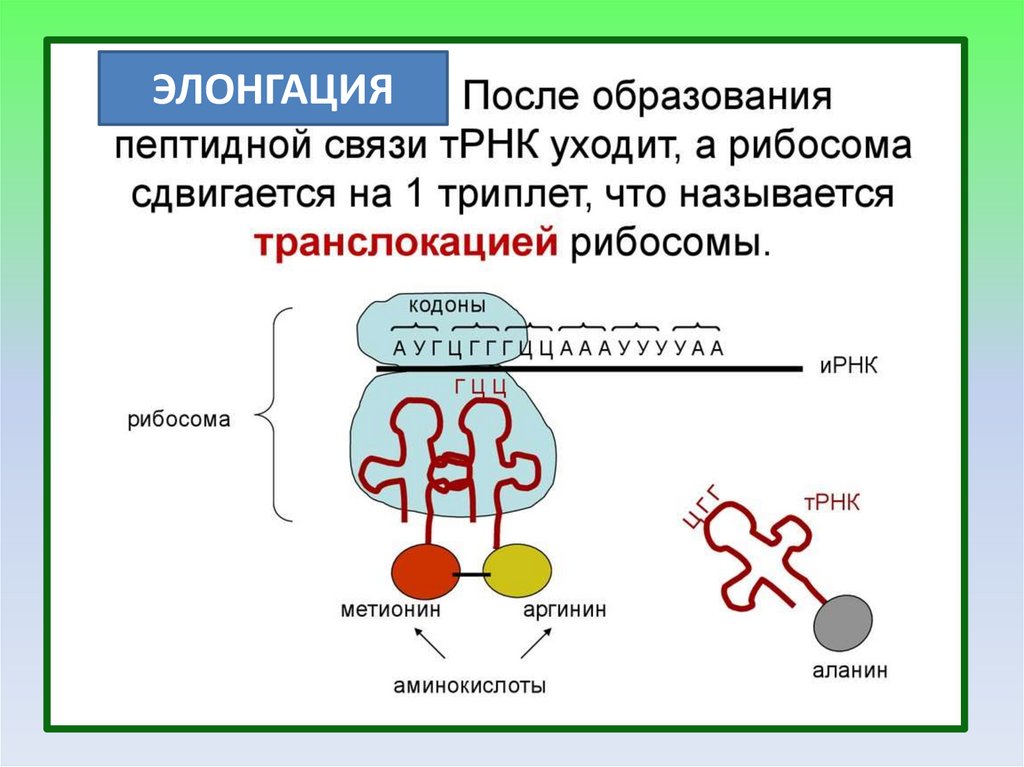
ЭЛОНГАЦИЯ20.
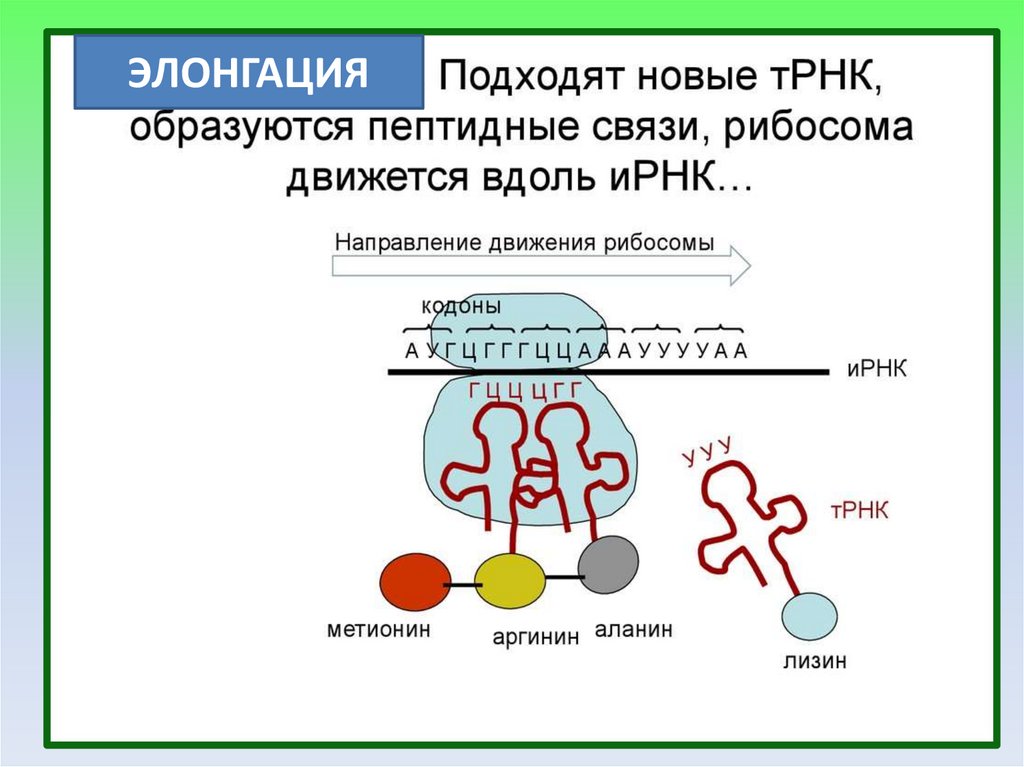
ЭЛОНГАЦИЯ21.
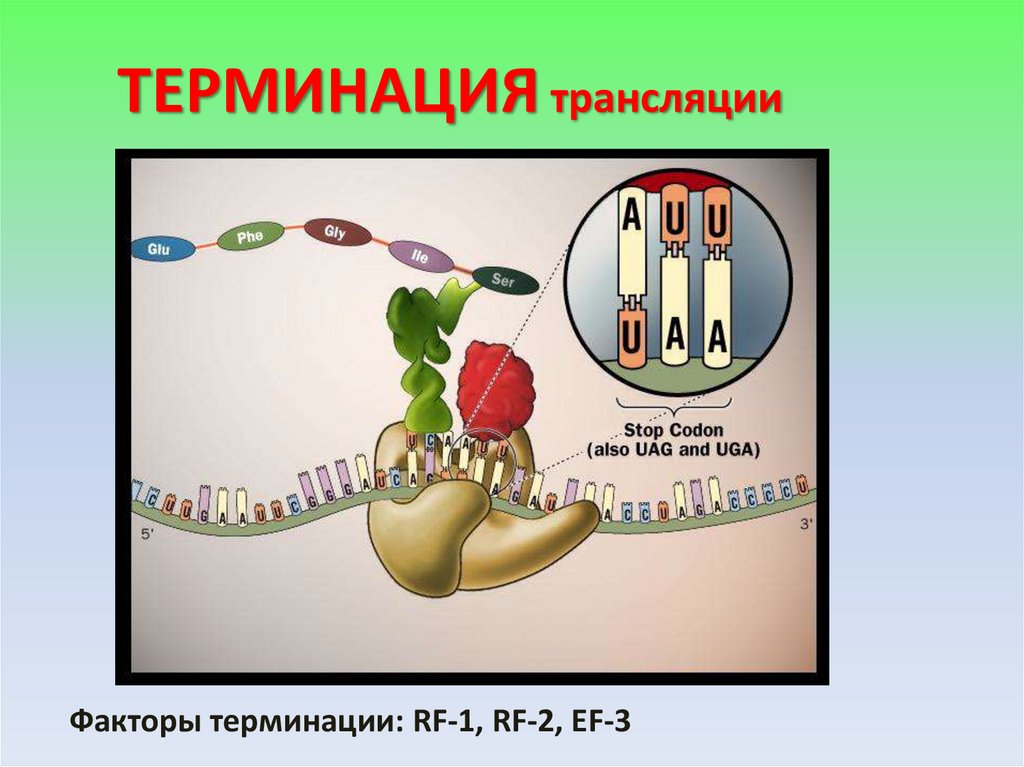
ТЕРМИНАЦИЯ трансляцииФакторы терминации: RF-1, RF-2, EF-3
22.
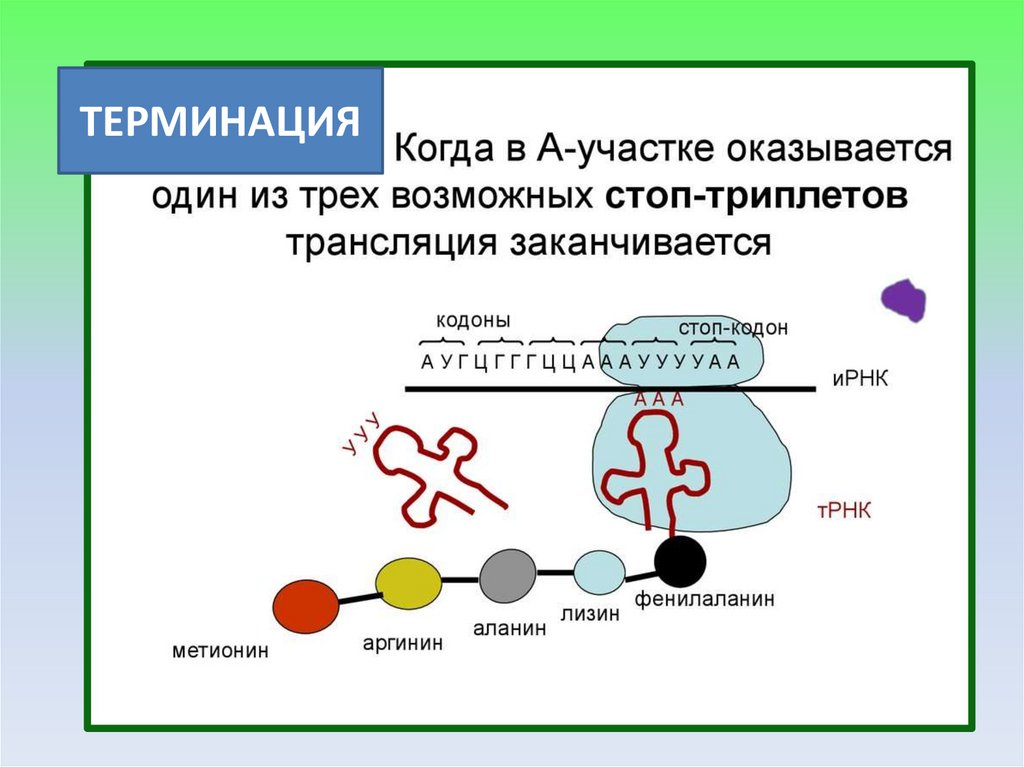
ТЕРМИНАЦИЯ23.
ТРАНСЛЯЦИЯ24.
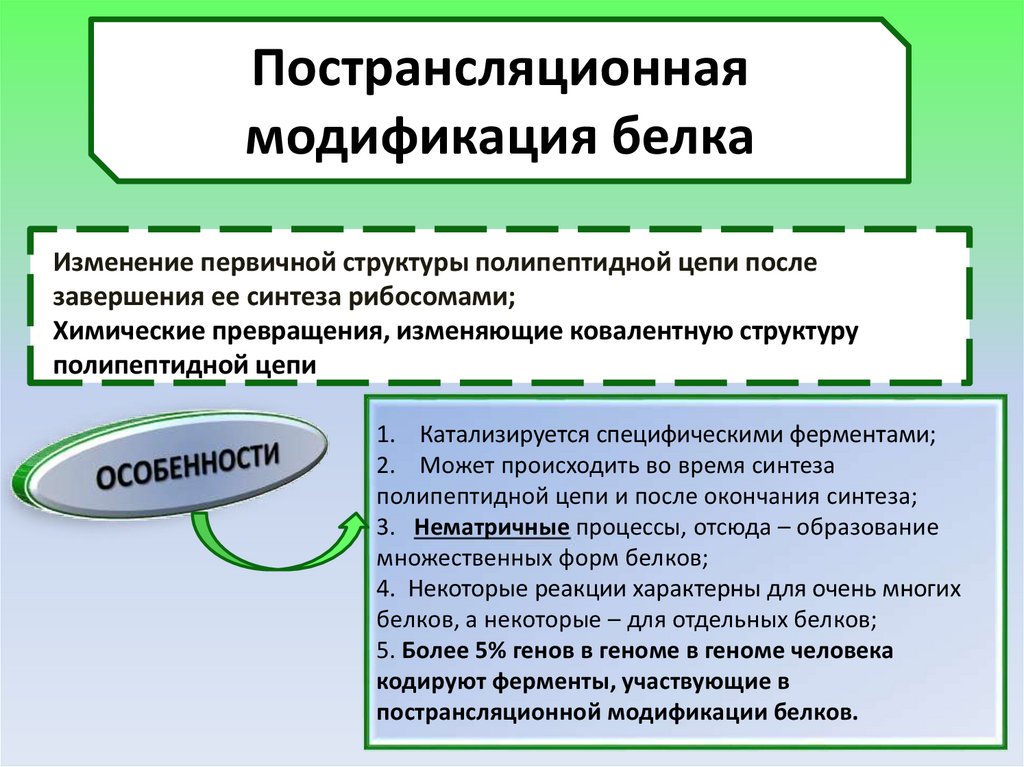
Пострансляционнаямодификация белка
Изменение первичной структуры полипептидной цепи после
это изменениеее
первичной
структуры полипептидной цепи после завершения ее
завершения
синтеза рибосомами;
рибосомами
Химические превращения,синтеза
изменяющие
ковалентную структуру
полипептидной цепи
1. Катализируется специфическими ферментами;
2. Может происходить во время синтеза
полипептидной цепи и после окончания синтеза;
3. Нематричные процессы, отсюда – образование
множественных форм белков;
4. Некоторые реакции характерны для очень многих
белков, а некоторые – для отдельных белков;
5. Более 5% генов в геноме в геноме человека
кодируют ферменты, участвующие в
пострансляционной модификации белков.
25.
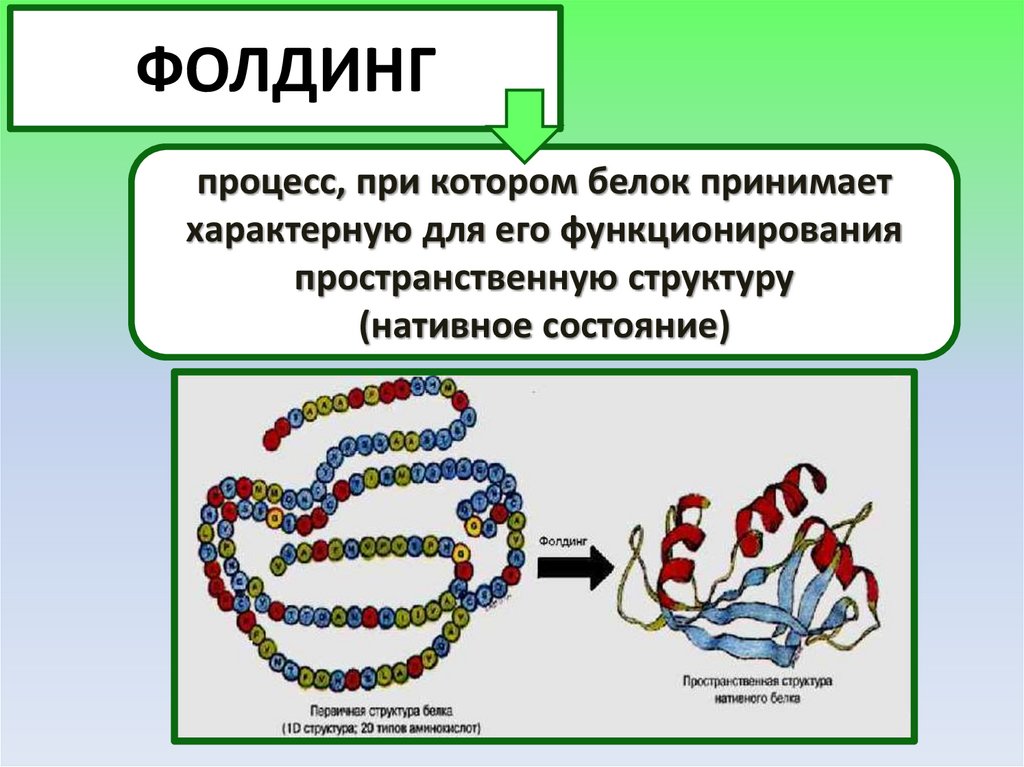
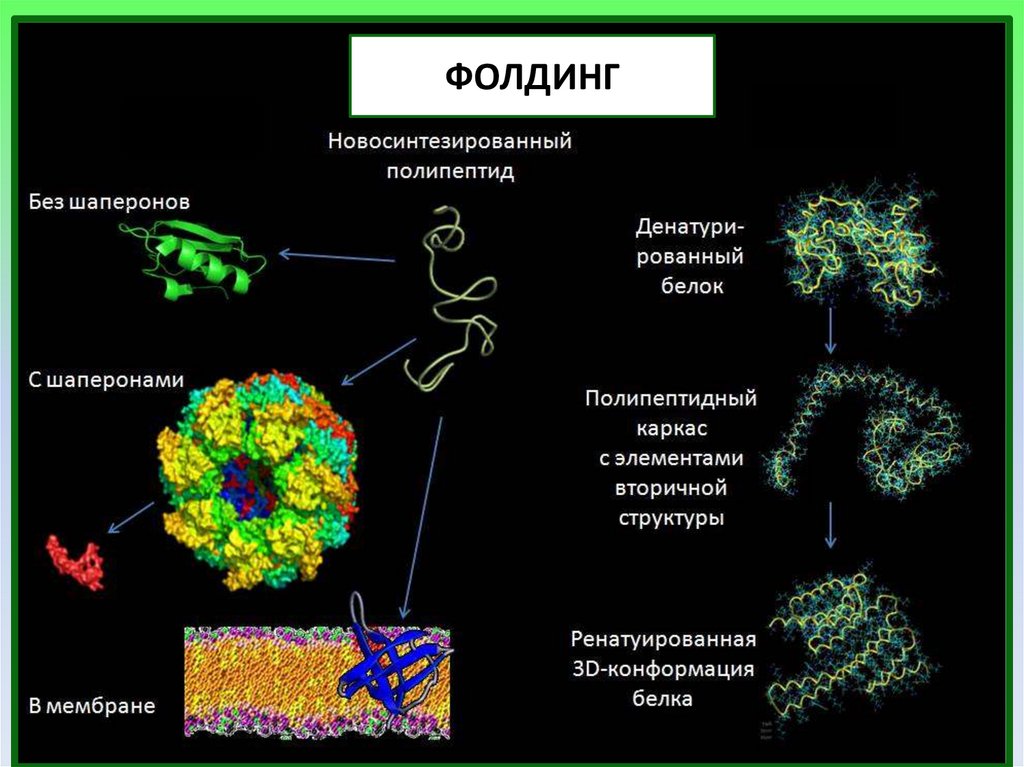
ФОЛДИНГпроцесс, при котором белок принимает
характерную для его функционирования
пространственную структуру
(нативное состояние)
26.
ФОЛДИНГ27.
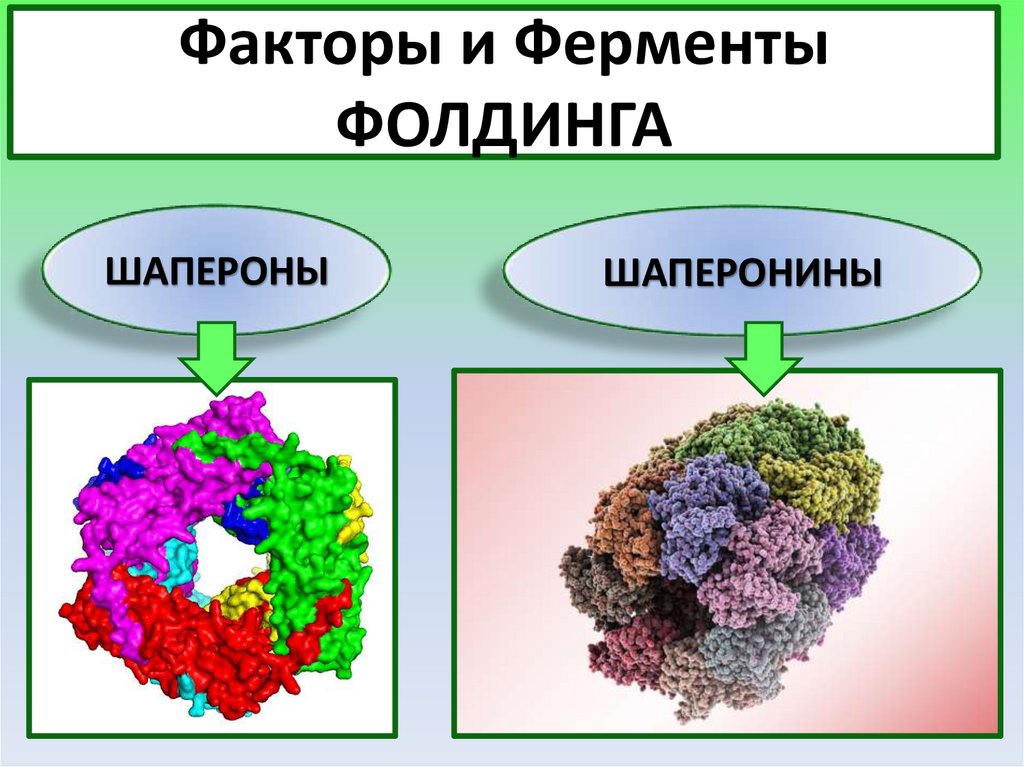
Факторы и ФерментыФОЛДИНГА
ШАПЕРОНЫ
ШАПЕРОНИНЫ
28.
ФУНКЦИИ ШАПЕРОНОВ29.
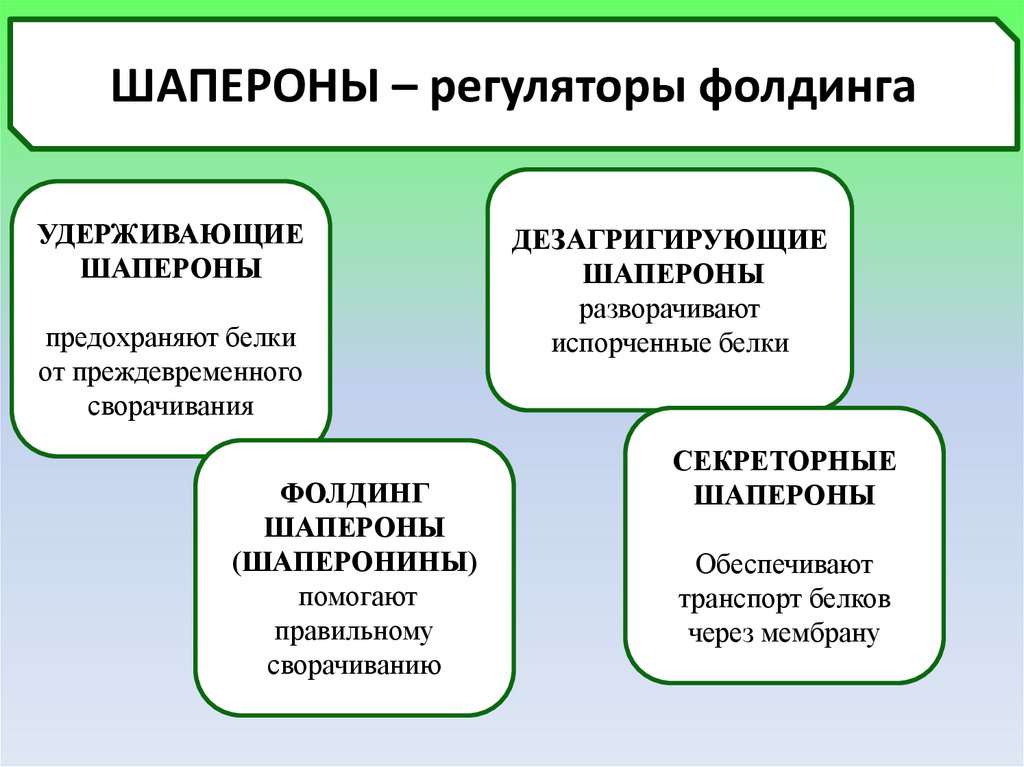
ШАПЕРОНЫ – регуляторы фолдингаУДЕРЖИВАЮЩИЕ
ШАПЕРОНЫ
предохраняют белки
от преждевременного
сворачивания
ФОЛДИНГ
ШАПЕРОНЫ
(ШАПЕРОНИНЫ)
помогают
правильному
сворачиванию
ДЕЗАГРИГИРУЮЩИЕ
ШАПЕРОНЫ
разворачивают
испорченные белки
СЕКРЕТОРНЫЕ
ШАПЕРОНЫ
Обеспечивают
транспорт белков
через мембрану
30.
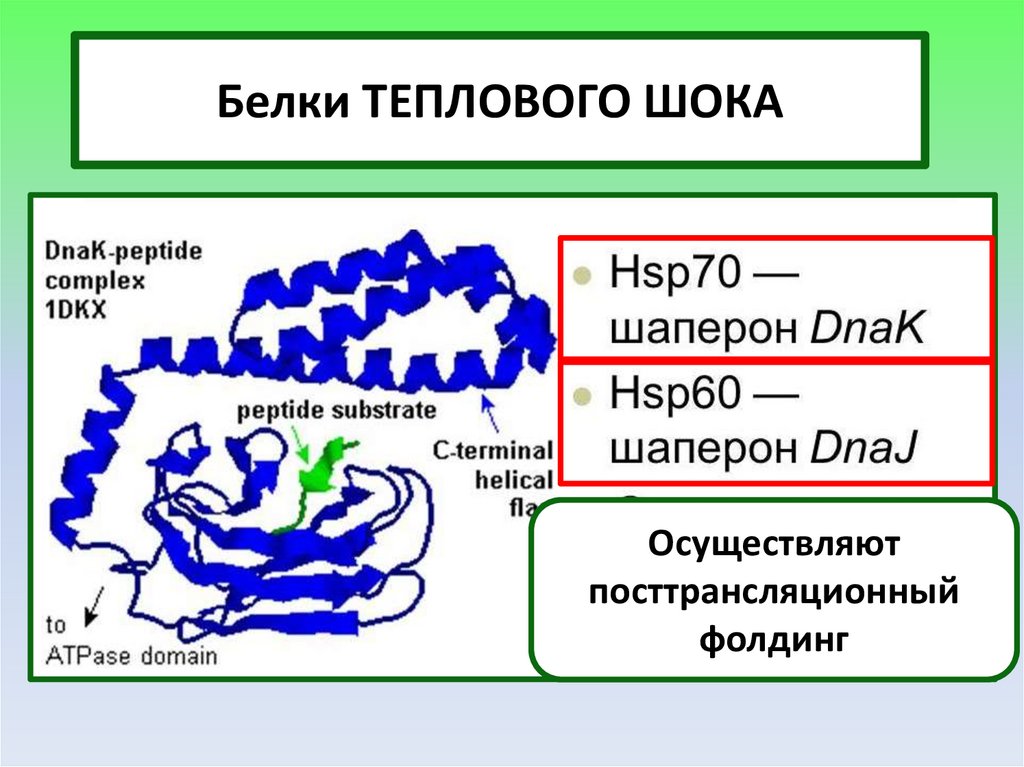
Белки ТЕПЛОВОГО ШОКАОсуществляют
посттрансляционный
фолдинг
31.
ПАТОЛОГИИ ФОЛДИНГА32.
КУРУ – «смеющаяся» СМЕРТЬМозжечковые расстройства
Нарушение походки
Дрожание конечностей,
нарушение артикуляции
Повышенная возбудимость
Эйфория, беспричинный
смех
Прогрессирующее
слабоумие
Встречается почти исключительно в
высокогорных районах Новой Гвинеи,
преимущественно у лиц, практикующих
каннибализм
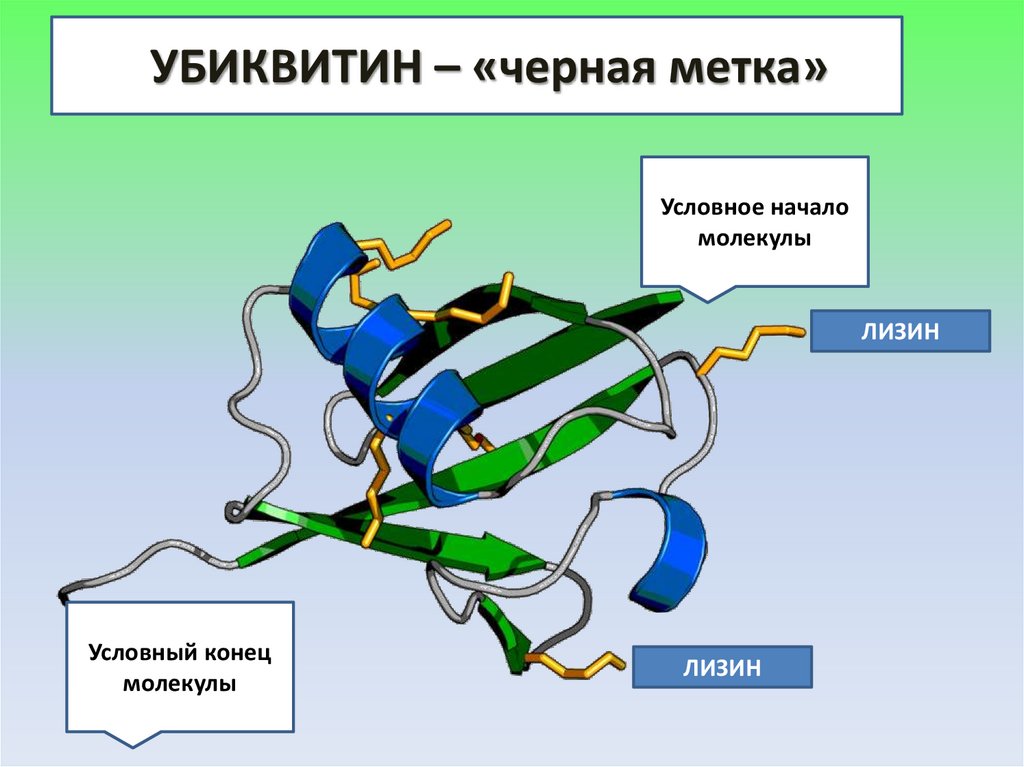
33.
УБИКВИТИН – «черная метка»Условное начало
молекулы
ЛИЗИН
Условный конец
молекулы
ЛИЗИН
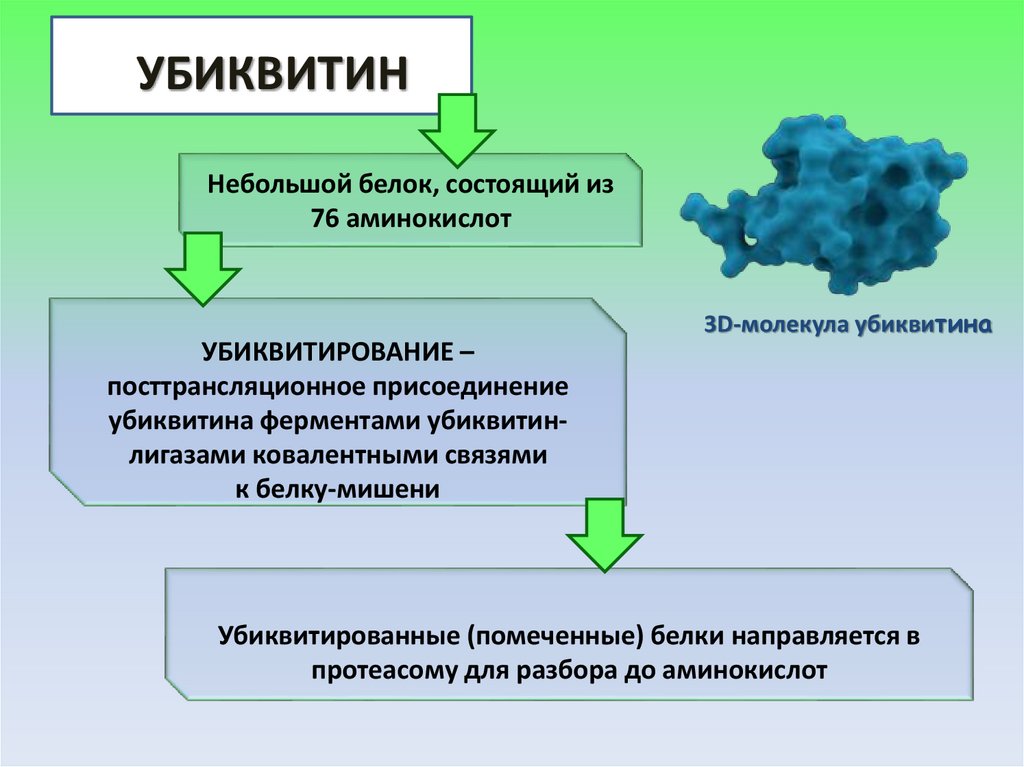
34.
УБИКВИТИННебольшой белок, состоящий из
76 аминокислот
3D-молекула убиквитина
УБИКВИТИРОВАНИЕ –
посттрансляционное присоединение
убиквитина ферментами убиквитинлигазами ковалентными связями
к белку-мишени
Убиквитированные (помеченные) белки направляется в
протеасому для разбора до аминокислот
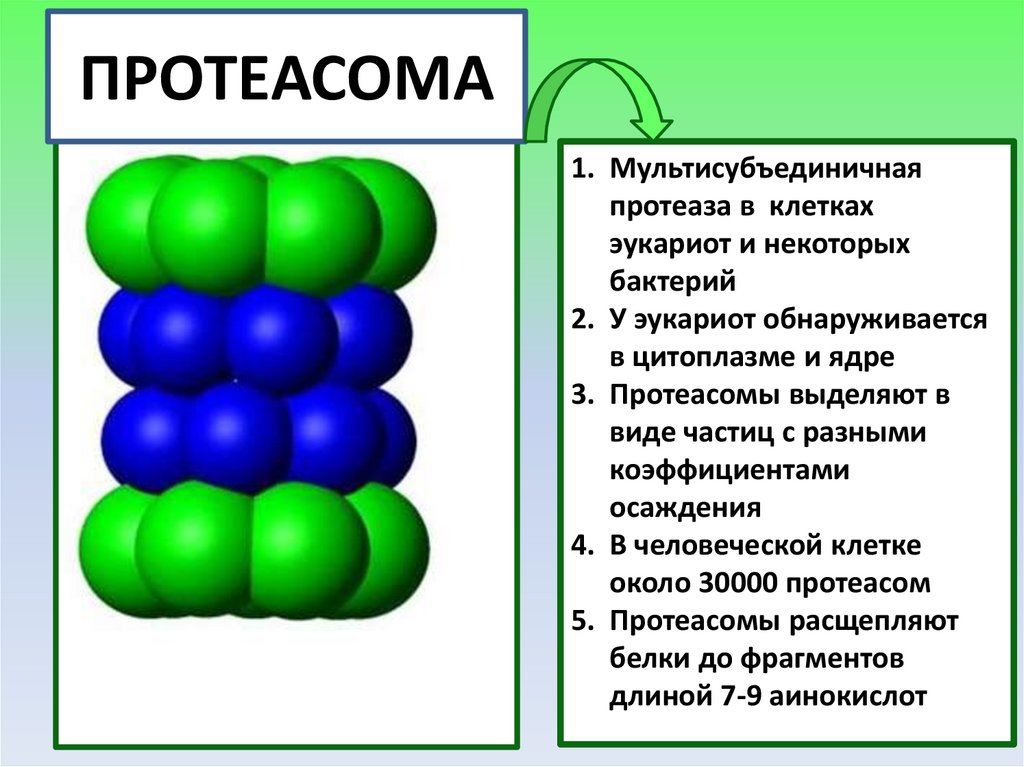
35.
ПРОТЕАСОМА1. Мультисубъединичная
протеаза в клетках
эукариот и некоторых
бактерий
2. У эукариот обнаруживается
в цитоплазме и ядре
3. Протеасомы выделяют в
виде частиц с разными
коэффициентами
осаждения
4. В человеческой клетке
около 30000 протеасом
5. Протеасомы расщепляют
белки до фрагментов
длиной 7-9 аинокислот
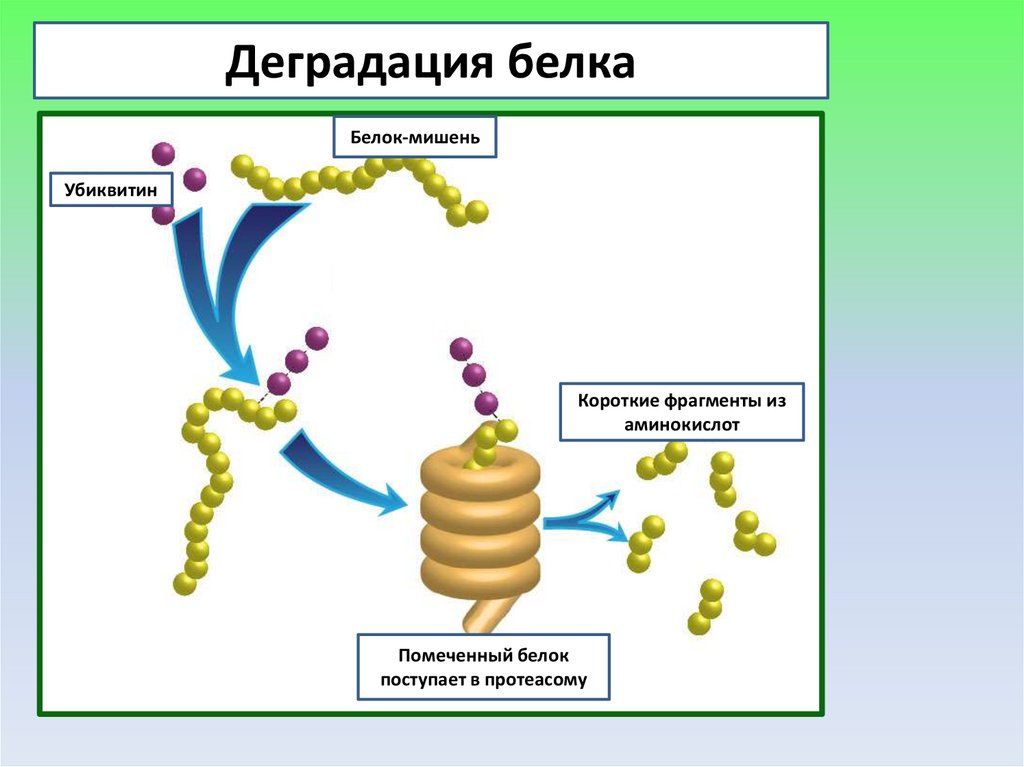
36.
Деградация белкаБелок-мишень
Убиквитин
Короткие фрагменты из
аминокислот
Помеченный белок
поступает в протеасому
37.
Решениезадач
38.
РАБОТА 1. Определение строения молекулы белка поструктуре ДНК, РНК
Задача 1. Фрагмент одной цепи ДНК имеет последовательность
нуклеотидов: 5' … Г Т А Т Ц Т А А А Ц А Т … 3'.
Определите последовательность нуклеотидов на второй цепи
ДНК, на и-РНК и последовательность аминокислот во
фрагменте молекулы белка, используя таблицу генетического
кода. В молекулярной генетике принято смысловую ДНК
писать сверху, транскрибируемую – снизу.
Пример решения и правильной записи задачи:
ДНК смысловая:
5'… Г Т А Т Ц Т А А А Ц А Т …3'
ДНК транскрибируемая: 3'… Ц А Т А Г А Т Т Т Г Т А … 5'
и-РНК:
5' ГУА – УЦУ – ААА – ЦАУ 3'
белок:
вал – сер – лиз – гис
39.
РАБОТА 2. Определение изменения в строении молекулы белкапосле мутаций
Задача 8. Какие изменения произойдут в строении белка, если в
кодирующем его участке ДНК: 3ʹ ТАА-ЦАА-АГА-АЦА-ААА 5ʹ
между 10-м и 11-м нуклеотидами включить цитозин, между 13-м и
14-м – тимин, а на конце прибавить еще один аденин.
Пример решения и правильной записи задачи:
ДНК: 3ʹ ТАА – ЦАА – АГА – АЦА – ААА 5ʹ
и-РНК: 5ʹ АУУ – ГУУ – УЦУ – УГУ – УУУ 3ʹ
белок: иле – вал – сер – цис – фен
ДНК (мут.) 3ʹ ТАА – ЦАА – АГА – АЦЦ – ААА – ТАА 5ʹ
и-РНК (мут.) 5ʹ АУУ – ГУУ – УЦУ – УГГ – УУУ – АУУ 3ʹ
белок (мут.) иле – вал – сер – три – фен – иле
Первые три аминокислоты останутся прежними, затем порядок и
состав аминокислот в составе молекулы белка изменятся из-за
произошедшей мутации.
40.
РАБОТА 3. Определение структуры молекулы белка поантикодонам тРНК
Задача 21. В биосинтезе фрагмента молекулы белка участвовали
последовательно молекулы т-РНК с антикодонами АЦЦ, ГУЦ, УГА,
ЦЦА, ААА.
Определите аминокислотную последовательность синтезируемого
фрагмента молекулы белка и нуклеотидную последовательность
участка двухцепочечной молекулы ДНК, в которой закодирована
информация о первичной структуре фрагмента белка.
Пример решения и правильной записи задачи:
антикодоны т-РНК: АЦЦ, ГУЦ, УГА, ЦЦА, ААА
кодоны и-РНК:
УГГ - ЦАГ - АЦУ - ГГУ - УУУ
аминокислоты:
три – глн – тре – гли – фен
фрагмент двуцепочечной ДНК:
1-ая цепь ДНК: 5ʹ АЦЦ – ГТЦ – ТГА – ЦЦА – ААА 3ʹ
2-ая цепь ДНК: 3ʹ ТГГ – ЦАГ – АЦТ – ГГТ-ТТТ 5ʹ
41.
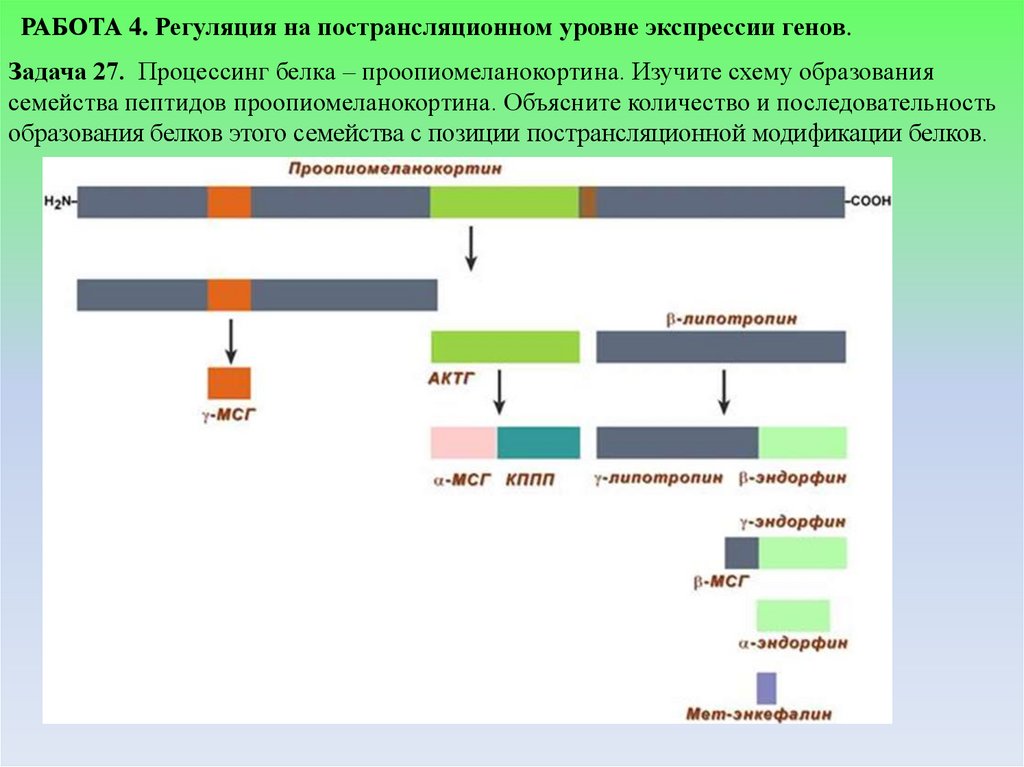
РАБОТА 4. Регуляция на пострансляционном уровне экспрессии генов.Задача 27. Процессинг белка – проопиомеланокортина. Изучите схему образования
семейства пептидов проопиомеланокортина. Объясните количество и последовательность
образования белков этого семейства с позиции пострансляционной модификации белков.
42.
Эталон ответа:Проопиомеланокортин (ПОМК) синтезируется в виде молекулы
предшественника, состоящей примерно из 285 аминокислотных остатков, и
подвергается различному процессингу в разных отделах гипофиза.
Процессинг белка ПОМК в передней и промежуточной долях гипофиза
протекает по-разному.
У взрослых людей промежуточная доля рудиментарна, но она активна у
плодов человека, женщин в поздние сроки беременности, а также у многих
видов животных. Процессинг белка ПОМК в периферических тканях
(кишечник, плацента, мужской половой тракт) сходен с таковым в
промежуточной доле гипофиза.
Существуют три основные группы пептидов семейства ПОМК:
1) АКТГ, из которого могут образовываться меланоцитстимулирующий
гормон (а-МСГ) и кортикотропиноподобный пептид промежуточной доли;
2) Р-липотропин (р-ЛПГ), служащий предшественником а-липотропина, РМСГ и Р-эндорфина и, следовательно, а- и у-эндорфинов;
3) большой концевой пептид, из которого образуется у-МСГ.
Сегмент прогормона отщепляется и подвергается посттрансляционной
модификации путем гликозилирования, ацетилирования и
фосфорилирования.
43.
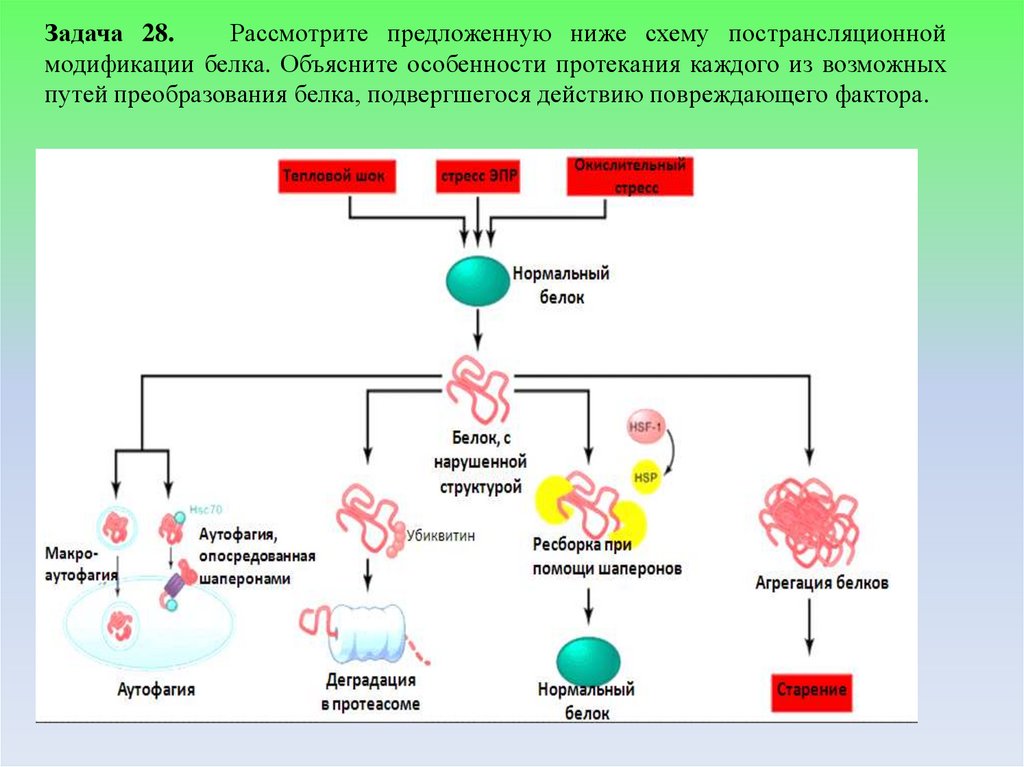
Задача 28.Рассмотрите предложенную ниже схему пострансляционной
модификации белка. Объясните особенности протекания каждого из возможных
путей преобразования белка, подвергшегося действию повреждающего фактора.













 Биология
Биология








