Похожие презентации:
Молекулярные методы исследования. Разработка и валидация методик
1.
Молекулярные методыисследования. Разработка и
валидация методик.
Лектор:
Валиахметова Эльвира Раисовна
Младший научный сотрудник ОМД
29.03.2022
1
2.
Введение.Молекулярные методы исследования
это методы молекулярной биологии с
помощью которых можно исследователь
молекулы ДНК и/или РНК.
•Гель-электрофорез;
•Капиллярный электрофорез;
•Рестрикционный анализ;
•Секвенирование;
•Блотинг и гибридизация нуклеиновых кислот. Нозерн-гибридизация. Саузернгибридизация. Вестерн-гибридизация;
•Полимеразная цепная реакция (ПЦР).
2
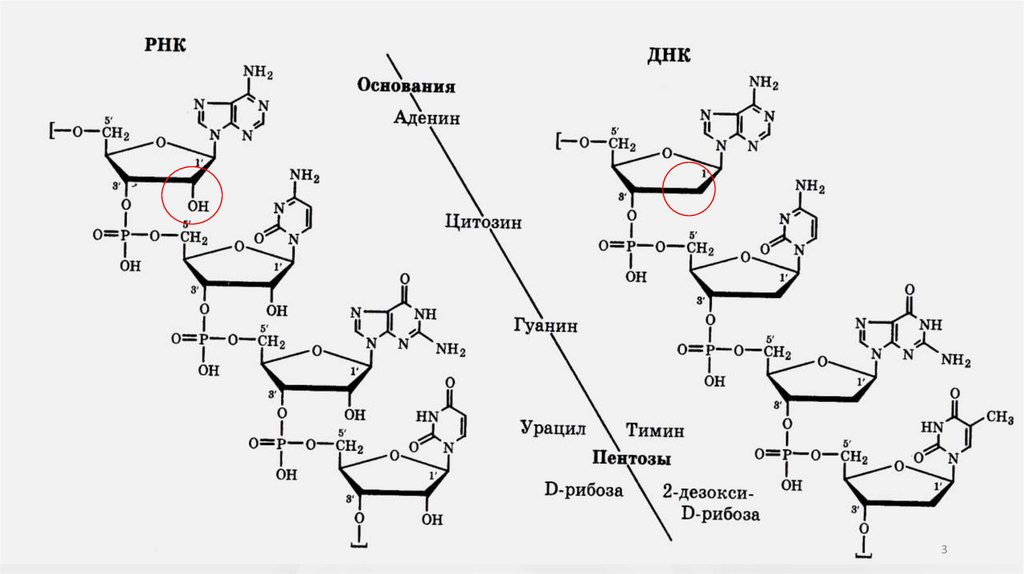
3.
Структура ДНК и РНК3
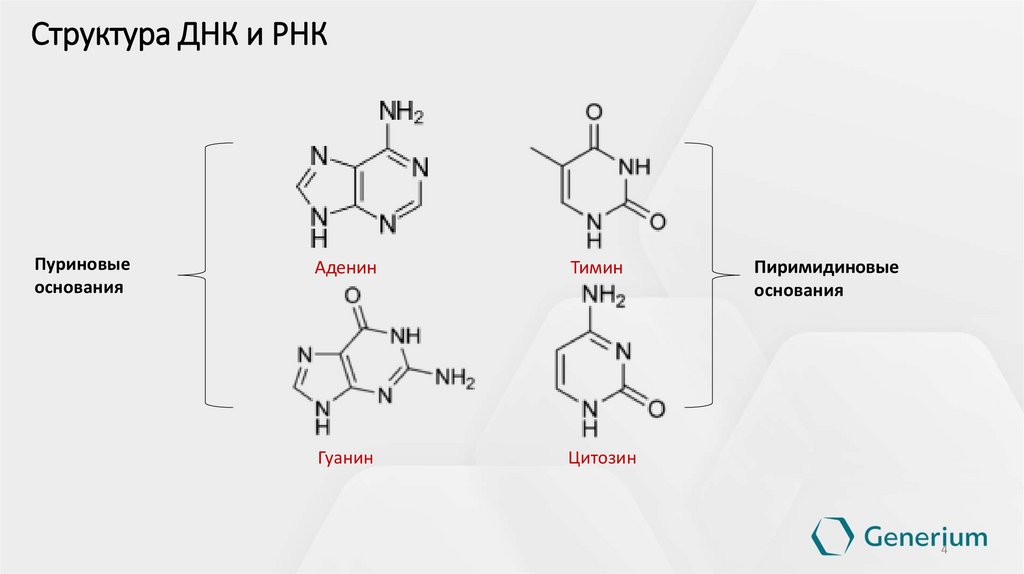
4.
Структура ДНК и РНКПуриновые
основания
Аденин
Тимин
Гуанин
Цитозин
Пиримидиновые
основания
4
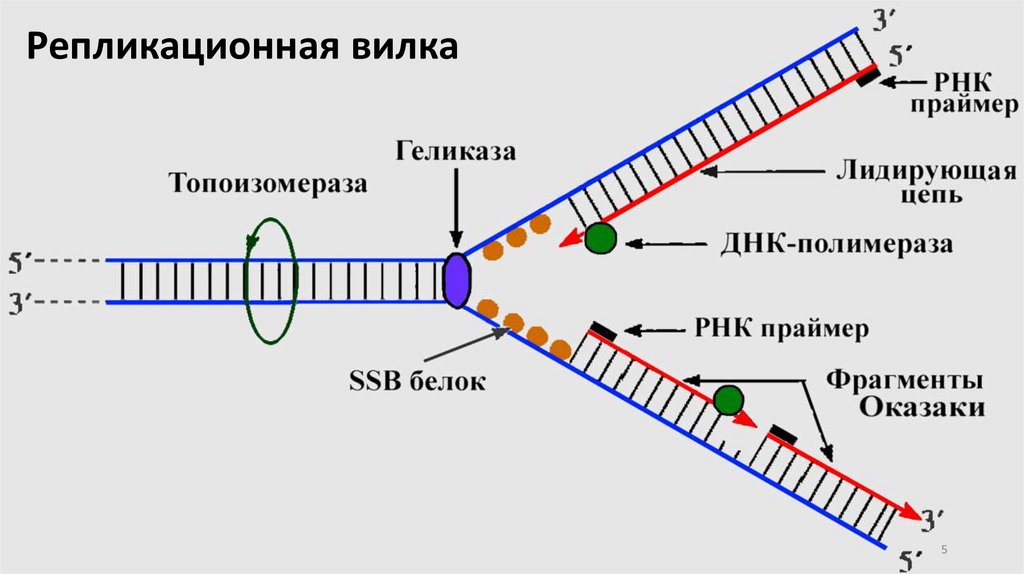
5.
Репликационная вилка5
6. Рестрикционный анализ
Реакционная смесь:Вода;
Буфер;
Рестриктаза(ы);
ДНК.
Rec II
Реакция проходит при 37 ◦С
Полиндромная
последовательность
Рестриктазы II типа узнают определённую
последовательность и разрезают двойную
спираль ДНК в определённой фиксированной
точке внутри этой последовательности.
6
7. Рестрикционный анализ
В 1970 году Гамильтон О. Смит , Томас Келли и Кент Уилкоксвыделили и охарактеризовали первый рестрикционный
фермент типа II, Hind II, из бактерии Haemophilus influenzae
7
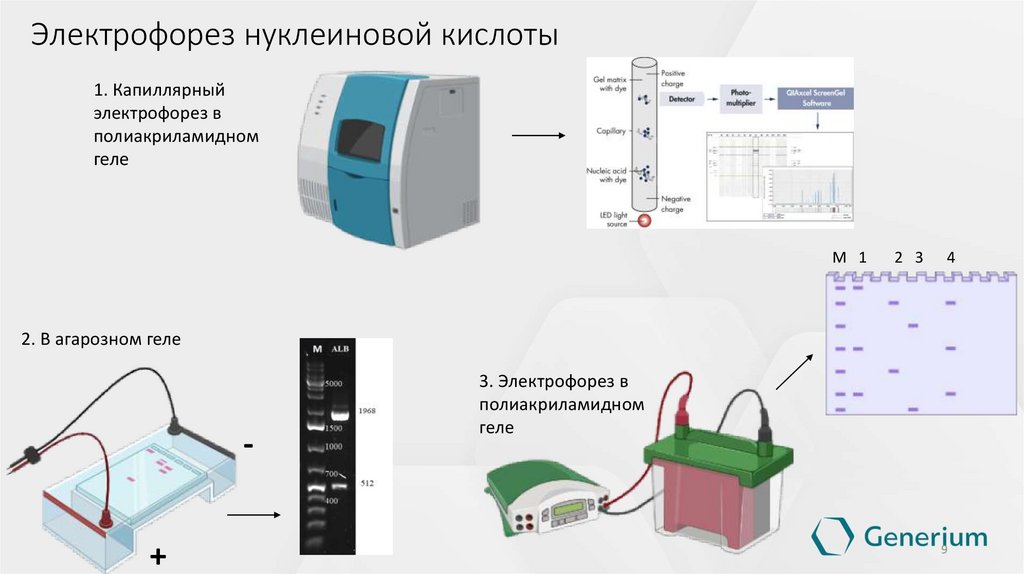
8. Электрофорез нуклеиновой кислоты
89. Электрофорез нуклеиновой кислоты
1. Капиллярныйэлектрофорез в
полиакриламидном
геле
М 1
2 3
4
2. В агарозном геле
+
3. Электрофорез в
полиакриламидном
геле
9
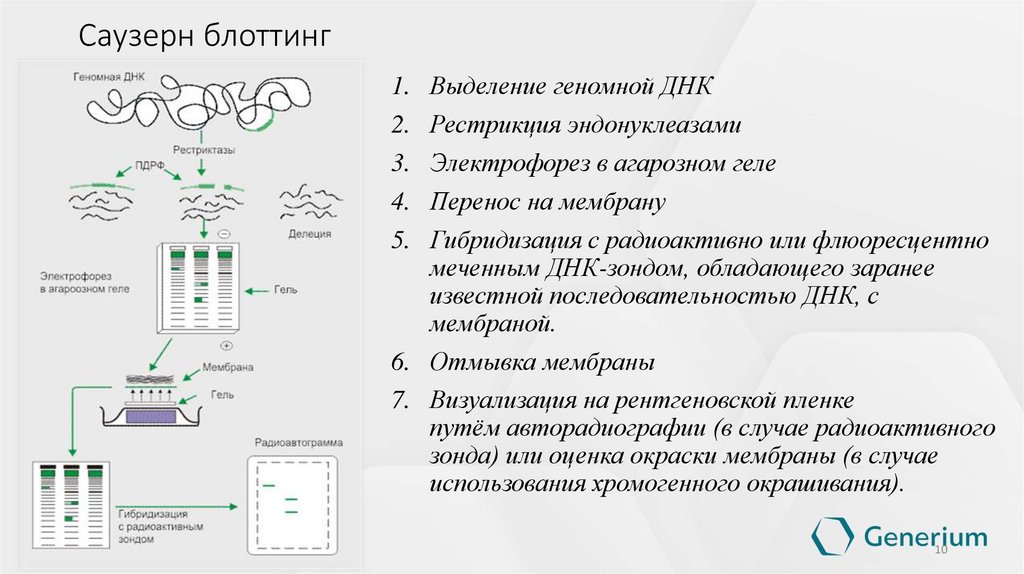
10. Саузерн блоттинг
1. Выделение геномной ДНК2. Рестрикция эндонуклеазами
3. Электрофорез в агарозном геле
4. Перенос на мембрану
5. Гибридизация с радиоактивно или флюоресцентно
меченным ДНК-зондом, обладающего заранее
известной последовательностью ДНК, с
мембраной.
6. Отмывка мембраны
7. Визуализация на рентгеновской пленке
путём авторадиографии (в случае радиоактивного
зонда) или оценка окраски мембраны (в случае
использования хромогенного окрашивания).
10
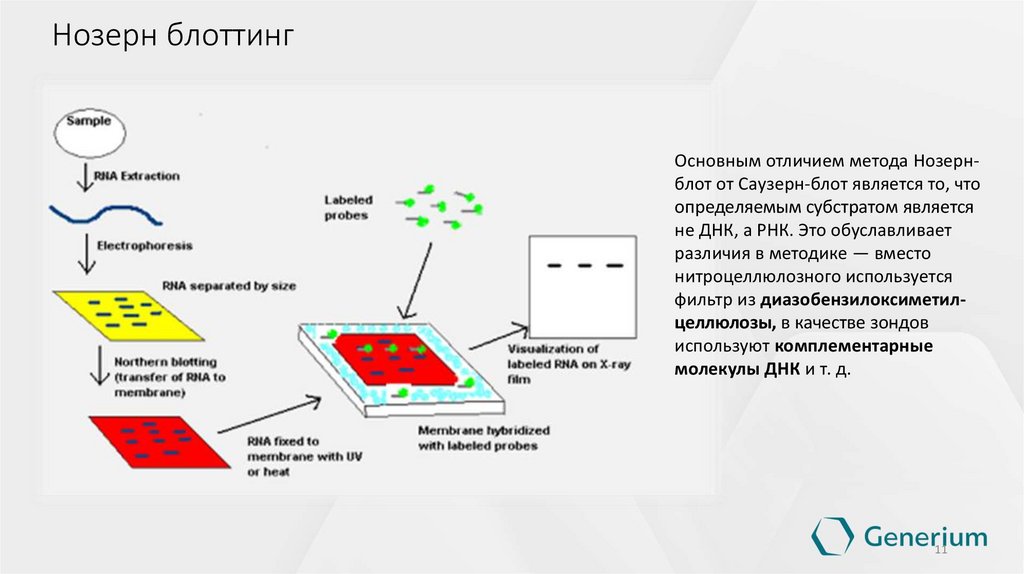
11. Нозерн блоттинг
Основным отличием метода Нозернблот от Саузерн-блот является то, чтоопределяемым субстратом является
не ДНК, а РНК. Это обуславливает
различия в методике — вместо
нитроцеллюлозного используется
фильтр из диазобензилоксиметилцеллюлозы, в качестве зондов
используют комплементарные
молекулы ДНК и т. д.
11
12.
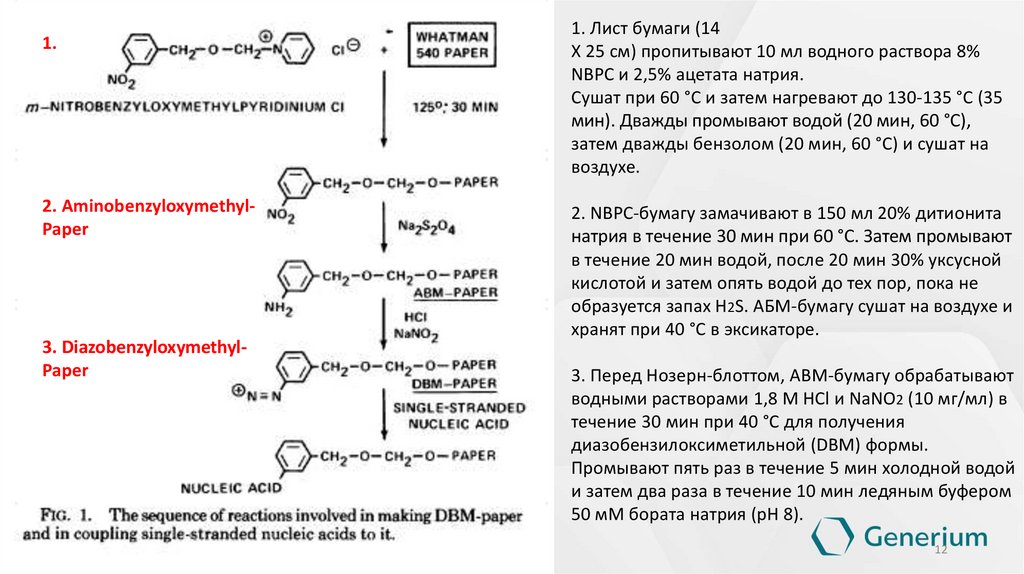
1.2. AminobenzyloxymethylPaper
3. DiazobenzyloxymethylPaper
1. Лист бумаги (14
Х 25 см) пропитывают 10 мл водного раствора 8%
NBPC и 2,5% ацетата натрия.
Сушат при 60 °С и затем нагревают до 130-135 °С (35
мин). Дважды промывают водой (20 мин, 60 °С),
затем дважды бензолом (20 мин, 60 °С) и сушат на
воздухе.
2. NBPC-бумагу замачивают в 150 мл 20% дитионита
натрия в течение 30 мин при 60 °С. Затем промывают
в течение 20 мин водой, после 20 мин 30% уксусной
кислотой и затем опять водой до тех пор, пока не
образуется запах H2S. АБМ-бумагу сушат на воздухе и
хранят при 40 °С в эксикаторе.
3. Перед Нозерн-блоттом, ABM-бумагу обрабатывают
водными растворами 1,8 М HCl и NaNO2 (10 мг/мл) в
течение 30 мин при 40 °С для получения
диазобензилоксиметильной (DBM) формы.
Промывают пять раз в течение 5 мин холодной водой
и затем два раза в течение 10 мин ледяным буфером
50 мМ бората натрия (рН 8).
12
13. Секвенирование. Секвенирование по Сэнгеру.
У дидезоксирибонуклеотидов (ddATP, ddGTP,ddCTP, or ddTTP) отсутствует 3'-гидроксильная
группа, поэтому после их включения в цепь
дальнейший синтез обрывается. Таким образом,
в каждой пробирке образуется набор фрагментов
ДНК разной длины, которые заканчиваются
одним и тем же нуклеотидом (в соответствии с
добавленным дидезоксинуклеотидом). После
завершения реакции содержимое пробирок
разделяют электрофорезом в полиакриламидном
геле в денатурирующих условиях и проводят
авторадиографию гелей. Продукты четырёх
реакций формируют «секвенирующую лестницу»,
которая позволяет «прочитать» нуклеотидную
последовательность фрагмента ДНК.
13
14.
Секвенирование.Секвенирование нового поколения Illumina/Solexa.
3′-O-азидометил 2′-деоксинуклеозид
трифосфаты (A, C, G и T), каждый с
отделяемой флюоресцентной меткой
своего цвета
*TCEP ( трис(2-карбоксиэтил)фосфин )
добавляют для отсоединения Oазидометила и дальнейшей
амплификации.
14
15.
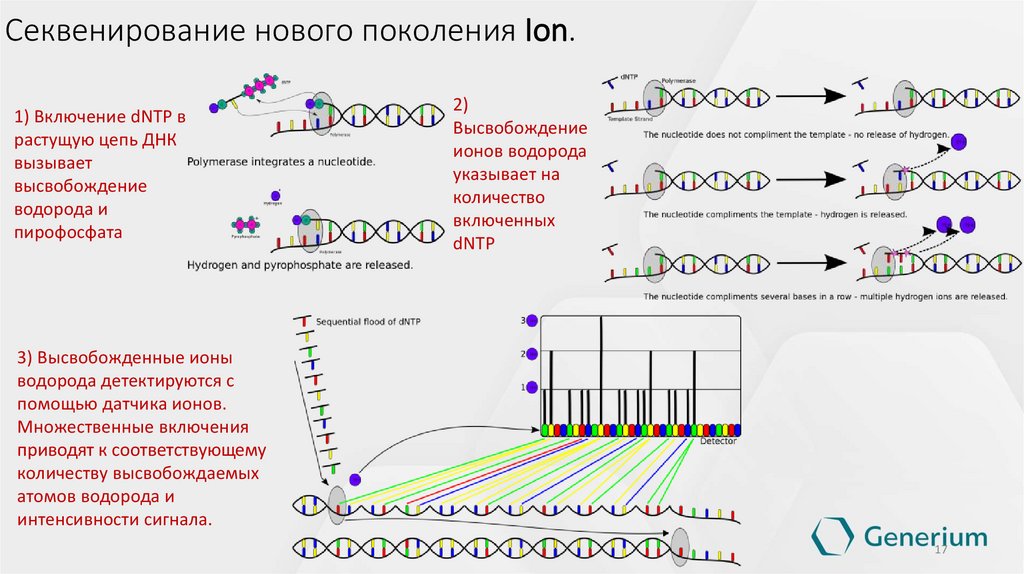
Секвенирование нового поколения Ion.1) Включение dNTP в
растущую цепь ДНК
вызывает
высвобождение
водорода и
пирофосфата
2)
Высвобождение
ионов водорода
указывает на
количество
включенных
dNTP
3) Высвобожденные ионы
водорода детектируются с
помощью датчика ионов.
Множественные включения
приводят к соответствующему
количеству высвобождаемых
атомов водорода и
интенсивности сигнала.
17
16.
Секвенирование нового поколения – нанопоровые секвенаторы.18
17.
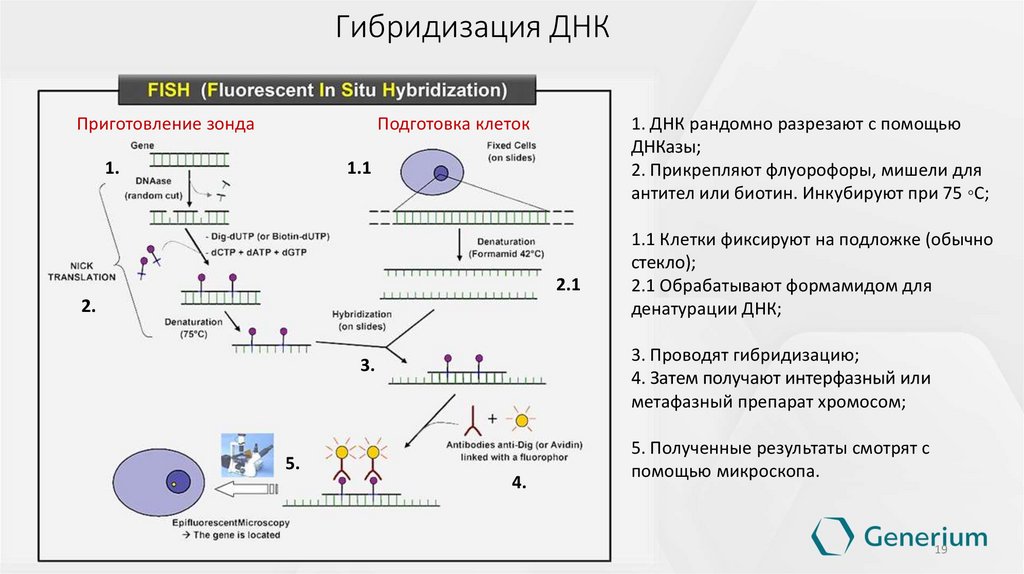
Гибридизация ДНКПриготовление зонда
Подготовка клеток
1.
1. ДНК рандомно разрезают с помощью
ДНКазы;
2. Прикрепляют флуорофоры, мишели для
антител или биотин. Инкубируют при 75 ◦С;
1.1
2.1
2.
3. Проводят гибридизацию;
4. Затем получают интерфазный или
метафазный препарат хромосом;
3.
5.
1.1 Клетки фиксируют на подложке (обычно
стекло);
2.1 Обрабатывают формамидом для
денатурации ДНК;
4.
5. Полученные результаты смотрят с
помощью микроскопа.
19
18.
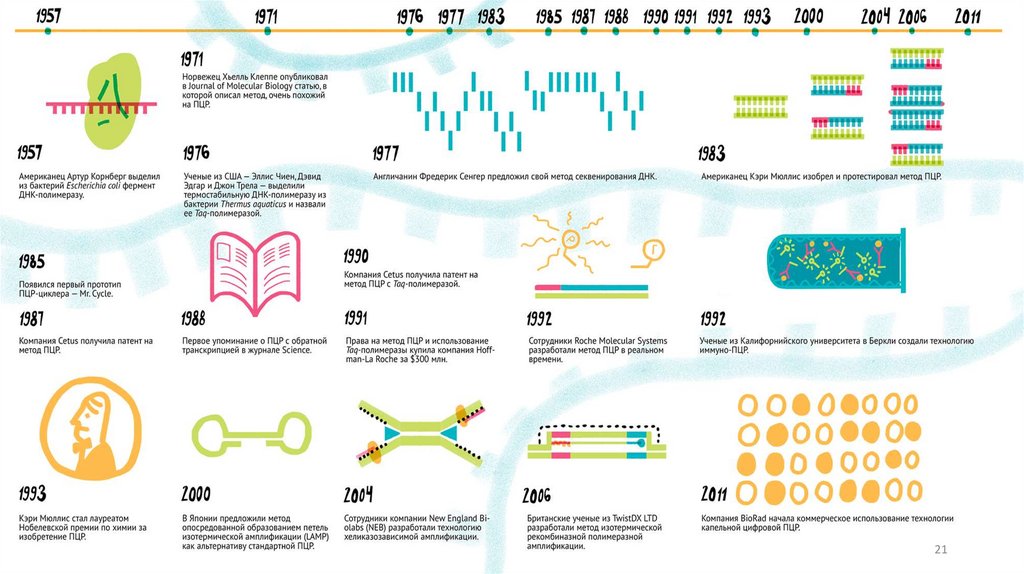
PCR – PolymeraseChain Reaction
В 1983 г. у руководителя
лаборатории синтеза ДНК в Cetus
Corporation (США) Кэри Мюллис, по
дороге из Сан-Франциско в
Мендосино, произошло озарение и
он создал полимеразную цепную
реакцию.
ПЦР полностью и безвозвратно
изменило медицину, науку и нашу
жизнь в целом.
20
19.
2120.
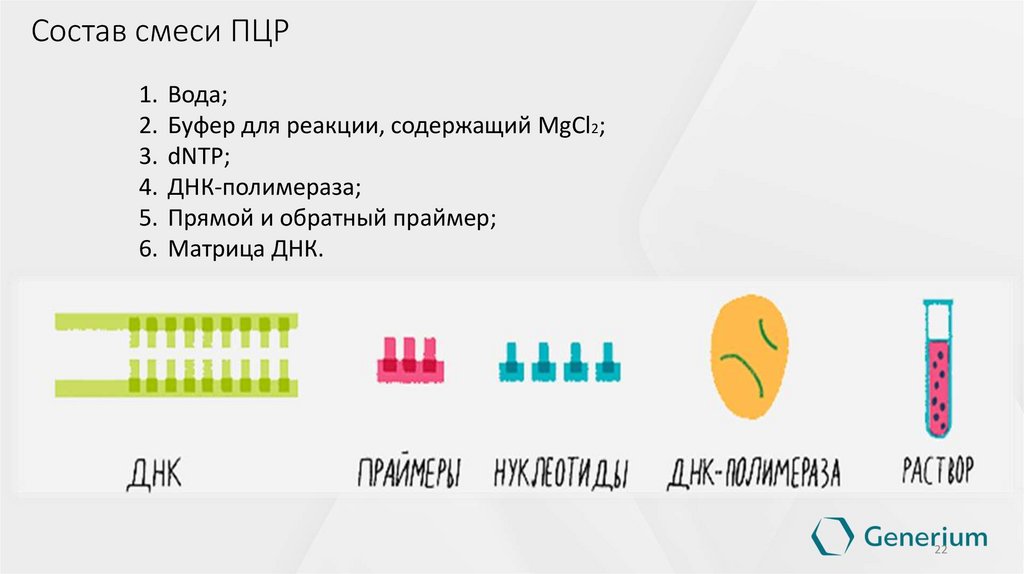
Состав смеси ПЦР1. Вода;
2. Буфер для реакции, содержащий MgCl2;
3. dNTP;
4. ДНК-полимераза;
5. Прямой и обратный праймер;
6. Матрица ДНК.
22
21.
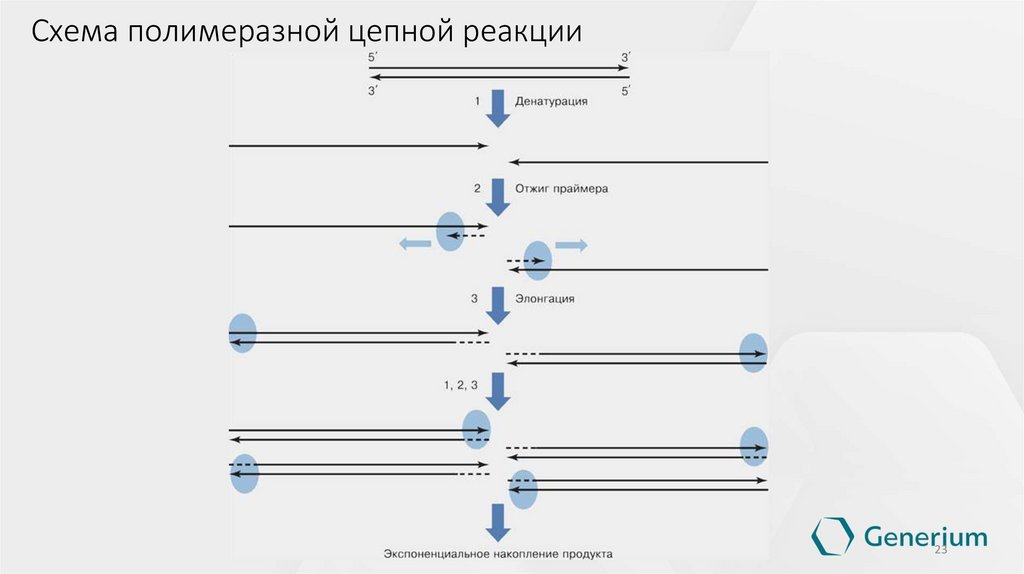
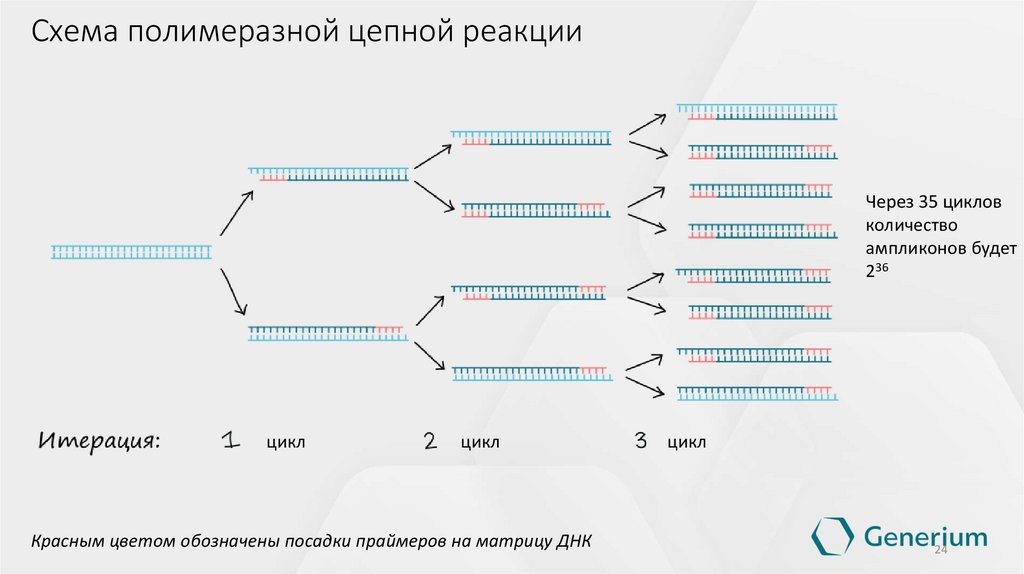
Схема полимеразной цепной реакции23
22.
Схема полимеразной цепной реакцииЧерез 35 циклов
количество
ампликонов будет
236
цикл
цикл
Красным цветом обозначены посадки праймеров на матрицу ДНК
цикл
24
23.
ОТ-ПЦРПолимеразная цепная реакция может идти исключительно на матрице ДНК, поэтому
если у экспериментатора есть мРНК, то сначала ее надо как-то «переписать» в ДНК. Для
этого применяют реакцию обратной транскрипции, в которой фермент обратная
транскриптаза по матрице РНК строит комплементарную ДНК, а потом с этой ДНК
проводят обычную ПЦР, как описано выше.
Реакция обратной транскрипции происходит при одной температуре в течение 20-30
минут.
25
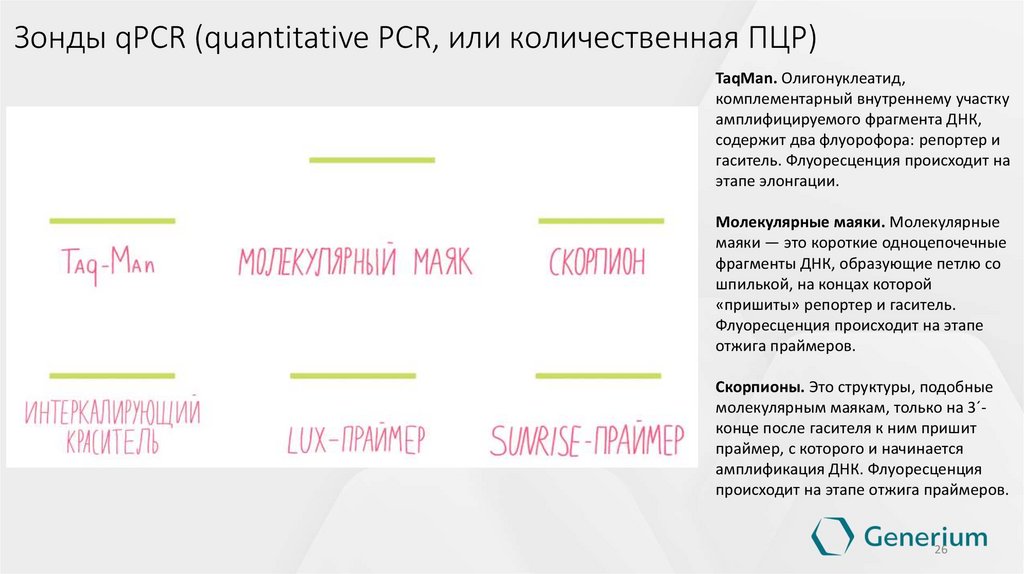
24.
Зонды qPCR (quantitative PCR, или количественная ПЦР)TaqMan. Олигонуклеатид,
комплементарный внутреннему участку
амплифицируемого фрагмента ДНК,
содержит два флуорофора: репортер и
гаситель. Флуоресценция происходит на
этапе элонгации.
Молекулярные маяки. Молекулярные
маяки — это короткие одноцепочечные
фрагменты ДНК, образующие петлю со
шпилькой, на концах которой
«пришиты» репортер и гаситель.
Флуоресценция происходит на этапе
отжига праймеров.
Скорпионы. Это структуры, подобные
молекулярным маякам, только на 3ˊконце после гасителя к ним пришит
праймер, с которого и начинается
амплификация ДНК. Флуоресценция
происходит на этапе отжига праймеров.
26
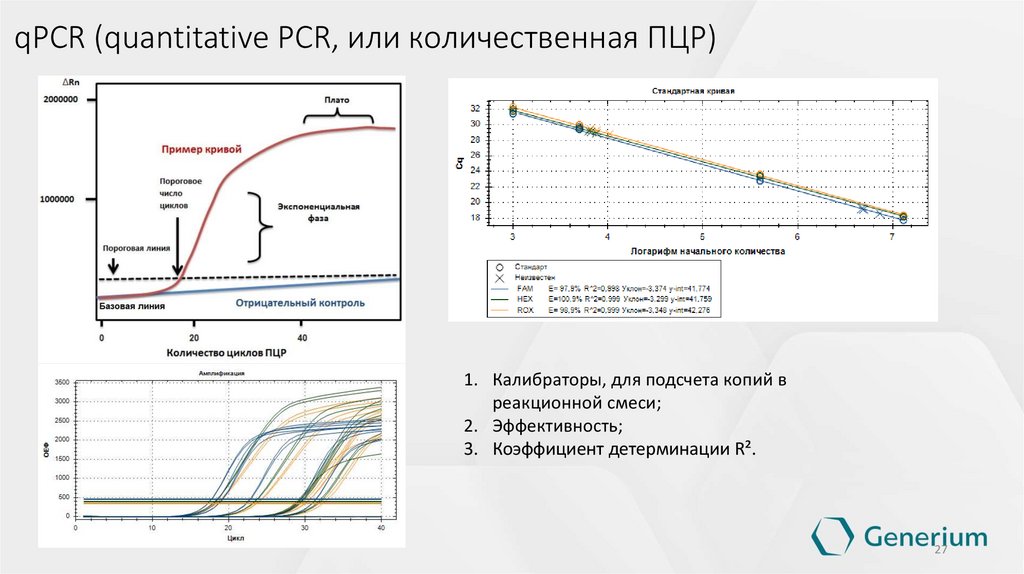
25.
qPCR (quantitative PCR, или количественная ПЦР)1. Калибраторы, для подсчета копий в
реакционной смеси;
2. Эффективность;
3. Коэффициент детерминации R².
27
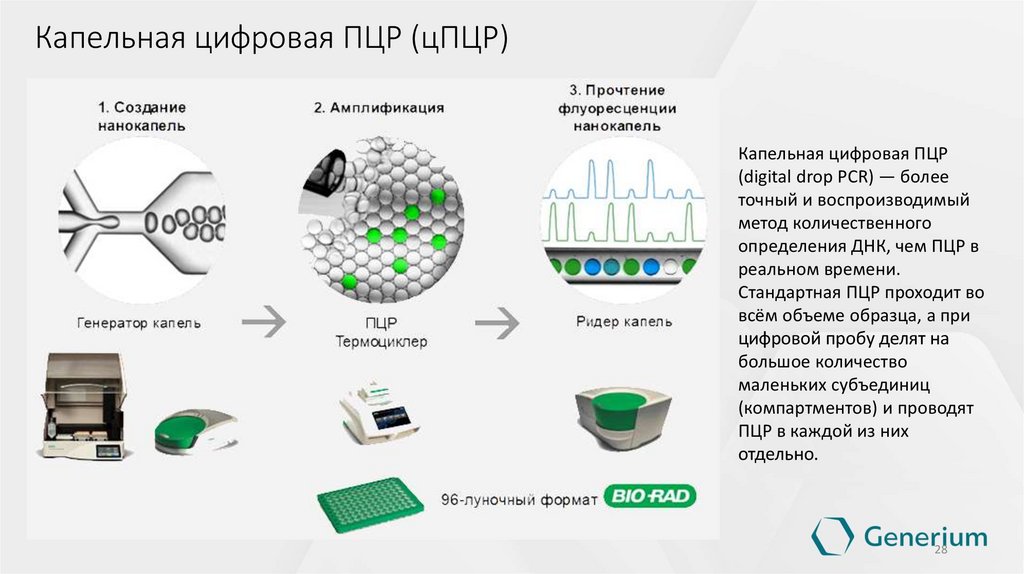
26.
Капельная цифровая ПЦР (цПЦР)Капельная цифровая ПЦР
(digital drop PCR) — более
точный и воспроизводимый
метод количественного
определения ДНК, чем ПЦР в
реальном времени.
Стандартная ПЦР проходит во
всём объеме образца, а при
цифровой пробу делят на
большое количество
маленьких субъединиц
(компартментов) и проводят
ПЦР в каждой из них
отдельно.
28
27.
Капельная цифровая ПЦР (цПЦР)Плазмида
обработанная
рестриктазой
Плазмида без
обработки
рестриктазой
Отрицательный
контроль
29
28.
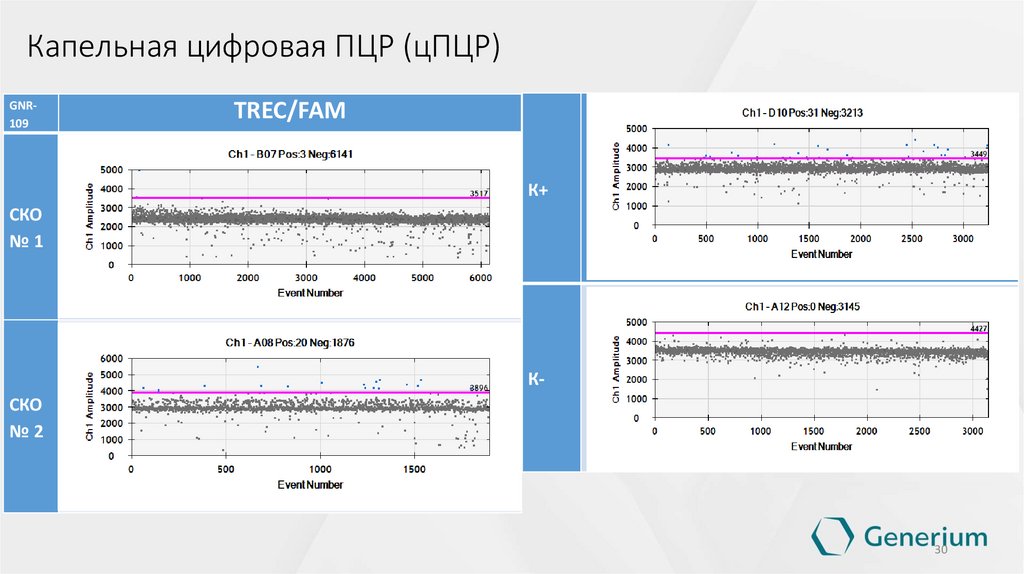
Капельная цифровая ПЦР (цПЦР)GNR109
TREC/FAM
К+
СКО
№1
КСКО
№2
30
29.
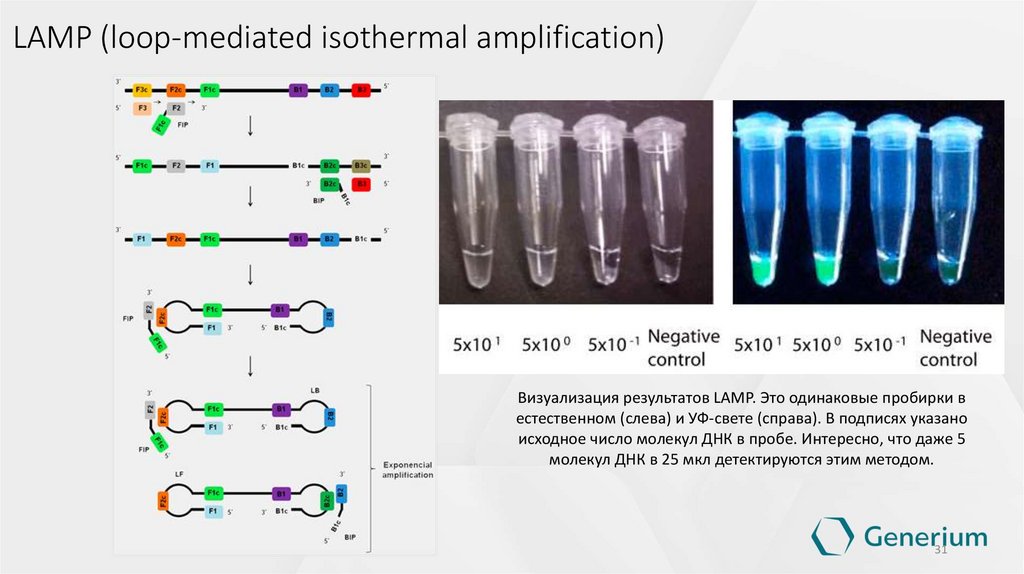
LAMP (loop-mediated isothermal amplification)Визуализация результатов LAMP. Это одинаковые пробирки в
естественном (слева) и УФ-свете (справа). В подписях указано
исходное число молекул ДНК в пробе. Интересно, что даже 5
молекул ДНК в 25 мкл детектируются этим методом.
31
30.
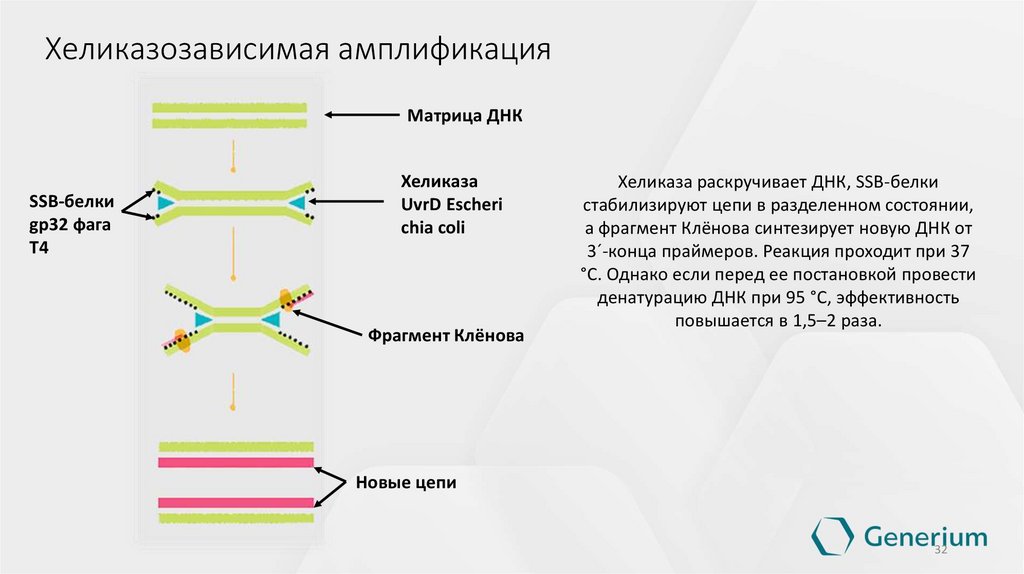
Хеликазозависимая амплификацияМатрица ДНК
SSB-белки
gp32 фага
Т4
Хеликаза
UvrD Escheri
chia coli
Фрагмент Клёнова
Хеликаза раскручивает ДНК, SSB-белки
стабилизируют цепи в разделенном состоянии,
а фрагмент Клёнова синтезирует новую ДНК от
3ˊ-конца праймеров. Реакция проходит при 37
°С. Однако если перед ее постановкой провести
денатурацию ДНК при 95 °С, эффективность
повышается в 1,5–2 раза.
Новые цепи
32
31.
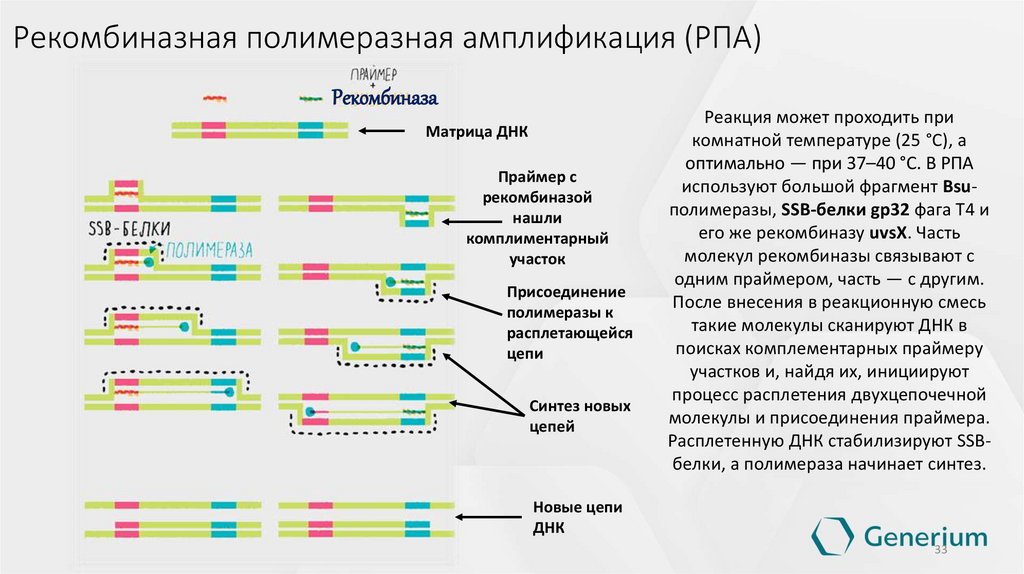
Рекомбиназная полимеразная амплификация (РПА)Рекомбиназа
Матрица ДНК
Праймер с
рекомбиназой
нашли
комплиментарный
участок
Присоединение
полимеразы к
расплетающейся
цепи
Синтез новых
цепей
Реакция может проходить при
комнатной температуре (25 °С), а
оптимально — при 37–40 °С. В РПА
используют большой фрагмент Bsuполимеразы, SSB-белки gp32 фага Т4 и
его же рекомбиназу uvsX. Часть
молекул рекомбиназы связывают с
одним праймером, часть — с другим.
После внесения в реакционную смесь
такие молекулы сканируют ДНК в
поисках комплементарных праймеру
участков и, найдя их, инициируют
процесс расплетения двухцепочечной
молекулы и присоединения праймера.
Расплетенную ДНК стабилизируют SSBбелки, а полимераза начинает синтез.
Новые цепи
ДНК
33
32.
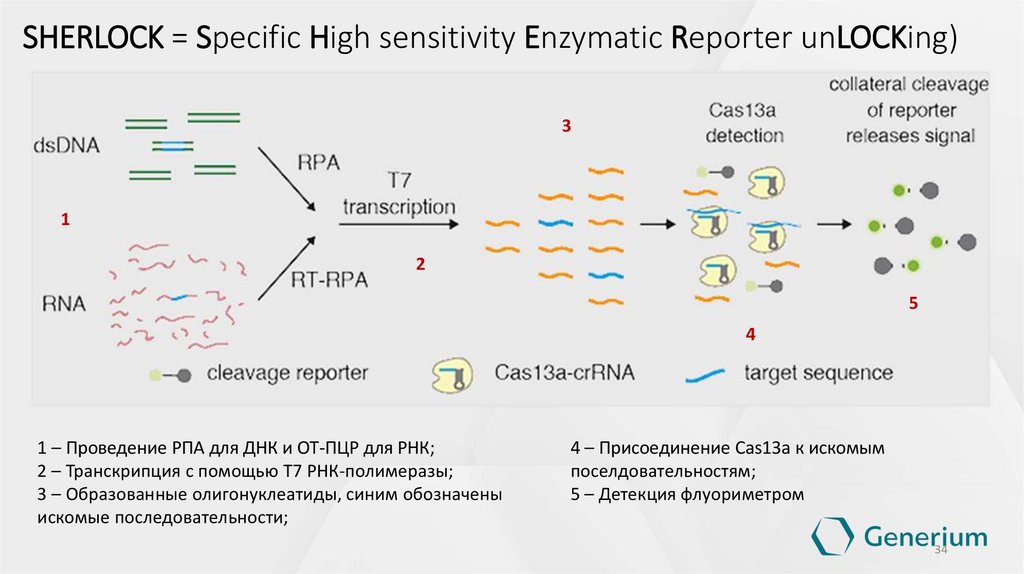
SHERLOCK = Specific High sensitivity Enzymatic Reporter unLOCKing)3
1
2
5
4
1 – Проведение РПА для ДНК и ОТ-ПЦР для РНК;
2 – Транскрипция с помощью Т7 РНК-полимеразы;
3 – Образованные олигонуклеатиды, синим обозначены
искомые последовательности;
4 – Присоединение Cas13a к искомым
поселдовательностям;
5 – Детекция флуориметром
34
33.
Валидация методик• ICH
• ГФ РФ
• FDA
• EuPH, JapPH..
35
34.
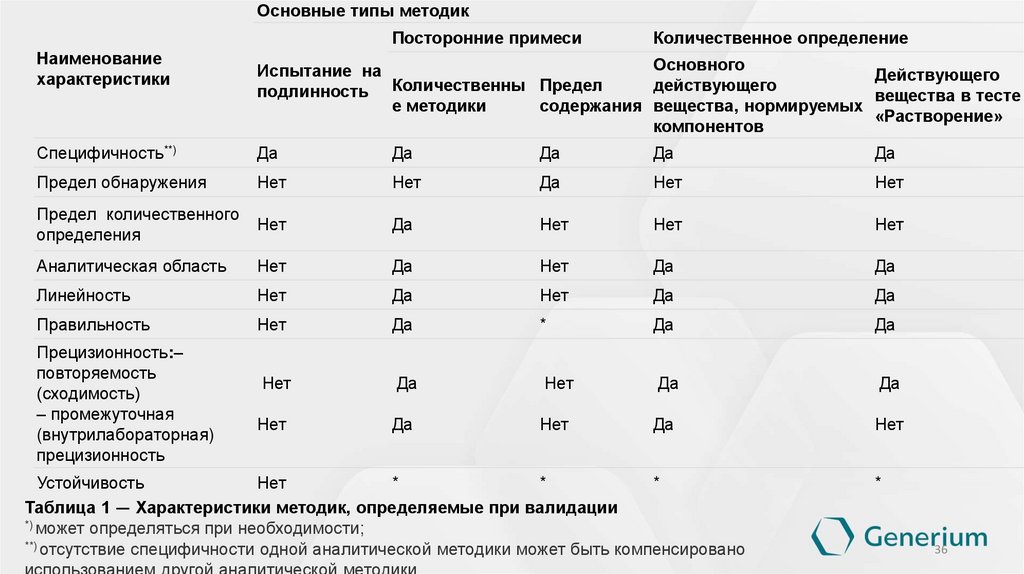
Основные типы методикПосторонние примеси
Количественное определение
Наименование
характеристики
Основного
Испытание на
Действующего
Количественны
Предел
действующего
подлинность
вещества в тесте
е методики
содержания вещества, нормируемых
«Растворение»
компонентов
Специфичность**)
Да
Да
Да
Да
Да
Предел обнаружения
Нет
Нет
Да
Нет
Нет
Предел количественного
определения
Нет
Да
Нет
Нет
Нет
Аналитическая область
Нет
Да
Нет
Да
Да
Линейность
Нет
Да
Нет
Да
Да
Правильность
Нет
Да
*
Да
Да
Нет
Да
Нет
Да
Да
Нет
Да
Нет
Да
Нет
Прецизионность:–
повторяемость
(сходимость)
– промежуточная
(внутрилабораторная)
прецизионность
Устойчивость
Нет
*
*
*
Таблица 1 — Характеристики методик, определяемые при валидации
*) может определяться при необходимости;
**) отсутствие специфичности одной аналитической методики может быть компенсировано
использованием другой аналитической методики.
*
36
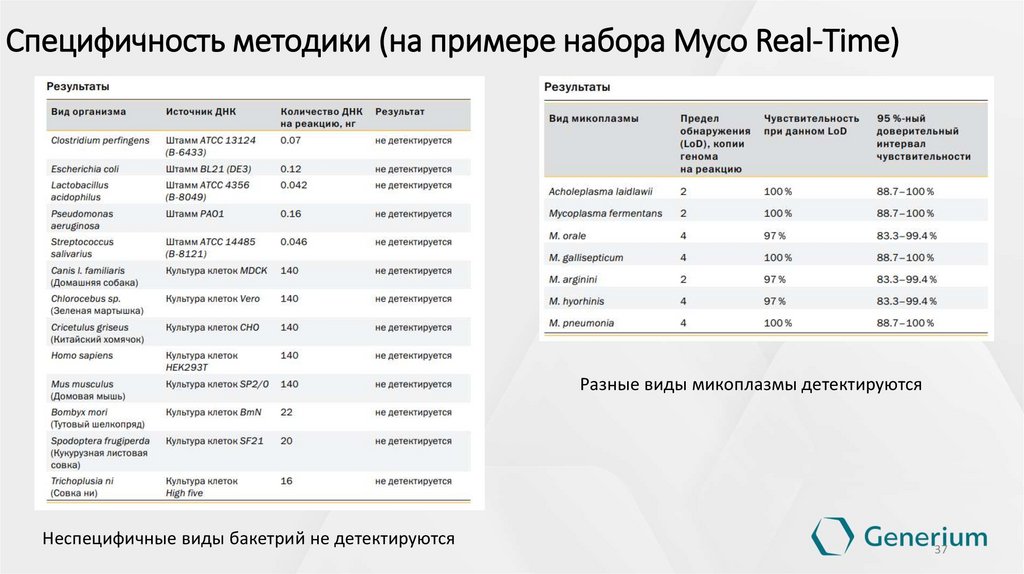
35. Валидация методик
Специфичность методики (на примере набора Myco Real-Time)Разные виды микоплазмы детектируются
Неспецифичные виды бакетрий не детектируются
37
36.
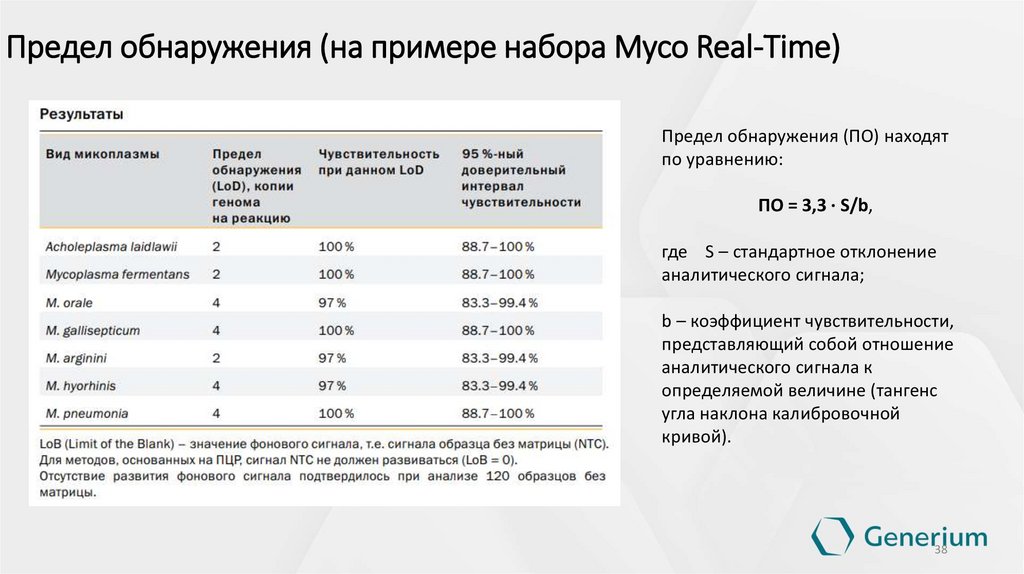
Предел обнаружения (на примере набора Myco Real-Time)Предел обнаружения (ПО) находят
по уравнению:
ПО = 3,3 · S/b,
где S – стандартное отклонение
аналитического сигнала;
b – коэффициент чувствительности,
представляющий собой отношение
аналитического сигнала к
определяемой величине (тангенс
угла наклона калибровочной
кривой).
38
37.
Предел количественного обнаруженияПредел количественного определения – это наименьшее количество (концентрация) вещества в образце,
которое может быть количественно оценено с использованием валидируемой методики с требуемой
правильностью и внутрилабораторной (промежуточной) прецизионностью.
Предел количественного определения является необходимой валидационной характеристикой методик,
используемых для оценки малых количеств (концентраций) веществ в образце и, в частности, для оценки
содержания примесей.
По величине стандартного отклонения сигнала и угловому коэффициенту калибровочного графика
Предел количественного определения (ПКО) рассчитывают по уравнению:
ПКО = 10 · S/b,
где
S – стандартное отклонение аналитического сигнала;
b – коэффициент чувствительности, представляющий собой отношение аналитического сигнала к
определяемой величине.
39
38.
Аналитическая областьАналитическая область методики – это интервал между верхним и нижним
значением аналитических характеристик определяемого компонента в объекте
анализа (его количества, концентрации, активности и т. п.). В этом интервале
результаты, получаемые с использованием валидируемой методики, должны
иметь приемлемый уровень правильности и внутрилабораторной
(промежуточной) прецизионности.
40
39.
ЛинейностьA
B
C
D
E
F
G
H
1
2
3
4
5
St1
St1
Образец
Образец
Образец
60 копий/мкл
60 копий/мкл
60 копий/мкл
Образец
Образец
Образец
50 копий/мкл
50 копий/мкл
50 копий/мкл
Образец
Образец
Образец
40 копий/мкл
40 копий/мкл
40 копий/мкл
Образец
Образец
Образец
30 копий/мкл
30 копий/мкл
30 копий/мкл
Образец
Образец
Образец
20 копий/мкл
20 копий/мкл
20 копий/мкл
Образец
Образец
Образец
10 копий/мкл
10 копий/мкл
10 копий/мкл
Образец
Образец
Образец
5 копий/мкл
5 копий/мкл
5 копий/мкл
Образец
Образец
Образец
1 копий/мкл
1 копий/мкл
1 копий/мкл
St2
St3
St4
St5
St6
St7
K-
St2
St3
St4
St5
St6
St7
K-
6 7 8 9
10
11 12
Линейность методики – это наличие линейной зависимости
аналитического сигнала от концентрации или количества
определяемого вещества в анализируемой пробе в
пределах аналитической области методики.
41
40.
ПравильностьПравильность методики характеризуется отклонением
среднего результата определений, выполненных с ее
использованием, от значения, принимаемого за истинное.
Валидируемая методика признается правильной, если
значения, принимаемые за истинные, лежат внутри
доверительных интервалов соответствующих средних
результатов анализов, полученных экспериментально по
данной методике.
42
41.
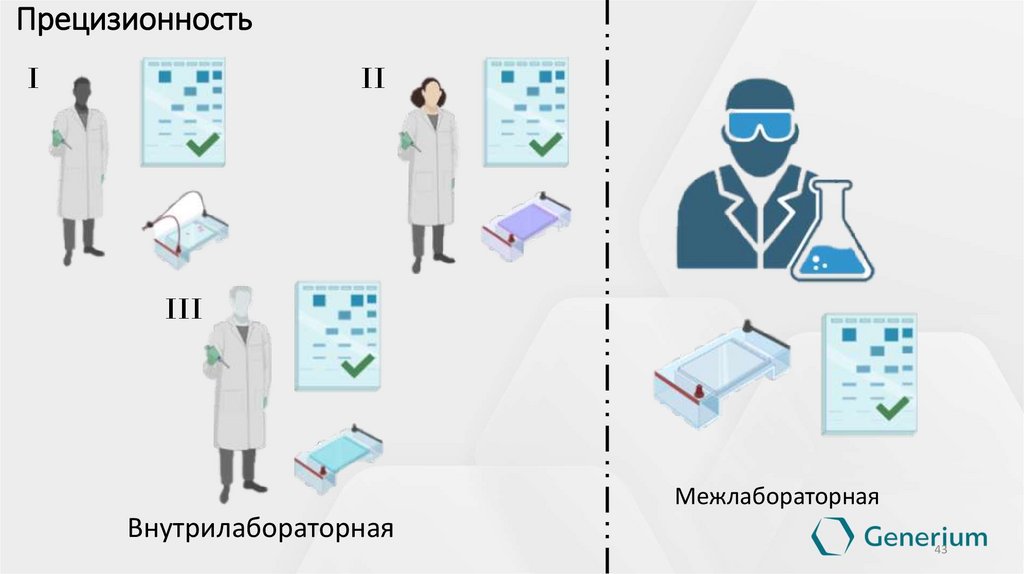
ПрецизионностьI
II
III
Межлабораторная
Внутрилабораторная
43
42.
Устойчивость (робастность)Робастность набора Myco Real-Time в
присутствии интерферентов
Робастность набора Myco Real-Time в
зависимости от используемого
амплификатора
44
43.
Представление результатов валидацииПротокол валидации аналитической методики должен
содержать:
ее полное описание;
оцениваемые характеристики;
все первичные результаты;
результаты статистической обработки данных;
иллюстративные материалы;
заключение о пригодности валидируемой методики.
45
44.
Спасибо завнимание!
www.generium.ru
46


















 Биология
Биология








