Похожие презентации:
Методы осаждения
1.
Федеральное государственное бюджетное образовательноеучреждение высшего образования «Красноярский
государственный медицинский университет имени профессора В.Ф.
Войно-Ясенецкого» Министерства здравоохранения Российской
Федерации
МЕТОДЫ ОСАЖДЕНИЯ
к.п.н. Агафонова И.П.
2.
Осадительное титрование группа титриметрических методованализа, основанных на реакциях
образования
малорастворимых
соединений,
выделяющихся
из
раствора в виде осадка.
3.
Раздел титриметрии, основанный на реакцииосаждения, называется СЕДИМЕТРИЯ.
Хотя подобных реакций известно очень много,
в седиметрии могут использоваться только те,
в которых:
1) образуется практически нерастворимый
осадок;
2) выпадение осадка происходит быстро и не
сопровождается соосаждением посторонних
ионов;
3) точка эквивалентности легко фиксируется.
4.
Точка эквивалентностинаступает тогда, когда исследуемое
вещество полностью переходит в осадок.
Конец реакции определяется с помощью
индикаторов, но в этом методе
индикаторы существенно отличаются от
индикаторов кислотно-основного метода.
5.
Осадительные методы:АРГЕНТОМЕТРИЯ
-метод Мора;
-метод Фаянса;
-метод Фольгарда
МЕРКУРОМЕТРИЯ
6.
Аргентометрическим титрованиемназывается титриметрический метод
анализа, основанный на образовании
малорастворимых соединений серебра.
Основное уравнение
Аg+ + Х- → АgХ↓,
где Х- = Cl‐ , Br‐ , I‐ , CN‐ , SCN‐ и др .
7.
ТИТРАНТЫаргентометрического титрования
0,05 моль/л или 0,1 моль/л
АgNО3
Вторичный стандартный раствор (раствор с
установочным титром)
Для стандартизации
раствора АgNО3
NaCl 0,1 моль/л
Первичные стандартные растворы
аргентометрического титрования
8.
МЕТОД МОРА9.
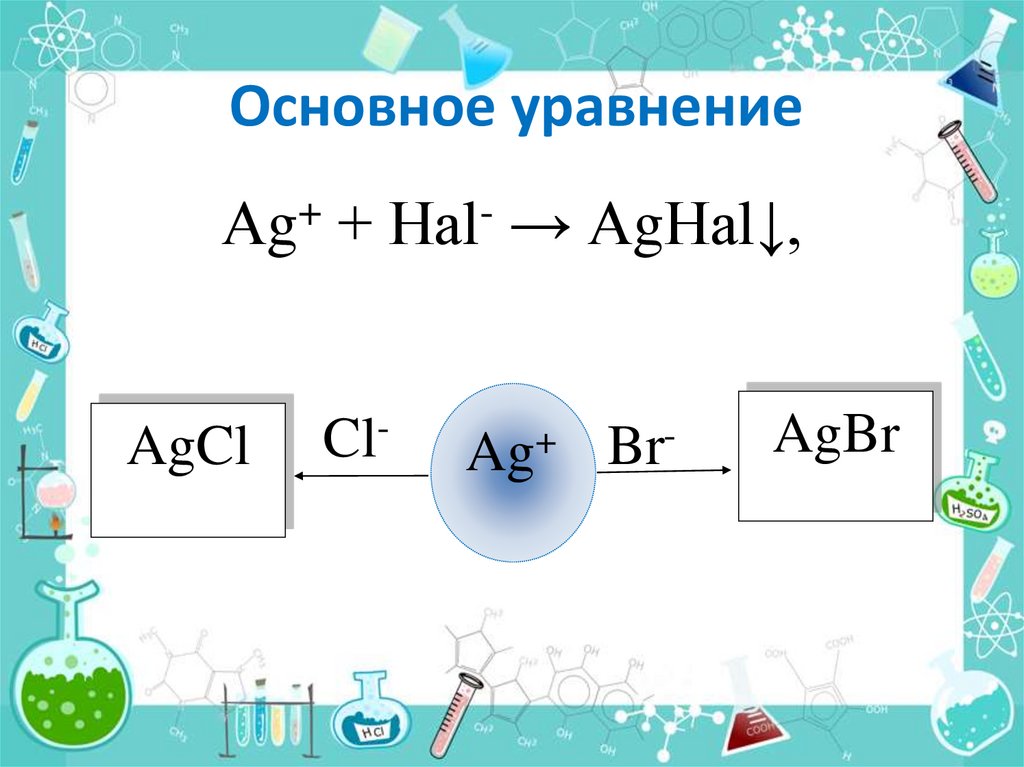
Основное уравнение+
Аg + Наl → АgНаl↓,
AgCl
Cl-
Ag+
Br-
AgBr
10.
Осадительные индикаторы вещества, выделяющиеся из раствора ввиде осадка в хорошо заметной форме
в точке эквивалентности или вблизи неё.
Индикатор
хромат калия К2СгО4 5 %
11.
Аg+ + Cl- → АgCl↓CrO42-
AgCrO4
Цвет суспензии AgCl
становится кирпично-красным
Для лучшего определения конца титрования можно
использовать раствор «свидетель».
12.
Условия1. Определение можно проводить только в
НЕЙТРАЛЬНЫХ , СЛАБОЩЕЛОЧНЫХ
РАСТВОРАХ
13.
Условия2. Иодиды этим методом не определяют,
так как выпадающий в осадок иодид
серебра АgI сильно адсорбирует К2СгО4,
поэтому
точку
эквивалентности
определить невозможно.
14.
Условия3.
Определение нельзя проводить в
присутствии ионов Ва2+, Вi3+, Рb2+, так
как эти ионы образуют с ионами СгО42осадки.
15.
МЕТОД ФАЯНСА16.
Основное уравнение+
Аg + Наl → АgНаl↓,
где Наl-
Хродиды, Бромиды,
ЙОДИДЫ
17.
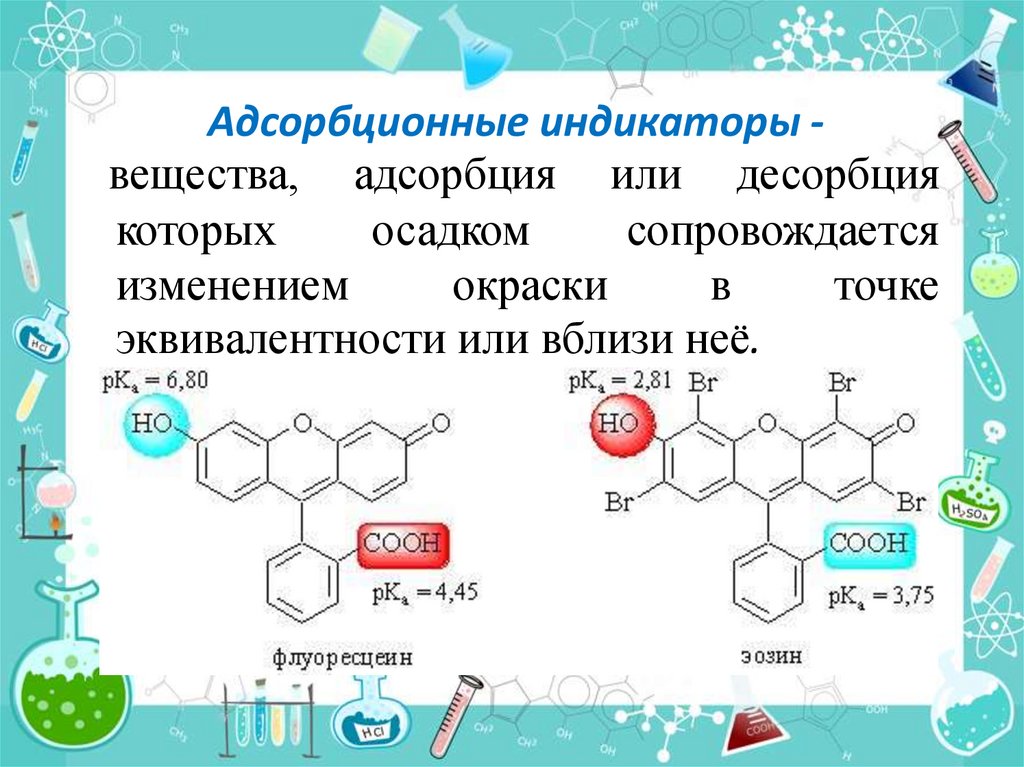
Адсорбционные индикаторы вещества, адсорбция или десорбциякоторых
осадком
сопровождается
изменением
окраски
в
точке
эквивалентности или вблизи неё.
18.
Адсорбционные индикаторыАдсорбционные
индикаторы
представляют собой слабые органические
кислоты,
в
водной
среде
диссоциирующие на ионы:
HInd↔H++IndБольшинство индикаторов имеют
окрашенные анионы.
19.
Аg+ + I- → АgI↓Флуоресцеин, находящийся в растворе, имеет жёлтую
окраску, а адсорбированный на осадке – розовую;
эозин, соответственно, оранжевую и краснофиолетовую.
20.
Условия1. Титрование в нейтральной или
слабокислой среде (уксуснокислой)
при рН ≤ 2.
21.
УСЛОВИЯ2. Для того чтобы поверхность осадка
была, возможно, большей (адсорбция
происходит на поверхности осадка),
титрование производят при сильном
взбалтывании, особенно вблизи
точки эквивалентности. Для
предотвращения коагуляции осадка
можно добавить раствор крахмала.
22.
УСЛОВИЯ3. Титрование нельзя проводить на
прямом солнечном свету, так как
адсорбированные индикаторы
сильно повышают чувствительность
солей к свету.
23.
МЕТОД ФОЛЬГАРДА(РОДАНОМЕТРИЯ)
24.
ТИТРАНТЫ0,1 моль/л раствор AgNO3;
0,1 моль/л раствор тиоцианата
аммония (NH4SCN).
ИНДИКАТОР
раствор железоаммонийных квасцов
(NH4)Fe(SO4)2 ∙12H2O
25.
Метод Фольгарда основан на реакцииобразования роданида серебра:
Ag++ Br- → AgBr↓
Ag++ SCN- → AgSCN↓
В ТЭ
Fe3+ + 3SCN- → Fe(SCN)3
Образующийся роданид железа (III) Fe(SCN)3
окрасит раствор в КРАСНЫЙ цвет.
26.
УСЛОВИЯ1)
определения проводят в
кислой среде (НNОз) (кислота
подавляет гидролиз соли железа
и ослабляет желтую окраску
раствора
железоаммонийных
квасцов.
27.
УСЛОВИЯ(определение иодидов)Иодид-ионы могут окисляться ионами
Fe3+. Поэтому при определении Iметодом Фольгарда к анализируемому
раствору вначале добавляют избыток
стандартного раствора AgNO3 и лишь
затем
железоаммонийные
квасцы.
Образовавшийся AgI не окисляется
ионами Fe3+
28.
УСЛОВИЯ (определение хлоридов)-осадок
AgCl отделяют от раствора
фильтрованием;
- уменьшают площадь поверхности осадка
AgCl – при нагревании или сильном
встряхивании
осадок
подвергается
коагуляции;
отделяют
осадок
AgCl
от
раствора слоем более тяжёлого, чем
вода
органического
растворителя,
например, нитробензола.
29.
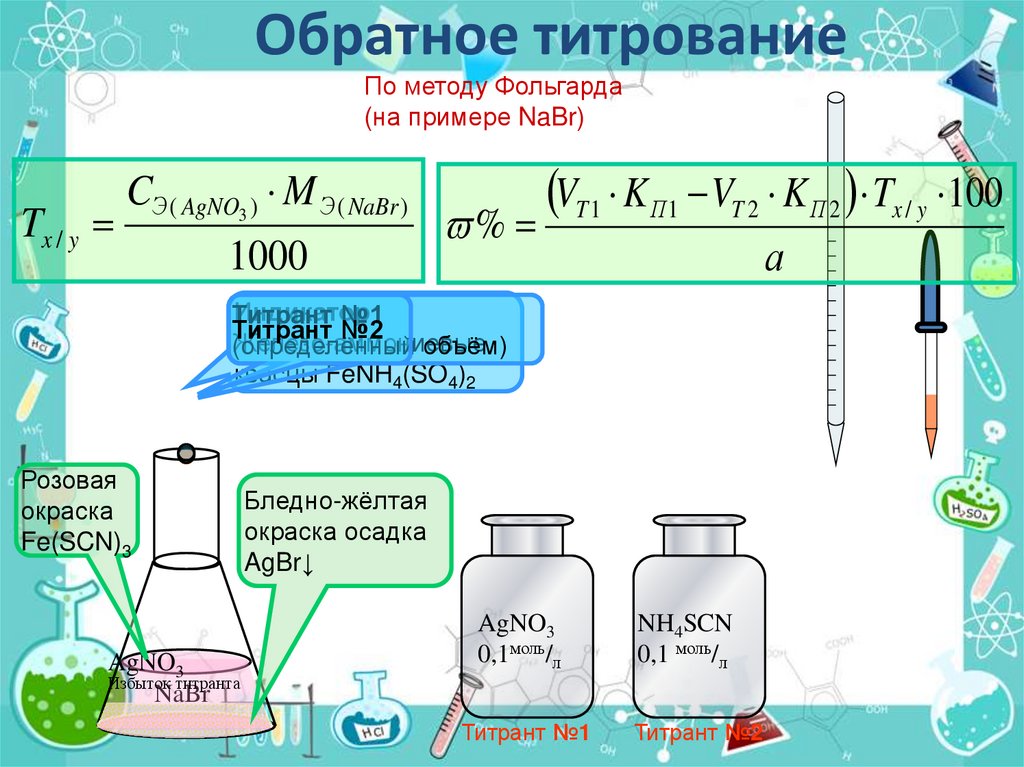
Обратное титрованиеПо методу Фольгарда
(на примере NaBr)
Tx / y
CЭ ( AgNO3 ) M Э ( NaBr )
1000
%
VT 1 K П1 VT 2 K П 2 Tx / y 100
а
Индикатор
Титрант
№1
Титрант
№2
Железо-аммониевые
(определённый
объём)
квасцы FeNH4(SO4)2
Розовая
окраска
Fe(SCN)3
AgNO3
Избыток титранта
NaBr
Бледно-жёлтая
окраска осадка
AgBr↓
AgNO3
0,1моль/л
NH4SCN
0,1 моль/л
Титрант №1
Титрант №2
30.
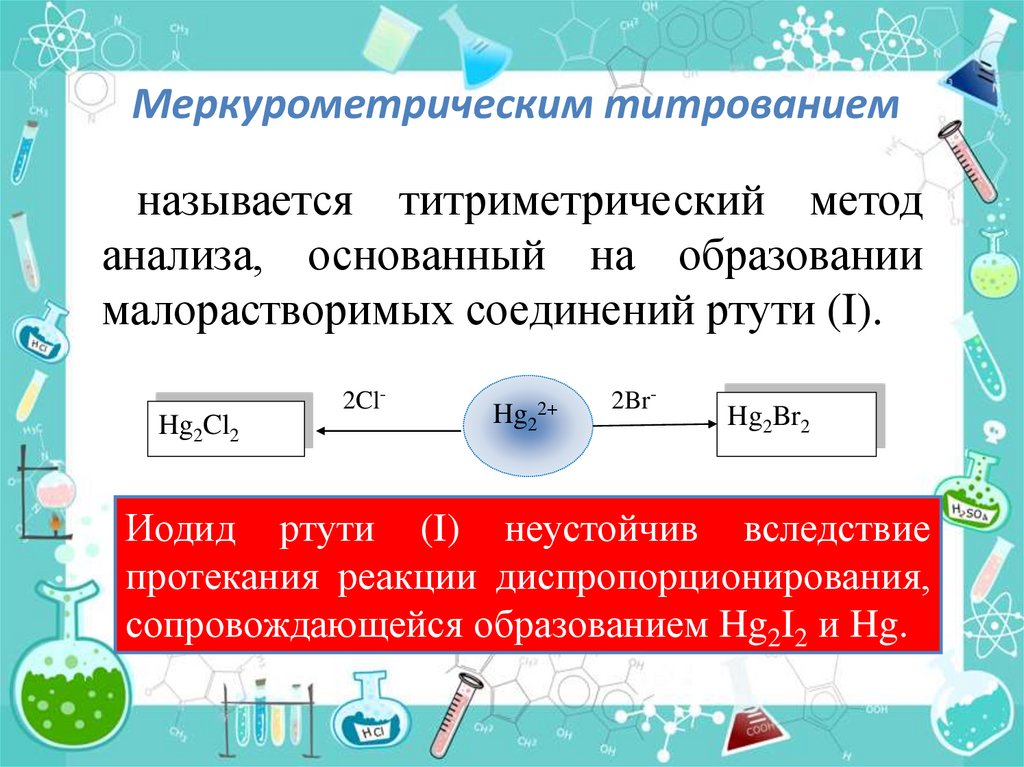
Меркурометрическим титрованиемназывается титриметрический метод
анализа, основанный на образовании
малорастворимых соединений ртути (I).
2Cl-
Hg2Cl2
Hg22+
2Br-
Hg2Br2
Иодид ртути (I) неустойчив вследствие
протекания реакции диспропорционирования,
сопровождающейся образованием Hg2I2 и Hg.
31.
ТИТРАНТЫмеркурометрического титрования
0,1 моль/л
Hg2(NO3)2
Вторичный стандартный раствор (раствор с
установочным титром)
Для стандартизации
раствора Hg2(NO3)2
NaCl 0,1 моль/л
Первичные стандартные растворы
меркурометрического титрования
32.
Индикаторы меркурометриидифенилкарбазон
Среда - HNO3
Адсорбционный индикатор
Вносят к концу титрования
Hg2Hal2
Суспензия
голубая
фиолетовая





























 Химия
Химия








