Похожие презентации:
Методы объемного анализа
1.
Кафедра химииТема лекции:
Методы объемного анализа
2.
Титриметрия (титрование) –процесс последовательного прибавления
небольших порций раствора с известной
концентрацией к измеренному объему
раствора с неизвестной концентрацией.
Цель:
определение концентрации
исследуемого раствора
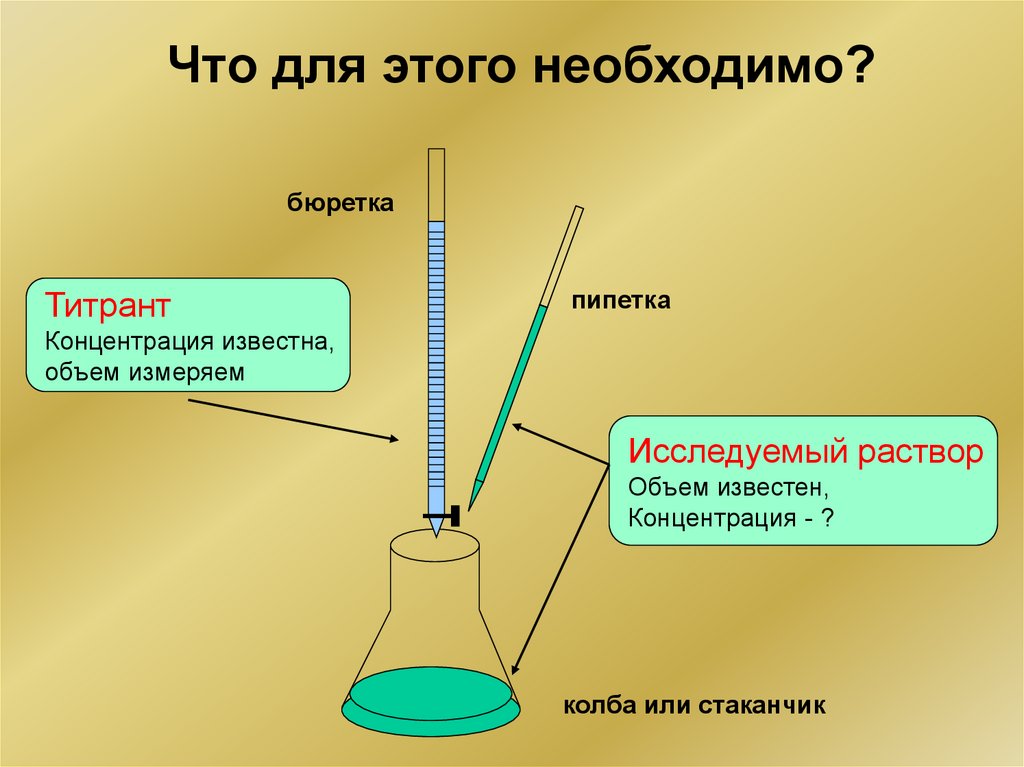
3.
Что для этого необходимо?бюретка
Титрант
пипетка
Концентрация известна,
объем измеряем
Исследуемый раствор
Объем известен,
Концентрация - ?
колба или стаканчик
4.
• Точка эквивалентности – момент,когда вещества прореагируют
в эквивалентных количествах.
• Объем титранта, затраченный для
достижения точки эквив. называют
эквивалентным объемом и используют
в расчетах.
• Индикатор – вещество, меняющее свою
окраску вблизи точки эквивалентности.
5.
Пример:Реакция нейтрализации
Сильная кислота + сильное основание
HCl + NaOH NaCl + HOH
H + OH HOH
+
-
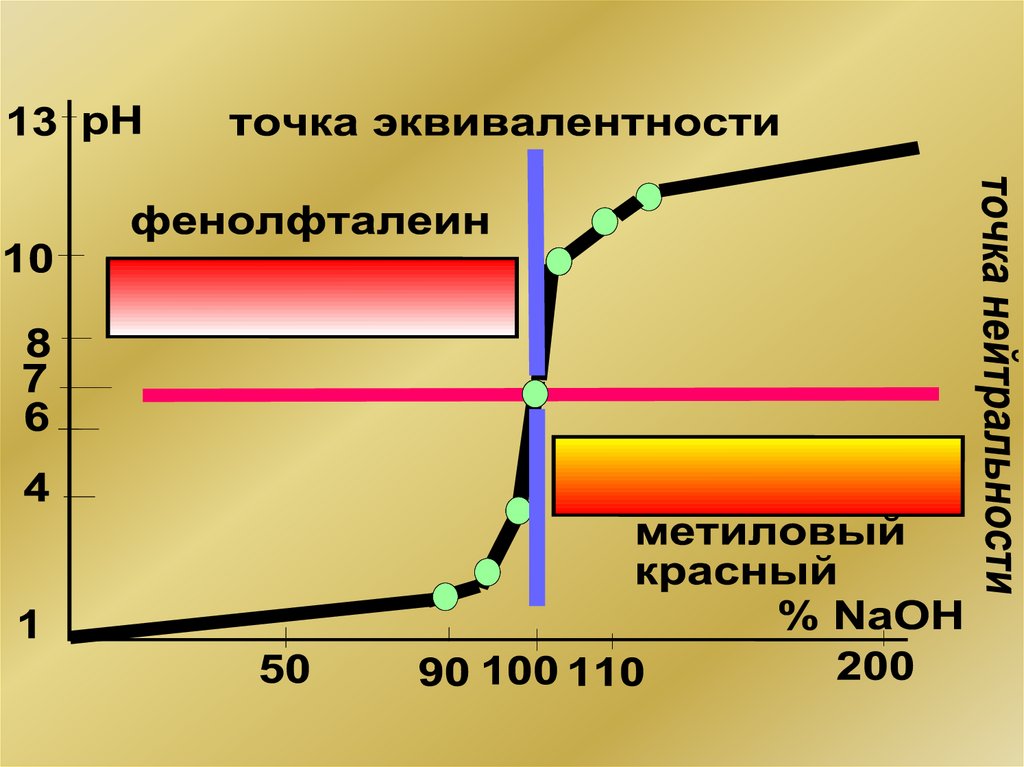
Кривая титрования – график зависимости рН
от объема добавленного титранта
Скачок титрования – резкое изменение рН
вблизи точки эквивалентности
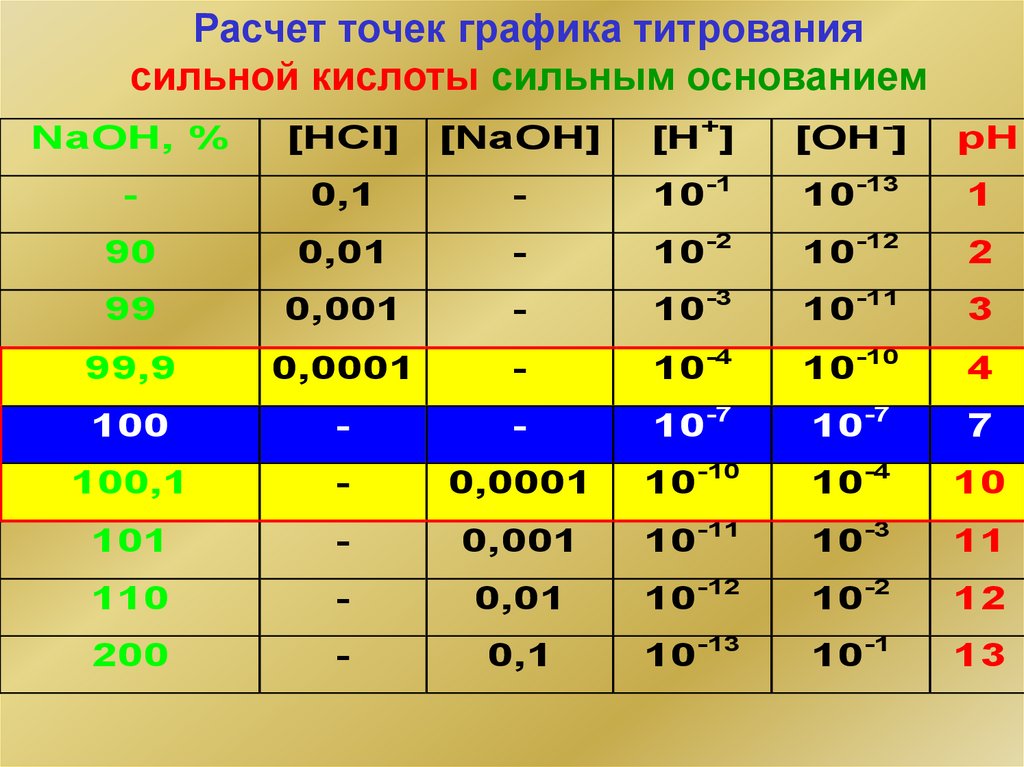
6.
Расчет точек графика титрованиясильной кислоты сильным основанием
NaOH, %
[HCl]
[NaOH]
[H+]
[OH-]
pH
-
0,1
-
10-1
10-13
1
90
0,01
-
10-2
10-12
2
99
0,001
-
10-3
10-11
3
99,9
0,0001
-
10-4
10-10
4
100
-
-
10-7
10-7
7
100,1
-
0,0001
10-10
10-4
10
101
-
0,001
10-11
10-3
11
110
-
0,01
10-12
10-2
12
200
-
0,1
10-13
10-1
13
7.
8. Общие закономерности
• Эквивалентная и нейтральная точки невсегда совпадают.
• Эквивалентная точка и зона скачка
титрования
могут
лежать
как
в
щелочной, так и в кислотной области.
• Для обнаружения эквивалентной точки
пригоден лишь тот индикатор, чей
диапазон изменения окраски находится
в зоне скачка титрования.
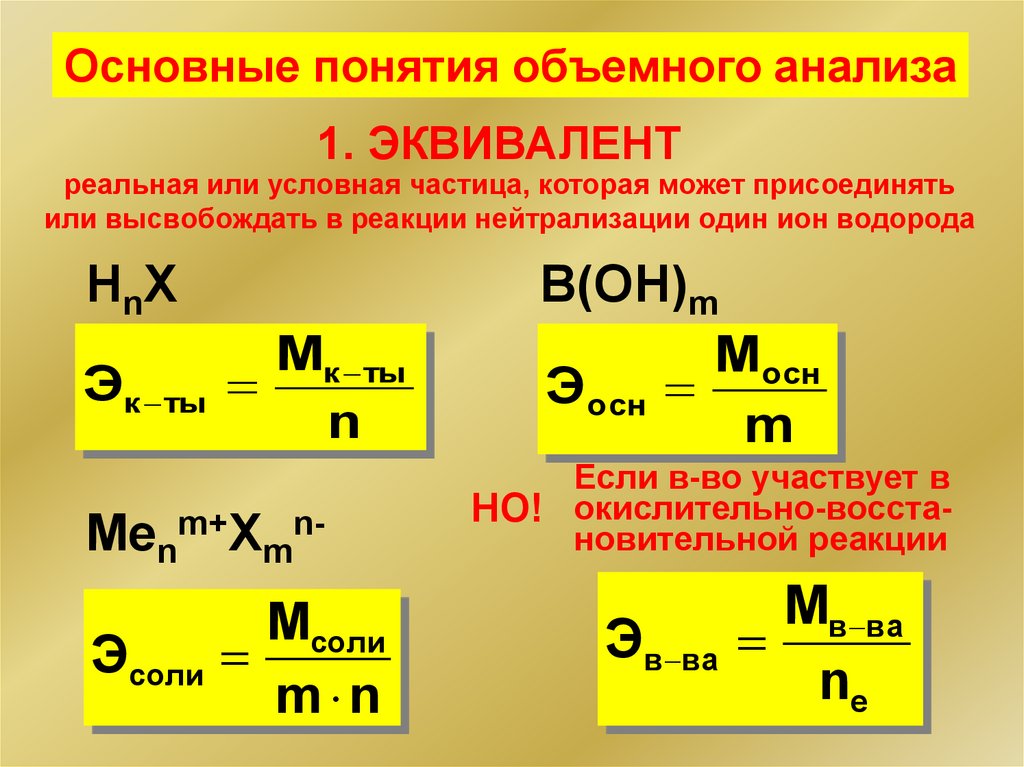
9.
Основные понятия объемного анализа1. ЭКВИВАЛЕНТ
реальная или условная частица, которая может присоединять
или высвобождать в реакции нейтрализации один ион водорода
HnX
Мк ты
Эк ты
n
Menm+Xmn-
Мсоли
Эсоли
m n
B(OH)m
Мосн
Эосн
m
Если в-во участвует в
НО! окислительно-восстановительной реакции
Мв ва
Эв ва
ne
10.
Основные понятия объемного анализаФактор эквивалентности – feq
Показывает, какая доля реальной частицы вещества
эквивалентна одному иону водорода (одному электрону)
в данной конкретной реакции.
1
feq
z
Пример:
Обратен эквивалентному числу z вещества.
H nX
Z=n
B(OH)m Z = m
z 1 feq 1
H2SO4 + 2NaOH Na2SO4 + 2H2O
feq(H2SO4) = ½
Но:
H2SO4 + NaOH NaHSO4 + H2O
feq(H2SO4) = 1
11.
Основные понятия объемного анализа2. ЭКВИВАЛЕНТНАЯ МАССА
Молярная масса эквивалента (M1/z) –
масса одного моля эквивалента вещества (г),
M1 / z M feq г/моль
Пример:
H2SO4 + 2NaOH Na2SO4 + 2H2O
feq(H2SO4) = ½
M1/z (H2SO4) = M feq = 98 ½ = 49 г/моль
Но:
H2SO4 + NaOH NaHSO4 + H2O
feq(H2SO4) = 1
M1/z (H2SO4) = M feq = 98 1 = 98 г/моль
12.
Основные понятия объемного анализа3. НОРМАЛЬНАЯ КОНЦЕНТРАЦИЯ
(нормальность, молярная концентрация эквивалента)
Обозначения: Сн , N, С1/z
Показывает количество
моль эквивалентов вещества
в одном литре раствора
mв в а
N
M1/z Vр ра
Поскольку M1/z М , то N
См
N = См , если M1/z = М
13.
Основные понятия объемного анализа4. ТИТР
Тр-ра = Nр-ра.M1/z
Размерность:
г/л, мг/мл.
Показывает, сколько миллиграммов вещества
содержится в одном миллилитре раствора
ТИТР по определяемому веществу
ТА/В = Nр-ра(А) . M1/z(В)
Размерность:
г/л, мг/мл.
Показывает, сколько миллиграммов вещества В
реагирует с одним миллилитром раствора А
14.
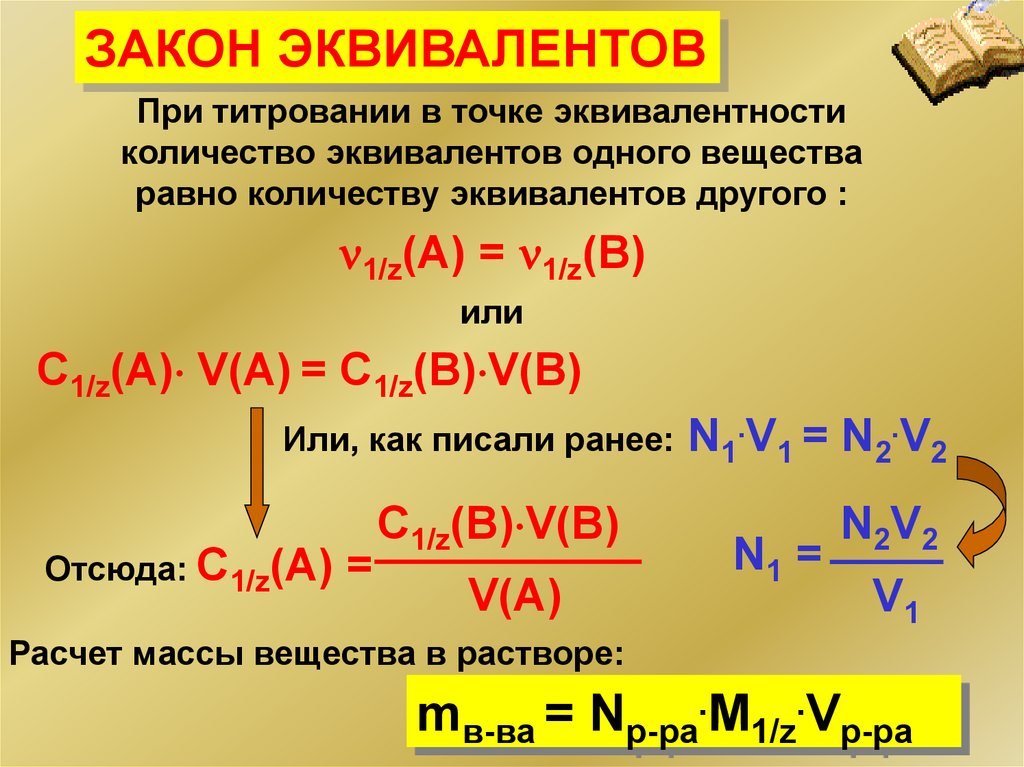
ЗАКОН ЭКВИВАЛЕНТОВПри титровании в точке эквивалентности
количество эквивалентов одного вещества
равно количеству эквивалентов другого :
1/z(A) = 1/z(B)
или
С1/z(A) V(A) = C1/z(B) V(B)
Или, как писали ранее: N1.V1 = N2.V2
Отсюда: С1/z(A) =
C1/z(B) V(B)
V(A)
N1 =
N2V2
V1
Расчет массы вещества в растворе:
mв-ва = Nр-ра.M1/z.Vр-ра
15.
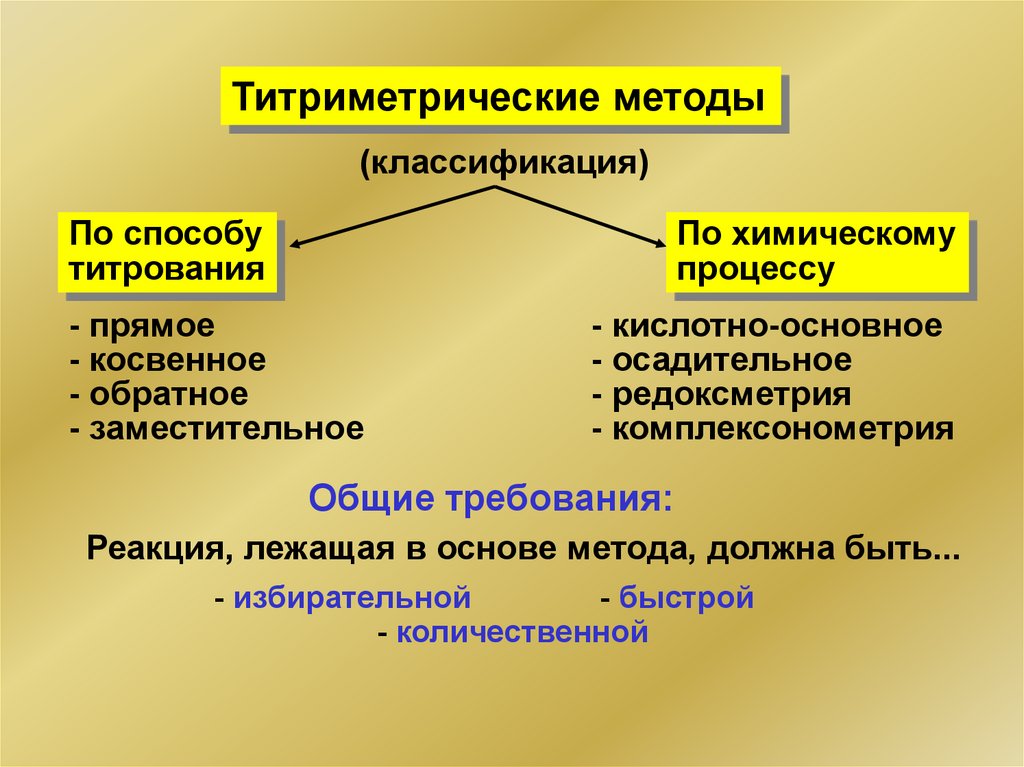
Титриметрические методы(классификация)
По способу
титрования
По химическому
процессу
- прямое
- косвенное
- обратное
- заместительное
- кислотно-основное
- осадительное
- редоксметрия
- комплексонометрия
Общие требования:
Реакция, лежащая в основе метода, должна быть...
- избирательной
- быстрой
- количественной
16.
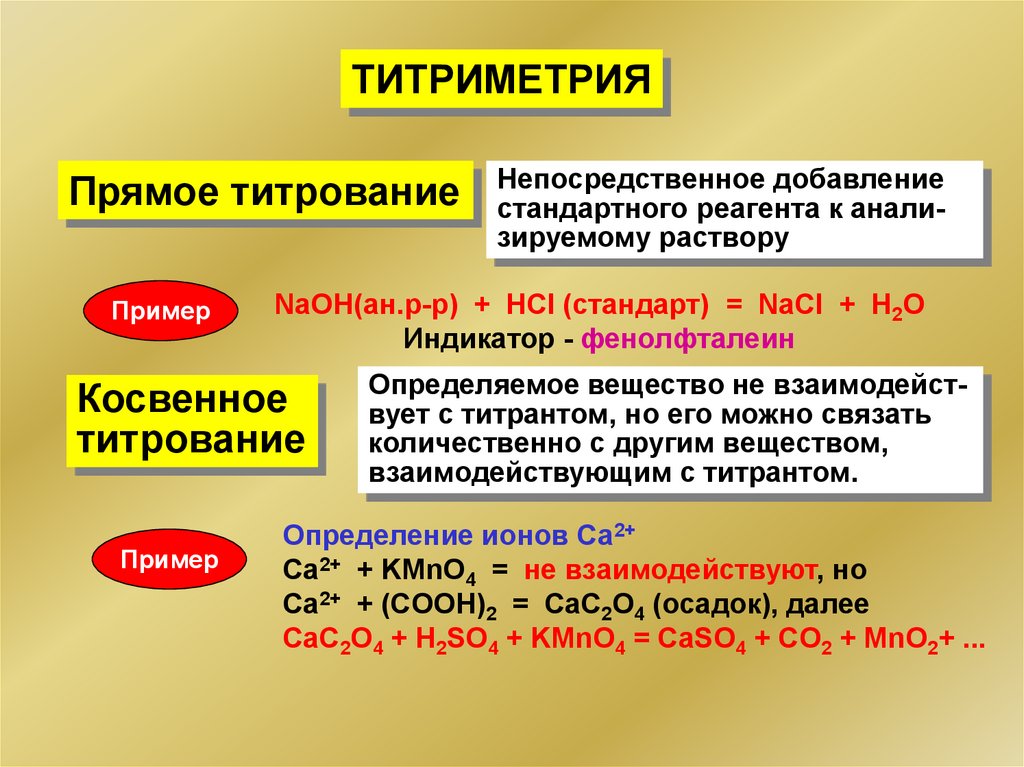
ТИТРИМЕТРИЯПрямое титрование
Пример
NaOH(ан.р-р) + HCl (стандарт) = NaCl + H2O
Индикатор - фенолфталеин
Косвенное
титрование
Пример
Непосредственное добавление
стандартного реагента к анализируемому раствору
Определяемое вещество не взаимодействует с титрантом, но его можно связать
количественно с другим веществом,
взаимодействующим с титрантом.
Определение ионов Са2+
Ca2+ + KMnO4 = не взаимодействуют, но
Сa2+ + (COOH)2 = CaC2O4 (осадок), далее
CaC2O4 + H2SO4 + KMnО4 = CaSO4 + CO2 + MnO2+ ...
17.
ТИТРИМЕТРИЯОбратное титрование
Титрование непрореагировавшего
вещества, которое прибавлено в
избытке в виде стандартного
раствора к анализируемому раствору
Пример
Определение содержания KBr по Фольгарду
KBr + AgNO3(изб.) = KNO3 + AgBr + AgNO3(ост.)
AgNO3(ост.) + NH4CNS = NH4NO3 + AgCNS
Индикатор - Fe3+ (Fe3+ + 3CNS- = Fe(CNS)3 (алый))
определяемое вещество не реагирует
Заместительное Если
с титрантом, к раствору добавляют вспотитрование
могательный реагент, образующий с определяемым веществом эквивалентное
количество вещества-заместителя.
Пример
Определение KMnO4
KMnO4 + KI + H2SO4 = I2 (эквивалентное кол-во) + ...
I2 + Na2S2O3 = NaI + Na2S4O6 (Индикатор - крахмал)
18.
Кислотно-основноетитрование
Основано на реакции переноса
протонов или электронных пар
NaOH(ан.р-р) + HCl (стандарт) NaCl + H2O
Титрант – сильная кислота (ацидиметрия) или щелочь
(алкалиметрия)
Исследуемые вещества – сильные и слабые кислоты и основания,
многие гидролизующиеся соли
Индикаторы – кислотно-основные, меняющие цвет в зависимости
от рН (фенолфталеин, метиловый красный и др.)
Применение в медицине:
кислотность желудочного содержимого
щелочность промывных вод при мытье посуды
кислотность пищевых продуктов (хлеба, муки, творога и др.)
годность лекарственных препаратов (анальгина, аспирина и др.)
19.
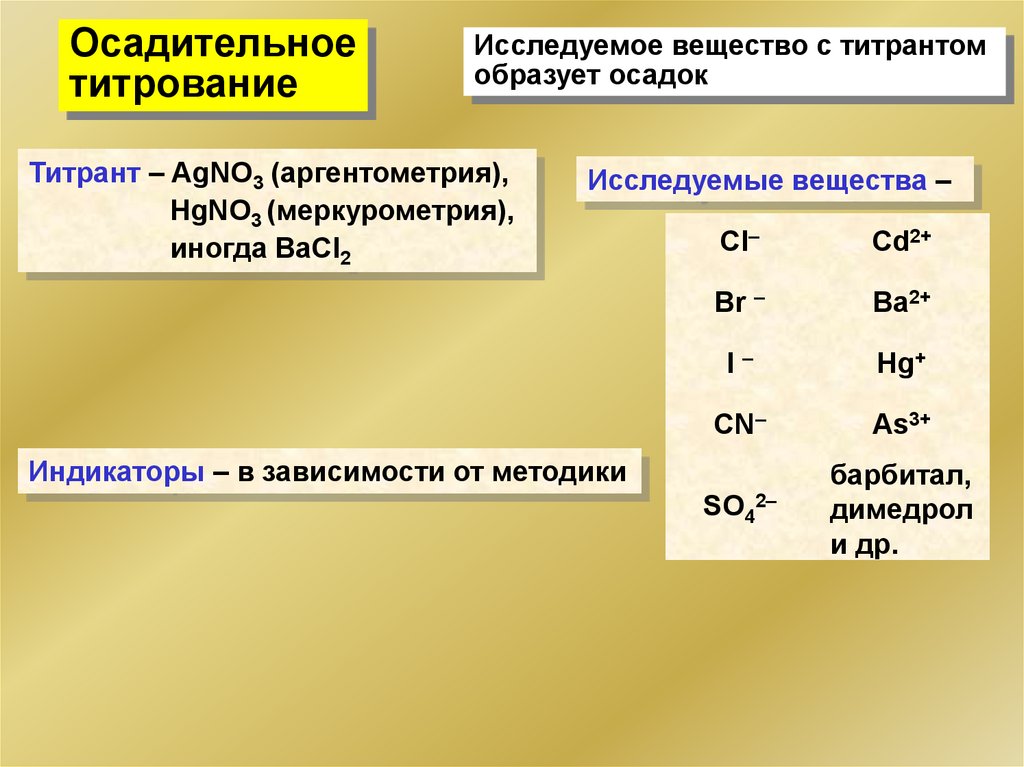
Осадительноетитрование
Исследуемое вещество с титрантом
образует осадок
Титрант – AgNO3 (аргентометрия),
HgNO3 (меркурометрия),
иногда BaCl2
Исследуемые вещества –
Cl–
Cd2+
Br –
Ba2+
I–
Hg+
CN–
As3+
SO42–
барбитал,
димедрол
и др.
Индикаторы – в зависимости от методики
20.
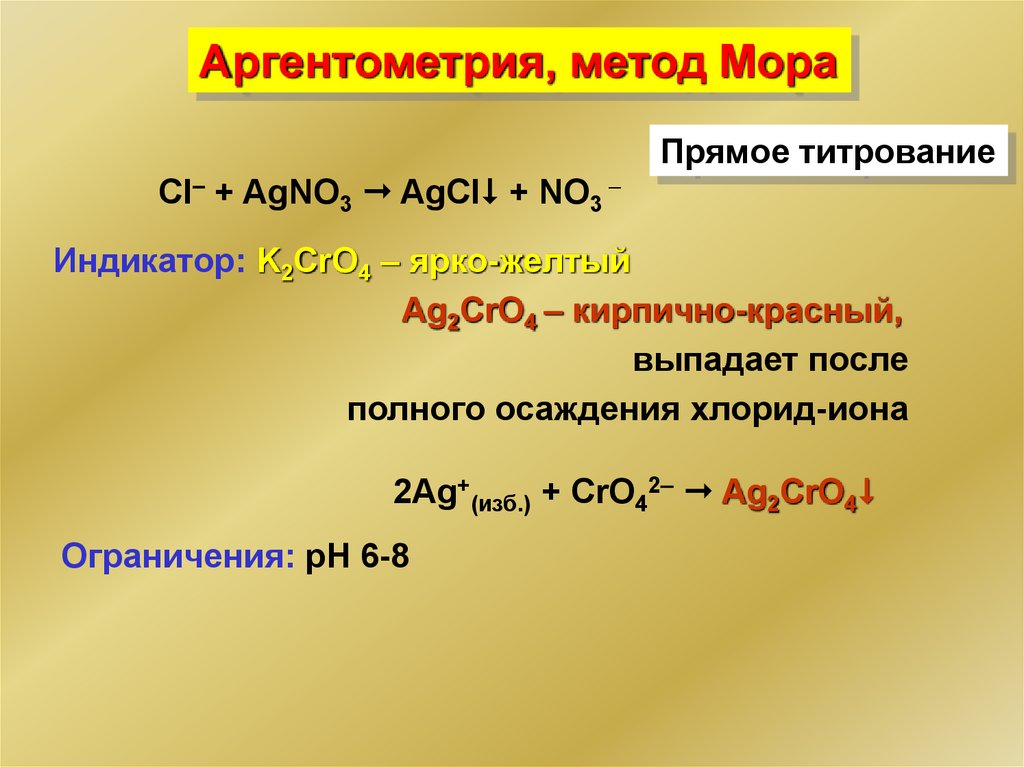
Аргентометрия, метод МораПрямое титрование
Cl– + AgNO3 AgCl + NO3 –
Индикатор: K2CrO4 – ярко-желтый
Ag2CrO4 – кирпично-красный,
выпадает после
полного осаждения хлорид-иона
2Ag+(изб.) + CrO42 Ag2CrO4
Ограничения: рН 6-8
21.
Аргентометрия, метод ФольгардаОбратное титрование
Cl– + AgNO3(избыток!) AgCl + NO3 –
{+ AgNO3(изб.)}
AgNO3(изб.) + NH4SCN AgSCN + NH4NO3
Индикатор: соль Мора NH4Fe(SO4)2 12H2O
Fe3++ SCN (изб.) + 3H2O [Fe(H2O)3(SCN)3]
Ярко-красный
комплекс
22.
КомплексонометрияТитрование раствором вещества,
образующего с определяемым
растворимый комплекс.
Титрант – трилон Б (двунатриевая
соль этилендиаминтетрауксусной
кислоты, ЭДТА-Na)
и другие комплексоны
Индикаторы – металлохромные
(тоже комплексоны), например,
эриохром черный, мурексид и др.
Исследуемые вещества –
ионы металлов (Ca2+, Mg2+,
Ba2+, Cu2+, Bi2+, Cd2+ и др.),
сульфат-ион.
23.
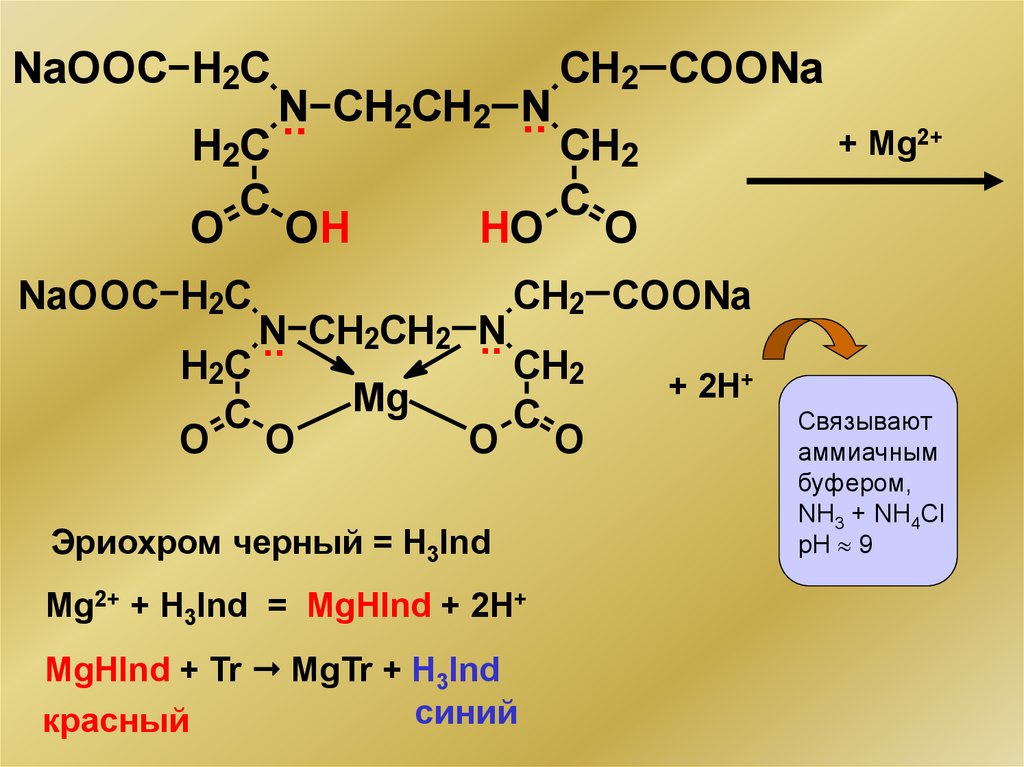
NaOOC H2CN
..
.. CH2CH2 N
H2C
C
O OH
CH2 COONa
+ Mg2+
CH2
C
HO O
NaOOC H2C
CH2 COONa
N
..
.. CH2CH2 N
H2C
CH2
Mg
C
C
O O
O O
Эриохром черный = H3Ind
Mg2+ + H3Ind = MgHInd + 2H+
MgHInd + Tr MgTr + H3Ind
синий
красный
+ 2H+
Связывают
аммиачным
буфером,
NH3 + NH4Cl
pH 9
24.
O2-
C
O
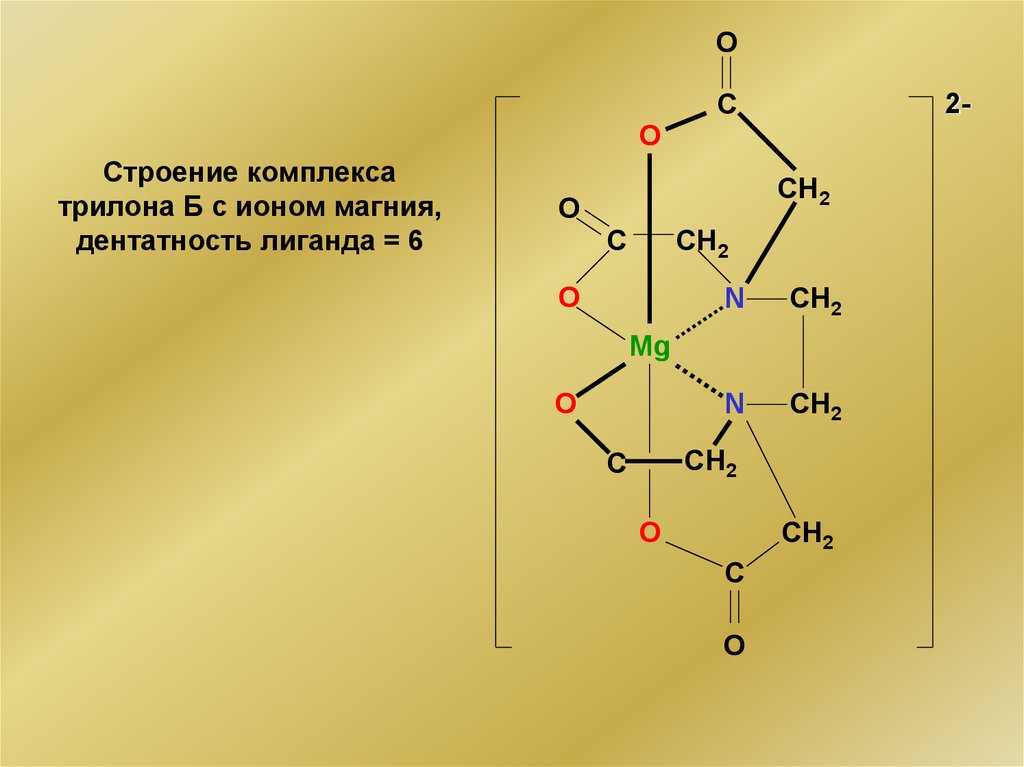
Строение комплекса
трилона Б с ионом магния,
дентатность лиганда = 6
CH2
O
C
CH2
O
N
CH2
N
CH2
Mg
O
CH2
C
O
CH2
C
O
25.
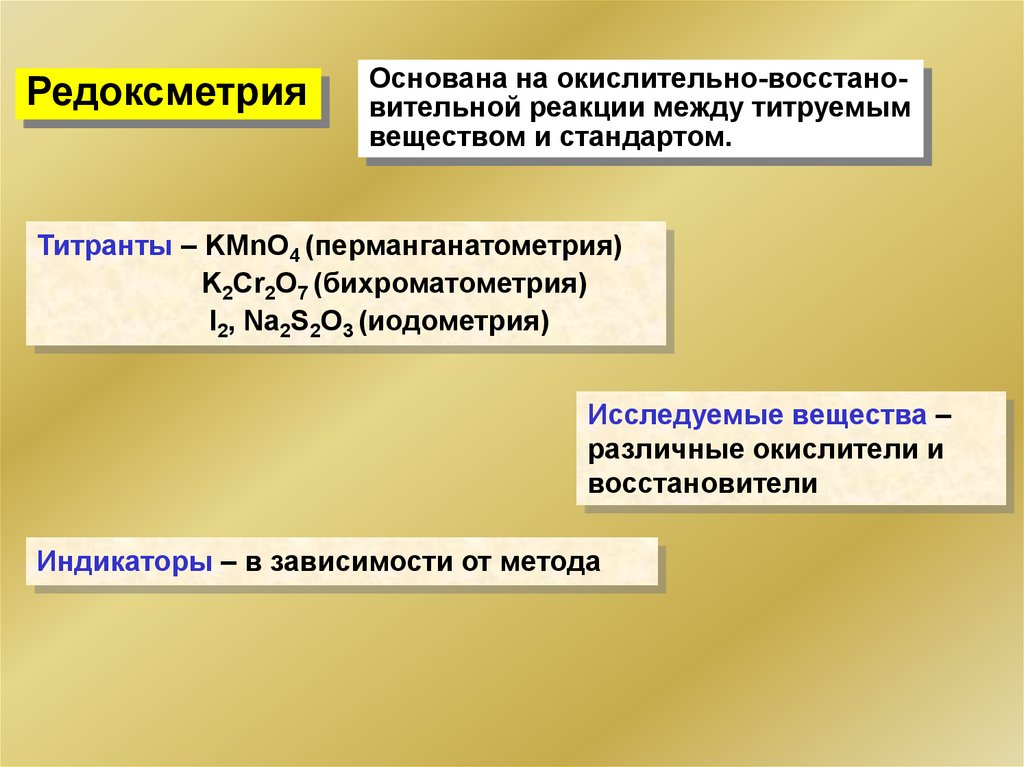
РедоксметрияОснована на окислительно-восстановительной реакции между титруемым
веществом и стандартом.
Титранты – KMnO4 (перманганатометрия)
K2Cr2O7 (бихроматометрия)
I2, Na2S2O3 (иодометрия)
Исследуемые вещества –
различные окислители и
восстановители
Индикаторы – в зависимости от метода
26.
ИодометрияРабочие растворы – Na2S2O3, KI или I2
Исследуемые вещества –
различные окислители и
восстановители
Индикатор – крахмал
Практическое определение содержания
активного хлора в хлорной извести:
CaOCl2 + 2HCl Cl2 + CaCl2 + H2O
Cl2 + 2KI I2 + 2KCl
I2 + Na2S2O3 2NaI + Na2S4O6
тиосульфат
натрия
Заместительное
титрование
27.
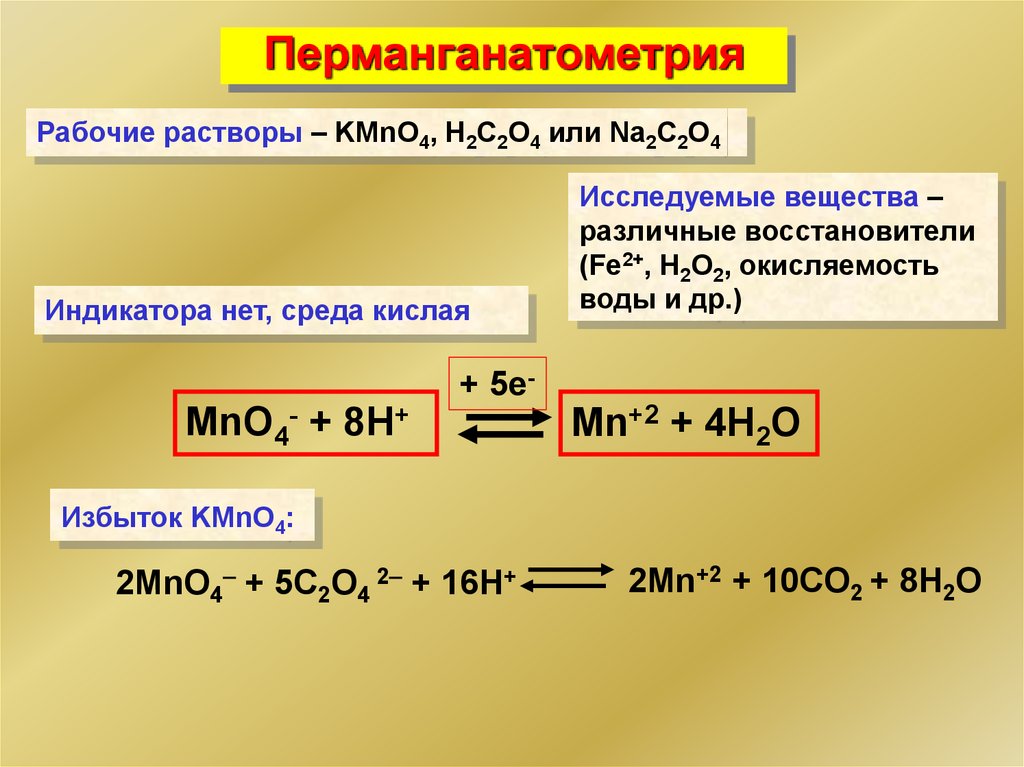
ПерманганатометрияРабочие растворы – KMnO4, H2C2O4 или Na2C2O4
Индикатора нет, среда кислая
MnO4- + 8Н+
+ 5е-
Исследуемые вещества –
различные восстановители
(Fe2+, H2O2, окисляемость
воды и др.)
Mn+2 + 4Н2О
Избыток KMnO4:
2MnO4 + 5C2O4 2 + 16Н+
2Mn+2 + 10CO2 + 8Н2О














 Химия
Химия








