Похожие презентации:
Основные положения и формулировки 2-ого закона термодинамики
1.
Основные положения и формулировки2-ого закона термодинамики.
Термический коэффициент полезного
действия цикла теплового двигателя.
Холодильный коэффициент циклов.
Цикл Карно. Энтропия.
Практика №1
2.
Второй закон термодинамикиВ 50-х годах XIX столетия Клаузиусом была дана
наиболее общая и современная формулировка второго
закона термодинамики в виде следующего постулата:
«Теплота не может переходить от холодного тела к
более нагретому сама собой даровым процессом (без
компенсации)».
3.
Одновременно с Клаузиусом в 1851 г. УильямомТомсоном была высказана другая формулировка
второго закона термодинамики
Механическую работу, электрическую работу, работу
магнитных сил и т. д. можно без остатка, полностью,
превратить в теплоту.
Что же касается теплоты, то только часть ее может быть
превращена в периодически повторяющемся процессе
в механическую работу и иные виды работы; другая ее
часть неизбежно должна быть передана холодному
источнику. В этом суть второго закона термодинамики.
4.
Все виды энергии, в конечном счете, превращаются в теплоту, котораязатем рассеивается в окружающей среде. Мера этого рассеивания была
названа энтропией. Чем больше рассеивается (обесценивается) энергия,
тем больше увеличивается энтропия.
Для получения работы необходимо иметь источник теплоты с высокой
температурой, или теплоотдатчик, и источник теплоты с низкой
температурой, или теплоприемник (холодильник).
5.
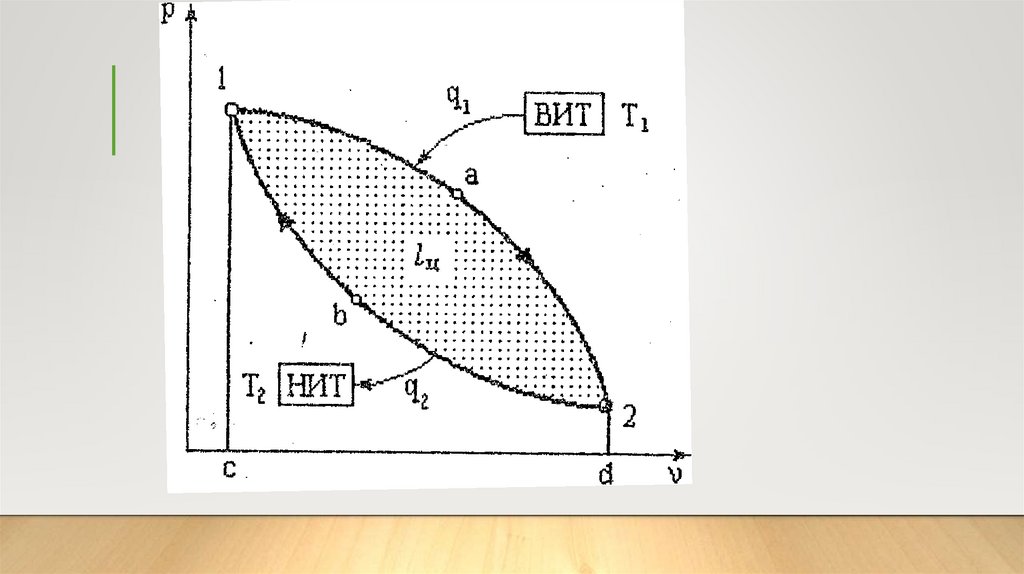
Условия работы тепловыхмашин
Для того чтобы от тепловой машины можно было получить полезную работу,
необходимо выполнить следующие условия.
1. Необходимо иметь рабочее тело - это тело, посредством которого осуществляется
взаимное превращение теплоты и работы.
2. Необходимо наличие, по меньшей мере, двух источников теплоты с разными
температурами - верхний (высший) источник теплоты (ВИТ) или нагреватель и нижний
(низший) источник теплоты (НИТ) или холодильник.
3. Работа тепловой машины должна быть цикличной, т.е. рабочее тело, совершая ряд
процессов, должно возвращаться в исходное состояние.
6.
7.
8.
9.
Обратимые и необратимые циклыЦикл, состоящий из равновесных обратимых процессов, будет
обратимым. Рабочее тело в таком цикле не должно подвергаться
химическим изменениям.
Если хоть один из процессов, входящих в состав цикла, является
необратимым, то и весь цикл будет необратимым.
10.
Термический КПД и холодильныйкоэффициент циклов
Отношение количества теплоты, превращенной в положительную
работу за один цикл, ко всей теплоте, подведенной к рабочему телу,
называется термическим коэффициентом полезного действия
прямого цикла:
11.
12.
Без затраты работы сам собой такой переходневозможен. Степень совершенства
обратного цикла определяется так
называемым холодильным коэффициентом
цикла
Холодильный коэффициент показывает, какое
количество теплоты отнимается от холодного
источника при затрате одной единицы
работы. Его величина, как правило, больше
единицы.
13.
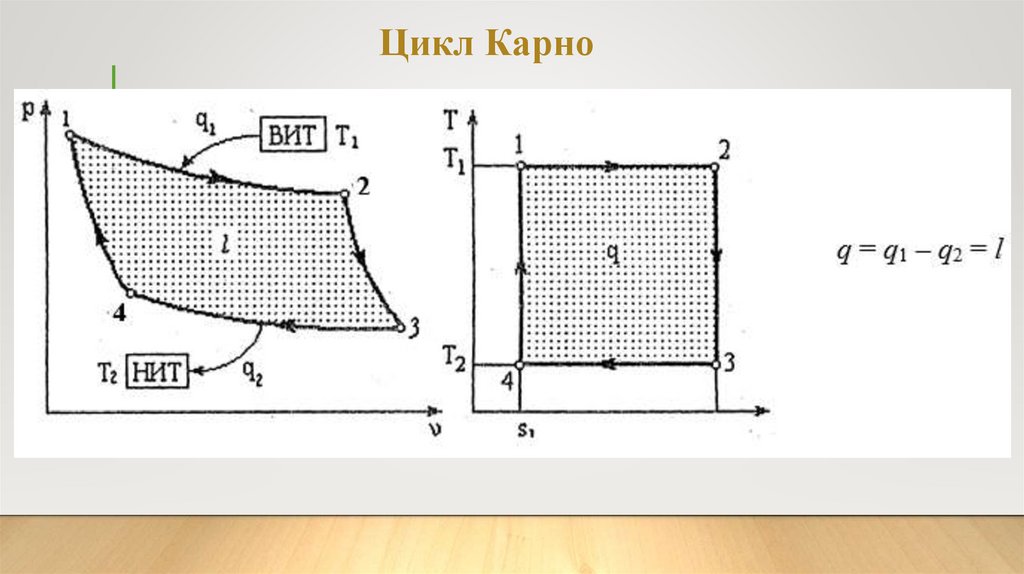
Цикл Карно14.
Следовательно, уравнение термическогок.п.д. цикла Карно
принимает вид:
после
сокращения
15.
Термический к. п. д. цикла Карно всегда меньше единицы, так какдля получения к.п.д., равного единице, необходимо, чтобы Т2=0 или
Т1=∞, что неосуществимо. Термический к.п.д. цикла Карно не
зависит от природы рабочего тела и приТ2=Т1 равен нулю, т. е. если
тела находятся в тепловом равновесии, то невозможно теплоту
превратить в работу.
В реальных двигателях цикл Карно не осуществляется вследствие
практических трудностей. Однако теоретическое и практическое
значение цикла Карно весьма велико. Он служит эталоном при
оценке совершенства любых циклов тепловых двигателей.
16.
Математическое выражение второго законатермодинамики. Энтропия.
17.
Приведенной теплотой называется отношение подводимой или отводимой теплотык соответствующей абсолютной температуре.
выведенное Клаузиусом в 1854 г., представляет собой математическое
Последнее выражение второго закона термодинамики
для произвольного обратимого цикла и называется
первым интегралом Клаузиуса.
18.
Для необратимого цикла Карно термический к.п.д. будет меньшесоответствующего
к.п.д.
обратимого
цикла
температурах источника теплоты и холодильника
Или
при
одинаковых
19.
20.
Энтропия есть однозначная функция состояния тела, принимающая длякаждого состояния вполне определенное значение. Энтропия, являясь
экстенсивным (зависит от массы вещества) параметром состояния, в
любом термодинамическом процессе полностью определяется крайними
состояниями тела и не зависит от пути процесса. Это свойство относится
как к обратимым, так и необратимым процессам.
Измеряется полная энтропия S в Дж/град,
а удельная энтропия s - в Дж/кг·град.
21.
Энтропия может быть определена как функция основных параметровсостояния (p, v, T).
22.
Аналитическое выражение второго закона термодинамики для бесконечно малого обратимогопроцесса имеет вид:
23.
Все действительные процессы являются необратимыми, поэтому энтропияизолированной системы всегда увеличивается. Возрастание энтропии при
необратимых процессах связано с уменьшением работоспособности
изолированной системы.
Все необратимые процессы в изолированной системе сопровождаются обесценением
энергии, которая из более полезной формы переходит в менее полезную. Происходит
рассеивание энергии и ее деградация. Энтропия системы при этом увеличивается. Все
самопроизвольные, т. е. необратимые процессы, протекают всегда с увеличением
энтропии.
24.
Отсчет значений энтропии можно вести от любого состояния. Для газов принятосчитать значение энтропии равным нулю при нормальных условиях, т. е.
при р = 101325 Па и Т = 273,15 К (760 мм рт. ст. и 0° С).
Определение энтропии для любого, состояния газа, отсчитанной от нормального состояния, производят по
следующим формулам. При постоянной теплоемкости:
25.
26.
Изменение энтропии в термодинамическихпроцессах (при постоянной теплоемкости):
























 Физика
Физика








