Похожие презентации:
Расчётные формулы. Электронный репетитор для учащихся 8 -11 классов
1.
ГОУ Волгоградская санаторная школа – интернат «Созвездие»Электронный репетитор для учащихся 8-11 классов
2006
2.
Авторы:Ахмедов Альберт
Саутенко Александр
Руководитель –
Ширшина Наталья Владимировна
3. Содержание:
Количество веществаЧисло структурных единиц
Относительная плотность газов
Массовая доля вещества в смеси
Массовая доля элемента
Объёмная доля газа
Мольная доля вещества
Средняя молярная масса смеси газов
Массовая доля газа
Объединённый газовый закон Бойля – Мариотта и Гей-Люссака
Уравнение Менделеева – Клапейрона
Массовая доля растворённого вещества
Массовая доля растворённого вещества в смешанном растворе
Диагональная схема смешивания растворов («правило креста»)
Молярная концентрация растворённого вещества
Скорость химической реакции
Закон действующих масс
Правило Вант-Гоффа
Молярная масса (для газов)
Плотность вещества
4. Количество вещества
mv=
M
Пример
Для газов:
V
v=
Vm
Пример
Vm=22,4 л/моль (при н. у. - 0 C; 101,3 кПа)
0
5. Число структурных единиц
N = NA vNA - число Авогадро - 6,02 .1023
Пример
6. Относительная плотность газов
M1D=
M2
M газа
DH 2 =
2
Пример
M газа
Dвозд =
29
7. Массовая доля вещества в смеси
m(вещества)w=
m(смеси)
Пример
8. Массовая доля элемента
М (Э )w (Э ) =
М ( вещества)
v(Э ) M (Э )
w (Э ) =
M (Э )
Пример
9. Объёмная доля газа
V ( газа )j=
V (смеси)
Пример
10. Мольная доля вещества
v(вещества)c=
v(смеси)
Пример
11. Средняя молярная масса смеси газов
M ( X + Y + Z ) = j ( X ) M ( X ) + j (Y ) M (Y ) + j ( Z ) M ( Z )M ( X + Y + Z ) = c ( X ) M ( X ) + c (Y ) M (Y ) + c ( Z ) M ( Z )
Пример
12. Массовая доля газа
w газа =c газа M газа
M (смеси)
Пример
13. Объединённый газовый закон Бойля – Мариотта и Гей-Люссака
рV p0V0=
T
T0
Где ρ0 = 101,3 кПа,
V0 - объём газа при н.у.
T0 = 273
Пример
14. Уравнение Менделеева - Клапейрона
mpV = vRT =
RT
M
Дж
Где R = 8 ,314
моль К
Пример
15. Массовая доля растворённого вещества
m( р.в.)w ( р.в.) =
mраствора
m( р.в.)
w ( р.в.) =
m( р.в.) + mH 2O
m( р.в.)
w ( р.в.) =
Vраствора r
Пример
16. Массовая доля растворённого вещества в смешанном растворе
m1( р.в.) + m2( р.в.)wсм( р.в.) =
m1( р - ра ) + m2( р - ра )
Пример
17. Диагональная схема смешивания растворов («правило креста»)
w1w2
w см
Массовые
(w1 - w см ) части
исходных
w
w
( см
2 ) растворов
w1 - Более высокая массовая доля исходного раствора.
w2 - Белее низкая массовая доля исходного раствора.
wсм - Массовая доля раствора, полученного при
смешивании.
Пример
18. Молярная концентрация растворённого вещества
v мольC=
V л
V мл r w( р.в.)
C=
M ( р.в.) Vл
m
C=
M V
Пример
19. Скорость химической реакции
DCu=
Dt
Где τ - время
Пример
20. Закон действующих масс
u = k C (a ) C (b)Пример
21. Правило Вант-Гоффа
u 2 = u1 g0- 0
t1 t 2
0
10
Пример
22. Молярная масса (для газов)
M = Vm rM = 2 DH2
Пример
23. Плотность вещества
mr=
V
Пример
24.
Примеры задач:Пример: Вычислите относительную плотность оксида серы
(IV) по водороду и по воздуху.
Дано:
Решение:
M(SO2)=64 г/моль. Из формулы следует, что:
M ( SO2 )
Найти:
D ( SO ) =
H2
D H 2 ( SO2 )
2
M (H 2 )
64
DH 2 ( SO2 ) =
= 32
2
Dвозд (SO2)
M ( SO2 )
64
Dвозд( SO2 ) =
= 2,2
; Dв озд( SO2 ) =
M возд
29
Ответ: DH ( SO2 ) = 32; Dвозд( SO2 ) = 2,2.
2
25.
Примеры задач:Задача: Вычислите, сколько атомов содержится в сере
количеством вещества 2 моль.
Дано:
Решение:
v(S)=2 моль.
Найти:
N(S)
Число структурных единиц серы определяем
по формуле:
N (S ) = N A v(S )
тогда N (S ) = 6 1023 2 = 12 1023(атомов серы).
Ответ: N(S)= 12.1023 атомов серы.
26.
Примеры задач:Задача: Вычислите массовые доли элементов в воде.
Дано:
Решение:
v(H2O)=1 моль.
Молярная масса воды равна:
Найти:
w ( H ); w ( O )
M(H2O)=2.1+16=18 (г/моль).
Берем для расчета количество вещества 1 моль, тогда
m( H 2O) = 18(г).
На основе формулы определяем:
m( H )
v ( H ) M ( H ) 2 1
w(H ) =
=
=
= 0,11, или11%.
m( H 2 O )
M ( H 2O )
18
m(O)
v(O) M (O) 1 16
w (O) =
=
=
= 0,89, или89%.
m( H 2 O )
M ( H 2O )
18
Ответ: w ( H ) = 0,11или11%; w (O) = 0,89или89%.
27.
Примеры задач:Задача: Определите количество вещества,
соответствующее диоксиду кремния массой 180 г.
Дано:
Решение:
m(SiO2)=180 г.
М(SiO2)= М(Si)+2M(O)=28г/моль+2.16г/моль=
Найти:
=60г/моль
Используя формулу, определяем
количество вещества диоксида кремния:
v(SiO2).
m( SiO2 )
M ( SiO2 )
180
= 3 (моль)
тогда v( SiO2 ) =
60
v( SiO2 ) =
Ответ: v(SiO2)=0,5 моль.
28.
Примеры задач:Задача: Определите количество вещества,
соответствующее кислороду объёмом 11,2 л (н.у.).
Дано:
Решение:
V(О2)=11,2 л
Найти:
Для расчета используем формулу:
v (O2 ) =
v(O2)
тогда v(O2 ) =
V (O2 )
Vт
11,2
л
= 0,5 (моль)
22,4 л / моль
Ответ: v(O2)=0,5 моль.
29.
Примеры задач:Пример: Определите массу одной молекулы оксида
углерода (IV).
Дано:
Решение:
M(CO2)=44 г/моль
Найти:
m0(CO2)
Из формулы следует, что 1 моль
вещества содержит 6.1023 молекул,
следовательно:
M(CO2)=m0(CO2).NA
тогда
M (CO2 )
44
- 23
m0 (CO2 ) =
=
=
7
,
31
10
( г ).
23
NA
6 10
Ответ: m0 (CO2 ) = 7,31 10 -23 ( г ).
30.
Примеры задач:Задача: Определите массу серной кислоты количеством
вещества 0,25 моль.
Дано:
Решение:
v(H2SO4)=0,25 моль. Из формулы следует, что:
Найти:
M(H SO )= v(H SO ).M(H SO );
2
4
2
4
2
4
m (H2SO4)
M(H2SO4)=2.M(H)+M(S)+4.M(O)=
=2.1 г/моль+32 г/моль+4.16 г/моль=98 г/моль.
m(H2SO4)=0,25.98=24,5 (г).
Ответ: m(H2SO4)=24,5 г.
31.
Примеры задач:Задача: Определите молярную массу благородного газа Х,
плотность которого по водороду составляет 20.
Назовите этот газ.
Дано:
Решение:
DH2 ( X ) = 20
Из формулы следует, что:
Найти:
M ( X ) = 2 D ( X ),
H2
M(X).
M=20.2=40 (г/моль).
Из Периодической системы элементов следует, что этой
молярной массе соответствует благородный газ аргон
(M(Ar)=39,948 г/моль).
Ответ: M(X)=39,949 г/моль; аргон.
32.
Примеры задач:Задача: Определите массовую долю (%) соли в растворе,
полученном при растворении 50 г соли в 200 г воды.
Дано:
Решение:
m(соли) = 50 г
m(Н2O) = 200 г w (соли) =
Найти:
w (соли)
m(соли)
=
+
m(соли) m( H 2 0)
50
=
= 0,2 или 20%
50 + 200
Ответ: w (соли) = 0,2 или 20%
33.
Примеры задач:Задача: Окисление серы протекает по уравнению: S(тв)+O2(г)=SO2(г)
Как изменится скорость реакции, если объём системы уменьшить в 4 раза?
Дано:
V1/V2=4
Решение:
S(тв) +O2(г)=SO2(г) (гетерогенная реакция)
Найти:
Обозначим концентрацию кислорода: [O2] = a
u2 / u1
1. Согласно закону действующих масс скорость
реакции до изменения объёма равна: u 1= k[O2]=ka
2. Скорость реакции после уменьшения объёма
(вследствие уменьшения объёма концентрация
кислорода увеличивается в 4 раза):u 2= k(4a)=4ka
3. Определяем, во сколько раз возрастёт скорость
реакции:
u2 4ka
=
=4
u1 ka
Ответ: скорость реакции увеличится в 4 раза.
34.
Примеры задач:Задача: Вычислите, во сколько раз увеличится скорость реакции при
повышении температуры от 30 до 70 0С, если температурный
коэффициент скорости реакции равен 2.
Дано:
t=30 0C;
t=70 0C;
g = 2.
Решение:
По правилу Вант-Гоффа
u ( t 2 ) = u ( t1 ) g
t 2 - t1
10
По условию задачи требуется определить u (t 2 ) / u (t 1 ).
Найти:
u(t2 ) /u(t1 )
Подставим данные задачи в формулу:
t 2 - t1
70 - 30
u(t2 )
= g 10 = 2 10 = 2 4 = 16
u (t 1 )
Следовательно, скорость реакции увеличится в 16 раз
Ответ: увеличится в 16 раз.
35.
Примеры задач:Задача: Определите молярную и нормальную концентрации растворённого вещества в 1 л
раствора с массовой долей серной кислоты 62%, плотность которого равна 1,52 г/мл.
Решение:
Дано:
w ( H 2 SO4 ) = 62% 1.Определяем массу серной кислоты в 1 л (1000 мл)
раствора с массовой долей H2SO4 62%:
r = 1 2 г/мл
V =1л
Найти:
С(H2SO4);
Сэкв(H2SO4)
m(H 2 SO4 ) = V r w (H 2 SO4 ) = 1000 1,52 0,62 = 942 , 4 (г)
2.Вычисляем молярность раствора (объём раствора
составляет 1 л):
С(H 2 SO 4 ) =
m ( H 2 SO 4 )
942 , 4
=
= 9 ,616
M ( H 2 SO 4 )
98 1
(моль/л) или 9,616 М
Задачу можно решить в одно действие:
С ( H 2 SO4 ) =
Cм =
m( H 2 SO4 ) V ( мл) r w ( H 2 SO4 ) 1000 1,52 0,62
=
=
= 9,616( моль / л), или 9,616 М
M ( H 2 SO4 )
M ( H 2 SO4 ) V ( л)
98 1
V р ( мл) r w
M V ( л)
3.Определяем нормальную концентрацию раствора:
M ( H 2 SO 4 )
98
=
= 49 (г/моль)
основность кислоты
2
m ( H 2 SO 4 )
1000 1,52 0 , 62
=
= 19 , 232 (н.)
С экв ( H 2 SO 4 ) =
M экв ( H 2 SO 4 ) V
49 1
M экв ( H 2 SO 4 ) =
Ответ: С(H2SO4)=9,616 М
Сэкв(H2SO4)=19,232 н.
36.
Примеры задач:Задача: При давлении 105,4 кПа и температуре 25 0С азот занимает сосуд объёмом 5,5 л.
Вычислите количество вещества азота, находящегося в данном сосуде.
Дано:
Решение:
p=105,4 кПа;
Способ 1.
t=25 0C;
1.Вычисляем абсолютную температуру, при которой находится азот:
V(N2)=5,5 л
T= 273+t = 273+25 = 298 (K).
Найти:
u ( N2 )
2.На основе формулы определяем объём азота при н.у.:
V0 =
РVT 0
Р0T
=
105 , 4 5 , 5 273
= 5 , 24 ( л )
101 , 3 298
3.По формуле вычисляем количество вещества азота, находящееся в
сосуде:
n (N
Способ 2.
) =
2
V(N
V
2
m
)
=
5 , 24
= 0 , 234
( моль)
22 , 4
1.Вычисляем абсолютную температуру, при которой
находится азот: T=273+25=298 (K)
2.Вычисляем количество вещества азота. Из
уравнения Менделеева-Клапейрона следует, что
Ответ: v(N2)=0,234
моль
n (N 2 ) =
РV
RT
=
105 , 4 5 , 5
= 0 , 234
8 ,31 298
37.
Примеры задач:Задача: Воздух состоит примерно из 4 объёмов азота и 1 объёма
кислорода. Определите среднюю молярную массу воздуха.
Решение:
Дано:
V(N2) : V(O2)=
=4 : 1
Найти:
M (воздуха)
1.Используя формулу, определяем объёмные доли газов:
j (N 2 ) =
V (N2 )
4
=
= 0 ,8
V ( N 2 ) + V (O 2 ) 4 + 1
j (O 2 ) =
V (O 2 )
1
=
= 0,2
+
+
V ( N 2 ) V (O 2 ) 4 1
2.На основе формулы находим среднюю молярную массу
воздуха:
М(воздуха)= 0,8 28 + 0,2 32 = 28,8 29
М(воздуха)= j ( N 2 ) M ( N 2 ) + j (O 2 ) M (O 2 )
Ответ: М(воздуха) 29 г/моль.
(г/моль)
38.
Примеры задач:Задача: Смешали 300 г раствора с массовой долей хлорида натрия 20%
и 500 г раствора с массовой долей - 40%. Вычислите массовую долю
хлорида натрия в полученном растворе.
Дано:
Решение
т1р-ра=300 г
m1( р - ра) w1 + т2( р - ра) w2
т2 р-ра=500г
wсм =
Найти:
300 0,2 + 500 0,4
wсм =
= 0,325 или 32,5%
300 + 500
w1 = 20%
w2 = 40%
wсм
т1( р - ра) + т2( р - ра)
39.
Примеры задач:Задача: Имеются растворы с массовой долей хлорида натрия 10 и 20%. Какую массу
каждого раствора надо взять для получения 300 г раствора с массовой долей соли 12%?
Дано:
Решение:
w1 = 10%
w2 = 20%
1.
mсм ( р - ра) = 300г
0,2
wсм = 12%
0,02
0,12
0,1
Найти:
По правилу креста определяем массовые части исходных
растворов:
0,08
Следует смешать более концентрированный раствор (20%) и 10%
р-р в соотношении 0,02:0,08 или 1:4 (всего 5 частей).
m1(р-ра)
m2(р-ра)
Масса 10% р-ра:
300 4
= 240
5
Масса20%раствора:
300 1
= 60
5
40.
Примеры задач:Задача: Определить молярную массу газа Х, если масса его 0,6 л (н.у.) составляет 0,75 г.
Дано:
m(X)-0,75 г
V(X)- 0,6 л
Найти:
M(X)
Решение:
По формулам:
m
r =
V
M =Vm r
Рассчитаем:
М=22,4л/моль.(0,75г : 0,6 л) = 28 г/моль
41.
Примеры задач:Задача: Рассчитайте плотность газа Х, если масса его 0,6 л (н.у.) составляет 0,75 г.
Дано:
m(X)-0,75 г
V(X)- 0,6 л
Найти:
r (X)
Решение:
По формуле:
m
r =
V
Рассчитаем: r
0,75г : 0,6 л =1,25 г/л
Ответ: r =1,25г/л
42.
Примеры задач:Задача: Смесь азота и оксида углерода(IV) объёмом 14 л (н.у.) имеет массу 25,5 г.
Определите объёмную, мольную и массовую долю азота в смеси.
Дано:
Решение:
1.Находим количество вещества газовой смеси:
m(смеси)=25,5г
V(смеси)=14л
Найти:
j ( N2 ); c ( N2 ); w( N2 )
v(смеси ) =
V (смеси )
14
=
= 0,625( моль)
Vm
22,4
2.Вычисляем среднюю молярную массу смеси:
m(смеси ) 25,5
M (смеси ) =
=
= 40,8( г / моль)
v(смеси ) 0,625
3. Находим объёмную долю азота в смеси. Пусть x – объёмная доля азота в
смеси, тогда (1-х) – объёмная доля оксида углерода (IV) в смеси:
j (N 2 ) = x, j (CO 2 ) = 1 - x;
M (смеси ) = j ( N 2 ) М ( N 2 ) + j (CO 2 ) M (CO2 )
40,8 = x 28 + (1 - x) 44; x = 0,2 или 20%
4. Определяем мольную долю азота в смеси. По закону Авогадро объёмная
доля газа в смеси равна его мольной доле, поэтому объёмная доля азота
равна его мольной доле (0,2 или 20%)
5.Вычисляем массовую долю азота в смеси:
v( N 2 ) = c ( N 2 ) v(смеси ) = 0,2 0,625 = 0,125( моль),
т( N2 ) = v( N2 ) M ( N2 ) = 0,125 28 = 3,5(г),
откуда w ( N 2 ) =
m( N 2 )
3,5
=
= 0,137, или 13,7%
m(смеси ) 25,5
43.
Примеры задач:Задача: Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А
равна 0,22 моль/л, а через 10 сек -0,215 моль/л. Вычислите среднюю скорость реакции.
Решение:
Дано:
С1 -0,22 моль/л
С2 -0,215 моль/л
t =10 сек
u=
D C
D t
Найти:
Среднюю скорость р-и
u=
0,22-0,215(моль/л)
10 сек
=
0,0005
моль/л
сек



















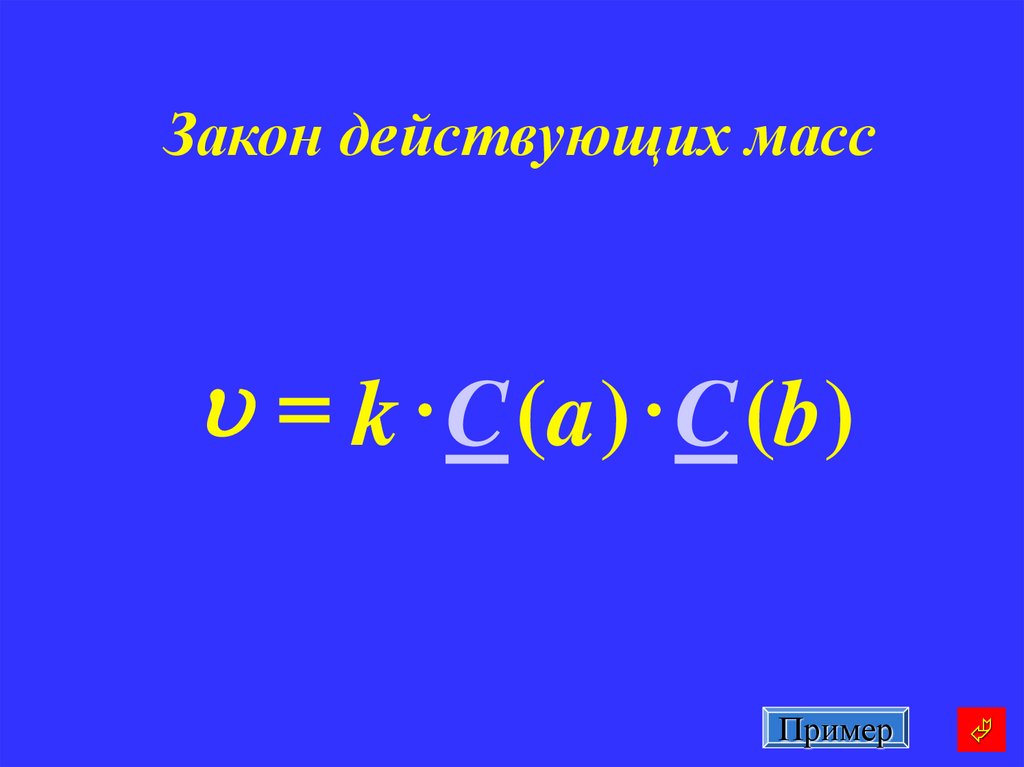























 Химия
Химия








