Похожие презентации:
Основы молекулярно - кинетической теории
1.
МОЛЕКУЛЯРНАЯ ФИЗИКА.ОСНОВЫ МОЛЕКУЛЯРНОКИНЕТИЧЕСКОЙ ТЕОРИИ.
2.
Составьте конспект (по материалу презентации!)1. Запишите дату и тему «Молекулярная физика. Основы молекулярно-кинетической теории (МКТ)».
2. Запишите определения - слайд 3:
- тепловые явления – это….,
- молекулярная физика – это ….,
- перечислить методы молекулярной физики.
3. Запишите основные положения молекулярно-кинетической теории (МКТ) – слайд 6.
4. Запишите, что такое атом, молекула, ион.
5. Составьте таблицу «Основные физические величины молекулярной физики» (без определений) - слайды 9, 10
6. Запишите решение типовых задач №1-3, вычисления выполните самостоятельно (слайды 22, 23, 24)
7. Запишите определение «Броуновское движение – это…». Что является причиной броуновского движения? Как
движется броуновская частица? Сделайте рисунок. От чего зависит интенсивность броуновского движения? Можно ли
наблюдать броуновское движение в твердых телах?
8. Запишите определение «Диффузия– это…». От чего зависит скорость диффузии? Во всех ли агрегатных состояниях
вещества можно наблюдать диффузию? В каких агрегатных состояниях она протекает быстрее?
3.
Молекулярная физика• После механического движения самые заметные явления в природе связаны
с нагреванием или охлаждением тел, с изменением их физических свойств в
зависимости от температуры. Эти явления называются тепловыми.
• Еще философы древности (Древняя Греция, Левкипп и Демокрит,
догадывались о том, что теплота - это вид внутреннего движения.
• Но только в XVIII в. начала развиваться последовательная молекулярнокинетическая теория. Большой вклад в развитие молекулярно-кинетической
теории был сделан М. В. Ломоносовым. Он рассматривал теплоту как
вращательное движение частиц тела.
• Молекулярная физика - раздел физики, изучающий зависимости
строения и физических свойств тел от характера движения и
взаимодействия между частицами, из которых состоят тела.
• В молекулярной физике применяют два метода: молекулярнокинетический (статический) и термодинамический.
4.
АТОМИСТИКА –учение о дискретном, прерывном
строении материи
Левкипп (5 в. до н.) –
древнегреческий философ,
основоположник атомистики,
учитель и друг Демокрита.
Демокрит (ок. 460 - 370 гг. до н. э.)
В основе мира, согласно Демокриту, лежат два начала атомы и пустота. «Атомос» переводится с греческого как
«неделимое».
Атомы Демокрит считал мельчайшими, неделимыми
частицами, которые носятся в пустоте и отличаются друг от
друга лишь формой, величиной и положением.
Атомы численно бесконечны. Сталкиваясь и сцепляясь
между собой, они образуют тела и вещи, с которыми мы имеем
дело в повседневной жизни. Атомы вечны и неизменны,
отличаются по форме и величине.
Считал, что во Вселенной существует бесчисленное
множество миров, которые возникают, развиваются и гибнут.
5.
Михаил Васильевич Ломоносов (1711-1765)М. В. Ломоносов – первый русский выдающийся ученый, профессиональный
исследователь природы: физик, химик, географ, металлург, математик и астроном.
В XVIII — начале XIX века по распространённым воззрениям причиной
тепловых явлений был присутствующий в каждом теле невесомый флюид –
теплород. Также в химии существовала теория флогистона. Флогистон
представляли как невесомый флюид, «огненная субстанция», улетучивавшаяся из
вещества при сжигании.
Корпускулярно-кинетическая теория М. В. Ломоносова
Ломоносов опытным путём опроверг теории о теплороде и флогистоне,
подготовив тем самым, молекулярно-кинетическую теорию XIX века Клаузиуса,
Людвига Больцмана и Джеймса Максвелла.
Р. Клаузиус
Л. Больцман
Д. Максвелл
6.
Основные положениямолекулярно-кинетической теории
1) Все вещества состоят из мельчайших частиц – атомов, молекул, ионов.
Между молекулами есть промежутки, т. е. строение любого вещества дискретно
(прерывисто).
2) Атомы и молекулы вещества всегда находятся в непрерывном хаотичном
движении (тепловое движение).
3) Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Природа сил взаимодействия – электромагнитная.
.
7.
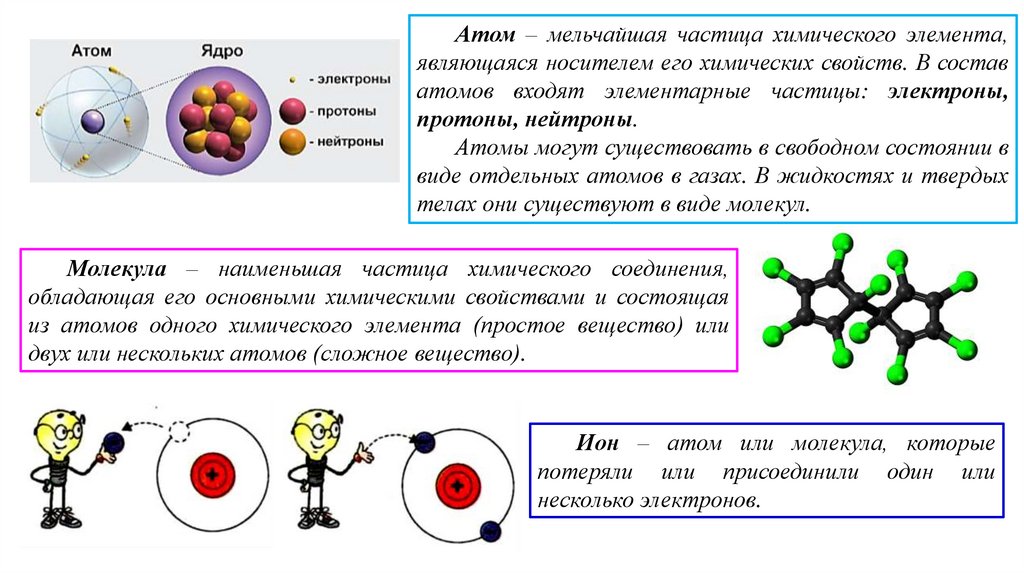
Атом – мельчайшая частица химического элемента,являющаяся носителем его химических свойств. В состав
атомов входят элементарные частицы: электроны,
протоны, нейтроны.
Атомы могут существовать в свободном состоянии в
виде отдельных атомов в газах. В жидкостях и твердых
телах они существуют в виде молекул.
Молекула – наименьшая частица химического соединения,
обладающая его основными химическими свойствами и состоящая
из атомов одного химического элемента (простое вещество) или
двух или нескольких атомов (сложное вещество).
Ион – атом или молекула, которые
потеряли или присоединили один или
несколько электронов.
8.
Размеры и масса молекулДля определения размеров молекул проводились различные опыты. С помощью электронного микроскопа
удалось сфотографировать отдельные крупные молекулы. Методом рентгеноструктурного анализа можно определить
размеры молекул с хорошей точностью. Массы отдельных молекул экспериментально определяют с помощью
специального прибора – масс-спектрометра.
9.
Наименование физическойвеличины
Атомная единица массы (а.е.м.) это единица измерения масс атомов,
молекул и элементарных частиц,
равная 1/12 массы атома изотопа
углерода 12С
Относительная молекулярная
масса (атомная масса Аr ) —
относительное значение массы
молекулы (атома), выраженное в
атомных единицах массы
Постоянная Авогадро (число
Авогадро) NA - это число атомов в
12 граммах чистого изотопа
углерода 12С или число частиц,
содержащихся в 1 моле вещества .
Буквенное обозначение,
единицы измерения
Формула (значение)
m0
1 а.е.м. = 1,66 · 10-27 кг
m0 = 1/12 m0С =
1,66 · 10-27 кг = 1 а.е.м.
Мr , Аr - безразмерные
единицы
NA , [моль-1]
NA = 6,022054(32) · 1023
10.
Количество вещества – этоотношение числа молекул (атомов) N в
данном макроскопическом теле к числу
атомов NA в 0,012 кг (12 грамм)
углерода
Молярная масса – масса 1 моля
вещества
Число молекул
Концентрация вещества - это
физическая величина, равная числу
молекул, содержащихся в единице
объема
Плотность вещества - физическая
величина равная отношению массы
тела к его объему, показывает массу
единичного объема вещества
Латинская n или
греческая ν
Моль – от «молекула»
ν = N / Na
1 моль – количества вещества,
содержащего столько же молекул
(атомов), сколько содержится в
0, 012 кг углерода
М, [кг/моль]
М = mмол · NA = m / ν = m / n
N
N = Na · ν = Na · m / М
n, [1/ м3] или в СИ [ м-3]
n = N/ V
ρ, [кг/ м3]
ρ = m / V = mмол· n
11.
ПОВТОРЕНИЕШКОЛЬНОЙ
ПРОГРАММЫ
12.
Относительная атомная масса и относительная молекулярная массаМасса атомов очень мала. Основную массу атома составляет ядро, которое кроме протонов содержит
еще и нейтроны, массы которых сопоставимы по численным значениям. Оболочку атома составляют
электроны. Масса молекул (за исключением молекул органических веществ, например, белков) также
очень мала. Работать с такими малыми цифрами неудобно, поэтому в физике и химии принято выражать
массы атомов и молекул в относительных единицах: относительная атомная масса Ar и
относительная молекулярная масса Мr
Абсолютные массы атомов некоторых элементов
13.
Величины, с которой сравнивают массу атомов- Дальтон сравнивал массы атомов с массой атома водорода, как самого легкого.
- Кислородная единица, равная 1/16 части массы атома кислорода. К ней перешли потому, что
большинство атомов химических элементов образуют соединения с кислородом.
- Развитие атомной физики. Кислородная единица стала неудобна, так как кислород в природе имеет 16
изотопов, которые отличаются своей атомной массой. Из-за большого разнообразия изотопов кислородная
единица утратила свою актуальность.
- В настоящее время (с 1961 года) общепринятой является углеродная единица, так называемая атомная
единица массы (сокращенно а.е.м.). Она равна 1/12 части массы атома углерода (изотопа 12С).
14.
Почему именно углерод?- у углерода всего 2 изотопа: 12С и 13С; причем первого 98,9%;
- количество органических веществ (их основу составляет углерод) в сотни раз больше, чем
неорганических;
- при переходе от кислородной единицы к углеродной уже посчитанные относительные атомные
массы всех элементов изменились не существенно.
Изотопы - разновидности атомов с одинаковым числом протонов в ядре, но разным числом
нейтронов.
Протоны определяют свойства атома, то есть придают ему индивидуальность.
Нейтроны не влияют на свойства атома, а отражаются на его массе.
Поэтому все изотопы одного и того же элемента химически одинаковы.
15.
Таким образом, масса атома любогохимического элемента связана с массой атома
углерода как относительная атомная масса:
Зная значения абсолютных масс атомов и а.е.м. найдем Аr:
Ar считается безразмерной величиной, либо величиной в а.е.м. Но «а.е.м.» обычно не
пишут, оставляя значение Ar без единиц измерения.
16.
17.
Почему атомная масса дробная?• В периодической системе указаны относительные атомные массы,
посчитанные с учетом всех существующих в природе изотопов элемента.
• Например, химический элемент кислород в природе состоит на 99,76% из
изотопа 16О, на 0,04% из изотопа 17О и на 0,20% из изотопа 18О. Таким
образом, Ar для кислорода является средним значением, учитывающим
относительное содержание его изотопов.
Относительная молекулярная масса
Так как молекулы состоят из атомов, то относительная молекулярная масса (Mr) будет складываться из их
относительных атомных масс. Например:
18.
Количество веществаПоскольку молекулы очень малы, в каждом физическом теле их содержится огромное количество. Так, в 1 см3 воздуха
содержится около 27 · 1018 молекул. Если через маленькое отверстие пропускают по миллиону молекул в секунду, тогда указанное
количество молекул пройдет через отверстие за 840 000 лет. Поэтому также используют относительное число атомов и молекул,
которое характеризуется физической величиной, называемой количеством вещества.
Количество вещества – это отношение числа молекул (атомов) N в данном макроскопическом теле к числу атомов в 0,012 кг
(12 грамм) углерода, единица измерения – моль.
ν = N / Na
Один моль вещества всегда содержит 6,02·1023 его частиц (постоянная Авогадро).
19.
Молярная массаТак как атомы элементов отличаются по своей массе, то и 1 моль вещества тоже будет отличаться по массе.
Массу одного моля вещества называют молярной массой (М) и вычисляют в г/моль или кг/моль.
Молярная масса и количество вещества связаны соотношением:
20.
21.
Типовые задачи помолекулярной физике
22.
Задача №1Определите объем V, занимаемый ртутью количеством вещества ν = 40
моль. Молярная масса ртути M=201·10-3 кг/моль, плотность ртути ρ =
13,6 ∙ 103 кг/м3 .
23.
Задача №2Масса m молекул N= 2,15·1027 некоторого газа равна 1 кг.
Определите, что это за газ.
24.
Задача №325.
БРОУНОВСКОЕДВИЖЕНИЕ.
ДИФФУЗИЯ.
26.
Броуновское движение27.
БРОУНОВСКОЕ ДВИЖЕНИЕ – это беспорядочное движение мелких частиц, взвешенных вжидкости или газе, происходящее под влиянием теплового движения молекул.
Впервые такое движение исследовал и описал в 1827 г. английский ботаник Р. Браун при изучении
под микроскопом взвешенной в воде цветочной пыльцы. Полная теория броуновского движения
была разработана А. Эйнштейном и М. Смолуховским и экспериментально подтверждена Ж.
Перреном.
Причина броуновского движения – тепловое движение молекул среды.
Молекулы жидкости (газа) беспорядочно со всех сторон действуют на броуновские частицы,
поэтому удары (импульсы) оказываются не скомпенсированными, т.к. непрерывно изменяются по
величине и направлению. В результате этого частица находится в беспорядочном движении и
перемещается по отрезкам сложной ломаной (зигзагообразной) линии.
28.
Интенсивность броуновского движения увеличивается с повышением температуры, уменьшениемвязкости среды, уменьшением размера частиц. Оно не зависит от химической природы частиц и
времени наблюдения. Броуновское движение наиболее сильно присуще газам.
29.
ДиффузияЯвление, при котором происходит взаимное проникновение молекул одного вещества между
молекулами другого, называется ДИФФУЗИЕЙ. Явление диффузии объясняется свойством молекул
находиться в беспрерывном движении. Диффузия происходит во всех агрегатных состояниях вещества.
30.
Диффузия в газахПодтверждением движения молекул газа является всем известное распространение запаха какого-либо пахучего вещества
(эфир, керосин, нафталин, духи и др.), внесенного в комнату.
Летучие вещества - это группа химических элементов и химических соединений, которые легко испаряются, т.е. быстро
переходят из жидкого состояния в газообразное.
31.
Диффузия в жидкостяхВ жидкостях наблюдать взаимное проникновение одного вещества в другое можно с
помощью различных опытов с жидкими веществами, например: добавим в крепкий
раствор медного купороса осторожно воду. В начале наблюдается резкая граница между
темно-голубым медным купоросом и бесцветной водой, которая со временем исчезает.
32.
Диффузия в твердых телахВ твердых телах также наблюдается диффузия. Так, в одном из опытов гладко
отшлифованные пластины свинца и золота положили друг на друга и сжали
грузом. Через пять лет золото и свинец проникли друг в друга на 1 мм.
33.
Скорость диффузии зависит от агрегатного состояния вещества итемпературы тела.































 Физика
Физика








