Похожие презентации:
Физико-химические методы анализа. Хроматография
1. Аналитическая химия II. Физико-химические методы анализа ХРОМАТОГРАФИЯ
Аналитическая химия - 12. План лекций
Основные понятияКлассификация методов
История
Хроматографические параметры
Теоретические основы
Основные виды хроматографии
Аналитическая химия - 1
3. Рекомендуемые учебники
КАЗАНСКИЙ (ПРИВОЛЖСКИЙ) ФЕДЕРАЛЬНЫЙУНИВЕРСИТЕТ
-----------------------------------------------Химический институт им.А.М.Бутлерова
ОСНОВЫ ХРОМАТОГРАФИИ
Стойков И.И., Стойкова Е.Е.
5
4
2
3
1
Старт
Казань – 2010
Аналитическая химия - 1
4. УНИВЕРСАЛЬНОСТЬ, ЭКСПРЕССНОСТЬ, ЧУВСТВИТЕЛЬНОСТЬ
Аналитическая химия - 15. Основные понятия
Хроматография (Х) – динамический методразделения и анализа смесей веществ,
основанный на различном распределении их
между двумя несмешивающимися фазами –
подвижной (ПФ) и неподвижной (НФ).
……. основанный на различии между
константами равновесия распределения
компонентов разделяемой смеси между НФ с
большой удельной поверхностью и ПФ,
которая протекает через неподвижную.
Аналитическая химия - 1
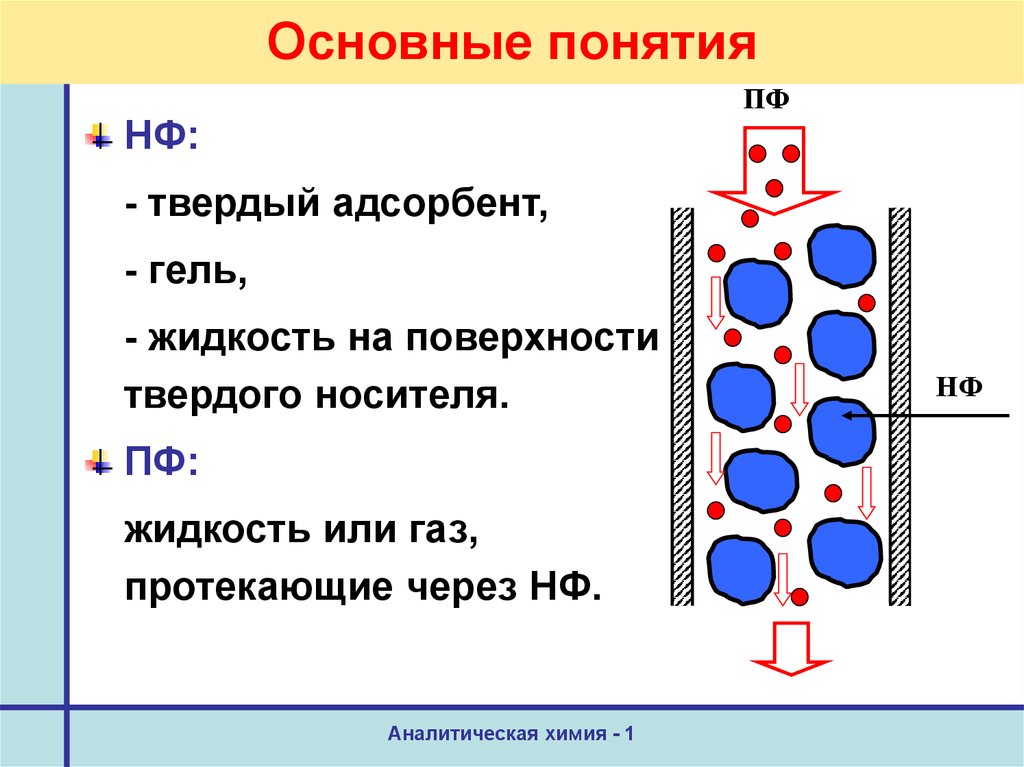
6. Основные понятия
ПФНФ:
- твердый адсорбент,
- гель,
- жидкость на поверхности
твердого носителя.
ПФ:
жидкость или газ,
протекающие через НФ.
Аналитическая химия - 1
НФ
7. Основные понятия
Хроматограмма – внутренняя (полосывдоль колонки) и внешняя (графическое
изображение распределения веществ в
элюате)
Сорбат – анализируемая проба в ПФ
(сорбент – НФ)
Элюент – ПФ на входе
Элюат – ПФ на выходе
Аналитическая химия - 1
8. Классификация
По способу перемещения сорбатоввдоль слоя сорбента:
элюентный (проявительный)
вытеснительный методы
фронтальный
электрохроматография
Аналитическая химия - 1
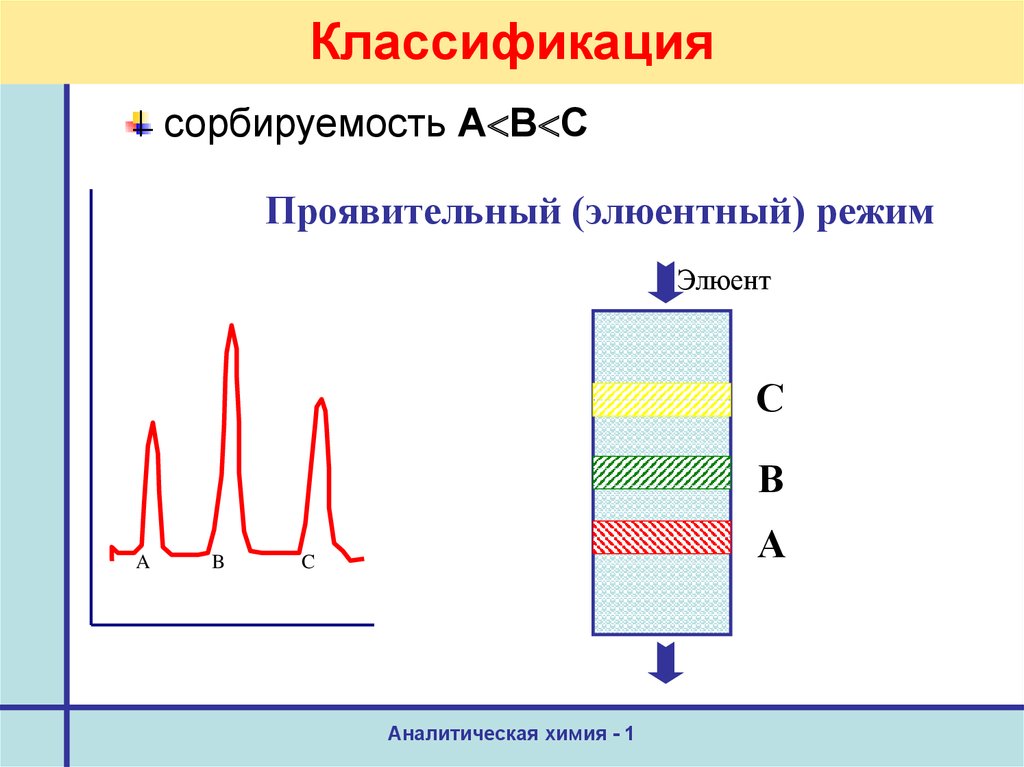
9. Классификация
сорбируемость А В СПроявительный (элюентный) режим
Элюент
С
В
A
B
А
C
Аналитическая химия - 1
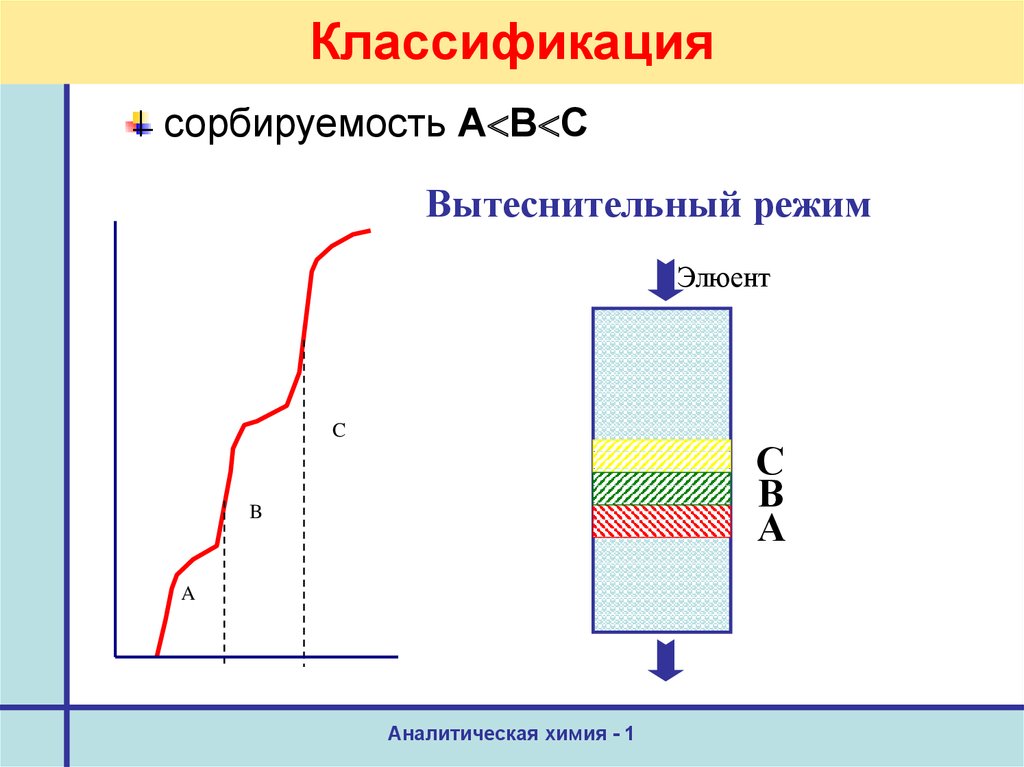
10. Классификация
сорбируемость А В СВытеснительный режим
Элюент
C
С
В
А
B
A
Аналитическая химия - 1
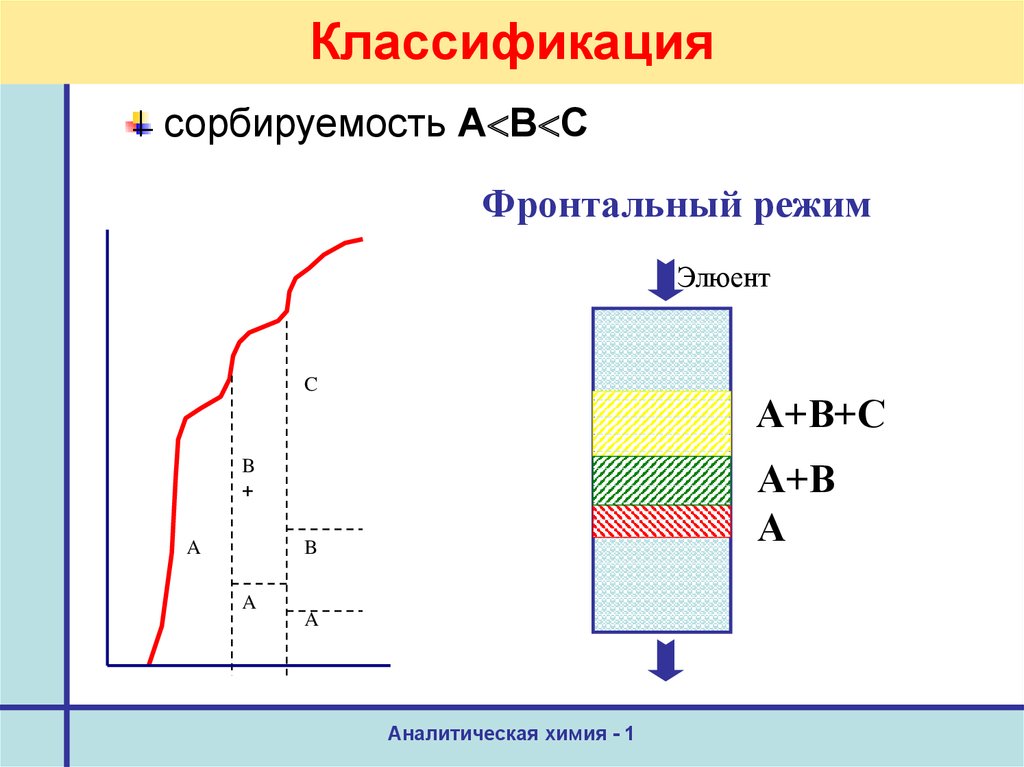
11. Классификация
сорбируемость А В СФронтальный режим
Элюент
C
А+В+С
А+В
А
B
+
A
B
A
A
Аналитическая химия - 1
12. Классификация
По природе процесса, обусловливающегораспределение сорбатов между ПФ и НФ:
Адсорбционная - разделение основано на различии в
адсорбируемости компонентов смеси на данном
адсорбенте
Распределительная - ─ // ─ в растворимости сорбатов в
ПФ и НФ или на различии в стабильности образующихся
комплексов
Ионообменная - ─ // ─ констант ионообменного
равновесия
Осадочная - ─ // ─ в растворимости осадков в ПФ
Эксклюзионная - ─ // ─ в проницаемости молекул
разделяемых веществ в НФ и обусловлено размерами этих
молекул
Аффинная - разделение основано на биоспецифическом
взаимодействии компонентов с аффинным лигандом
Аналитическая химия - 1
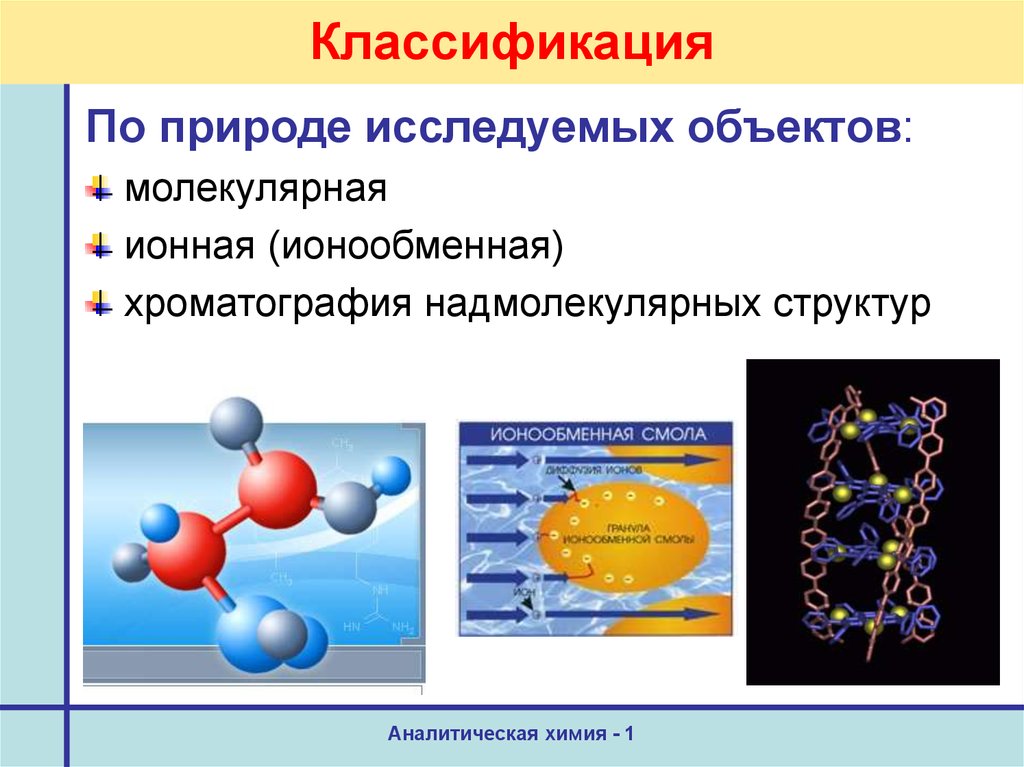
13. Классификация
По природе исследуемых объектов:молекулярная
ионная (ионообменная)
хроматография надмолекулярных структур
Аналитическая химия - 1
14. Классификация
По технике выполнения:-
-
колоночная
препаративная
насадочная
капиллярная
плоскостная
бумажная
тонкослойная
Аналитическая химия - 1
15. Классификация
По цели хроматографирования:аналитическая - качественный и
количественный анализ
неаналитическая - исследование
физико-химических характеристик
веществ на основании
хроматографических параметров удерживания
препаративная - для получения особо чистых веществ,
для выделения и концентрирования
микропримесей
промышленная - для автоматического
контроля и управления
производственным процессом
Аналитическая химия - 1
16. Классификация
По агрегатному состоянию ПФ и НФХроматографический процесс
ПФ
НФ
газ
газ
твердый адсорбент
жидкость на инертном
носителе
жидкость
жидкость
жидкость
твердый адсорбент
жидкость
гель
сжатый
газ
твердый адсорбент
Газовая хроматография
- газо-адсорбционная
- газо-жидкостная
Жидкостная хроматография
- жидкостно-адсорбционная
- жидкостно-жидкостная
- жидкостно-гелевая
Флюидная хроматография
Аналитическая химия - 1
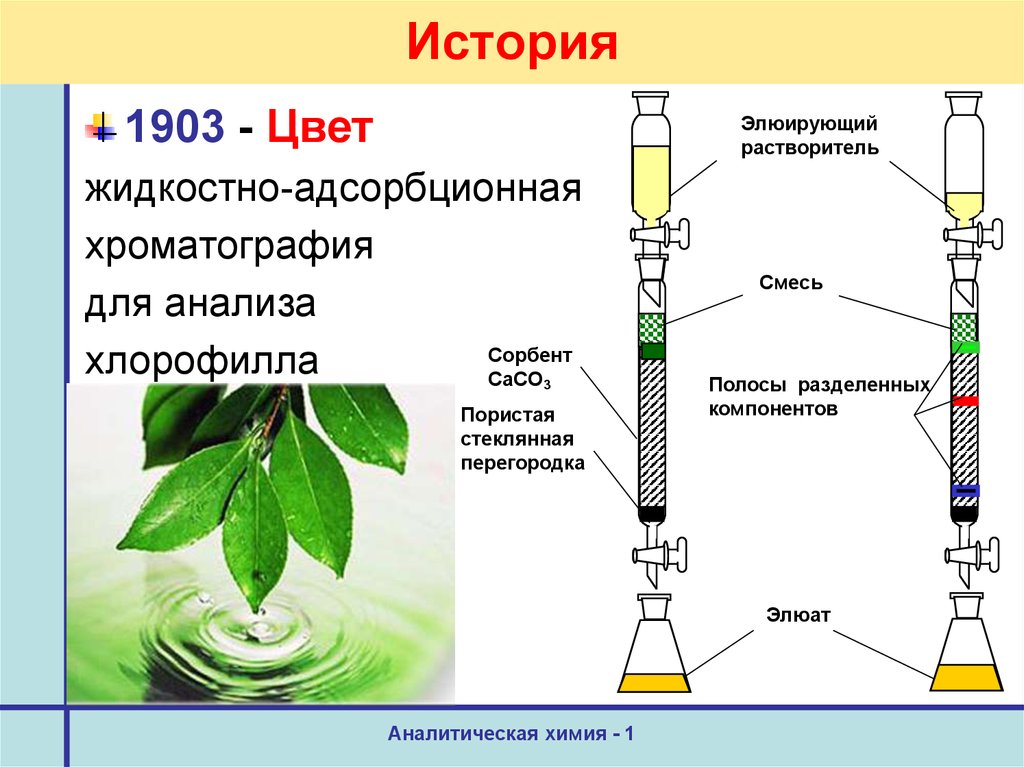
17. История
1903 - ЦветЭлюирующий
растворитель
жидкостно-адсорбционная
хроматография
для анализа
Сорбент
хлорофилла
CaCO
3
Пористая
стеклянная
перегородка
Смесь
Полосы разделенных
компонентов
Элюат
Аналитическая химия - 1
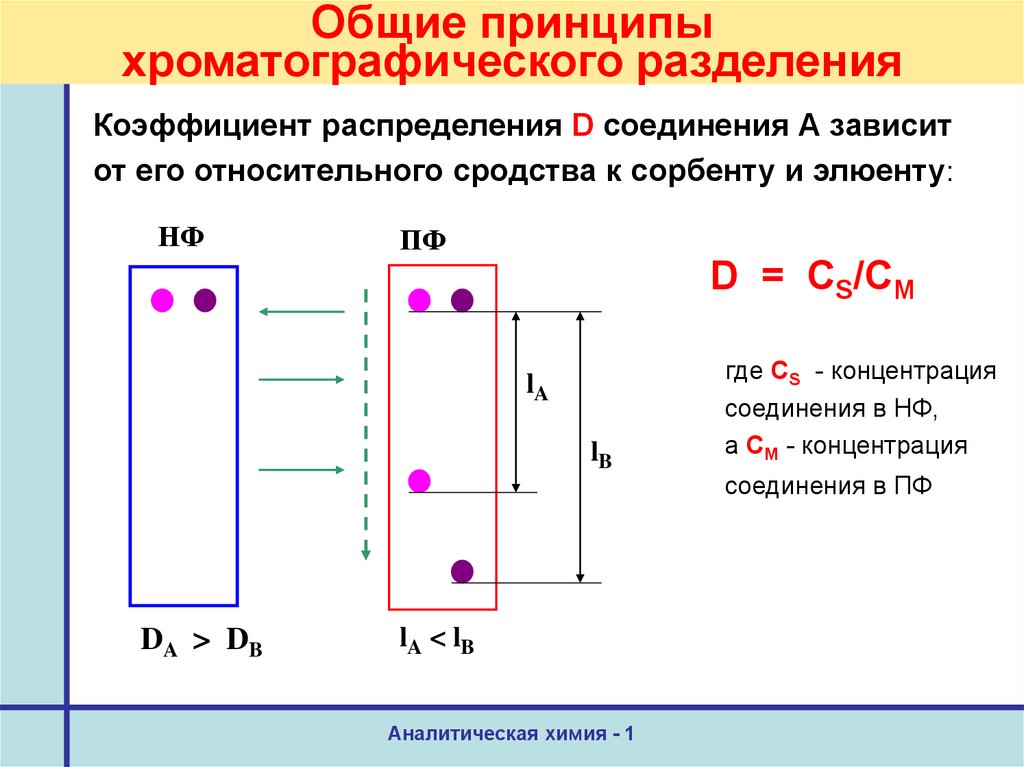
18. Общие принципы хроматографического разделения
Коэффициент распределения D соединения А зависитот его относительного сродства к сорбенту и элюенту:
НФ
ПФ
D = CS/CМ
lA
lB
DA > DB
lA < lB
Аналитическая химия - 1
где CS - концентрация
соединения в НФ,
а CM - концентрация
соединения в ПФ
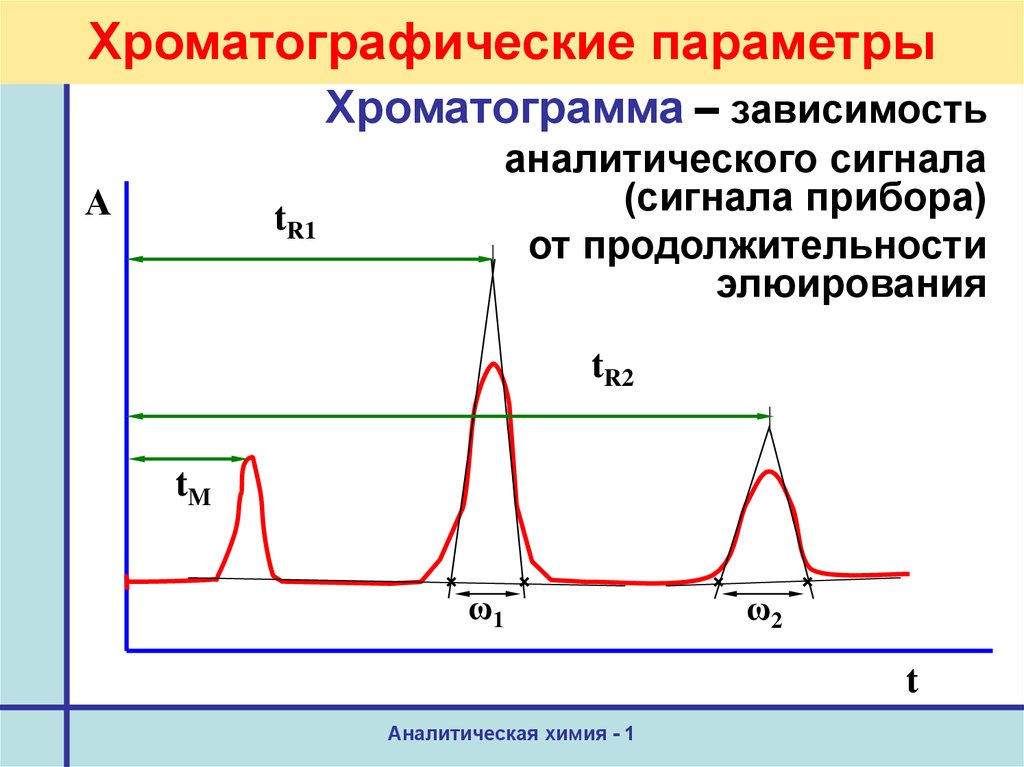
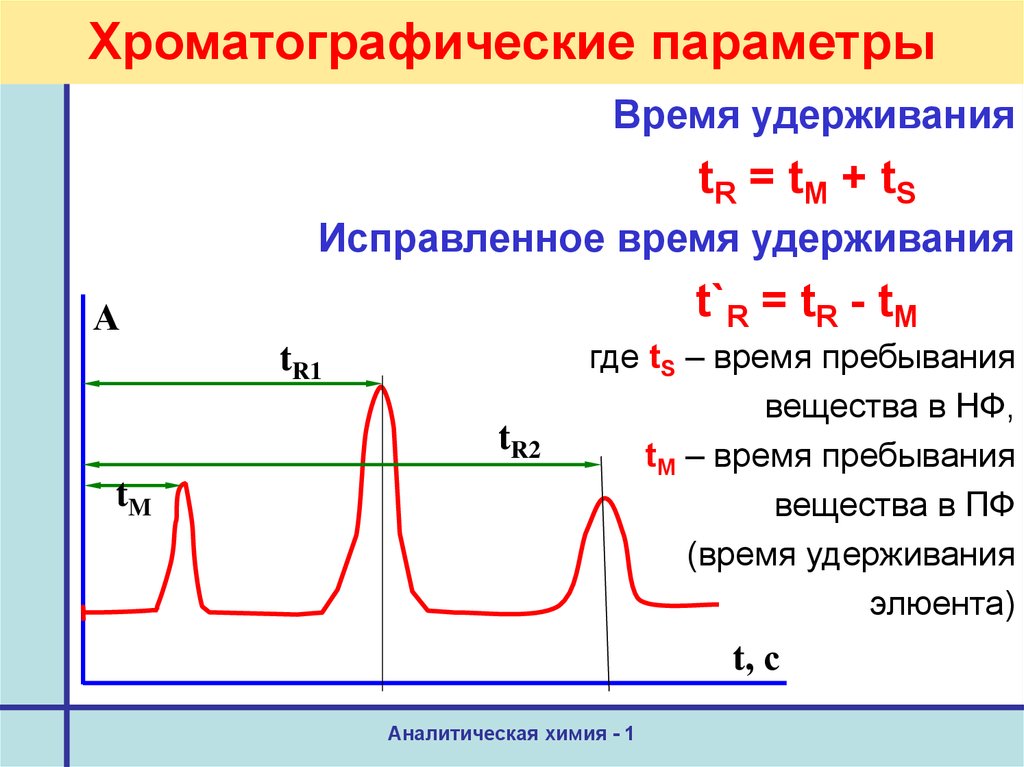
19. Хроматографические параметры
Хроматограмма – зависимостьА
аналитического сигнала
(сигнала прибора)
от продолжительности
элюирования
tR1
tR2
tM
ω1
ω2
t
Аналитическая химия - 1
20. Хроматографические параметры
Время удерживанияtR = tM + tS
Исправленное время удерживания
t`R = tR - tM
А
tR1
tR2
tM
где tS – время пребывания
вещества в НФ,
tM – время пребывания
вещества в ПФ
(время удерживания
элюента)
t, с
Аналитическая химия - 1
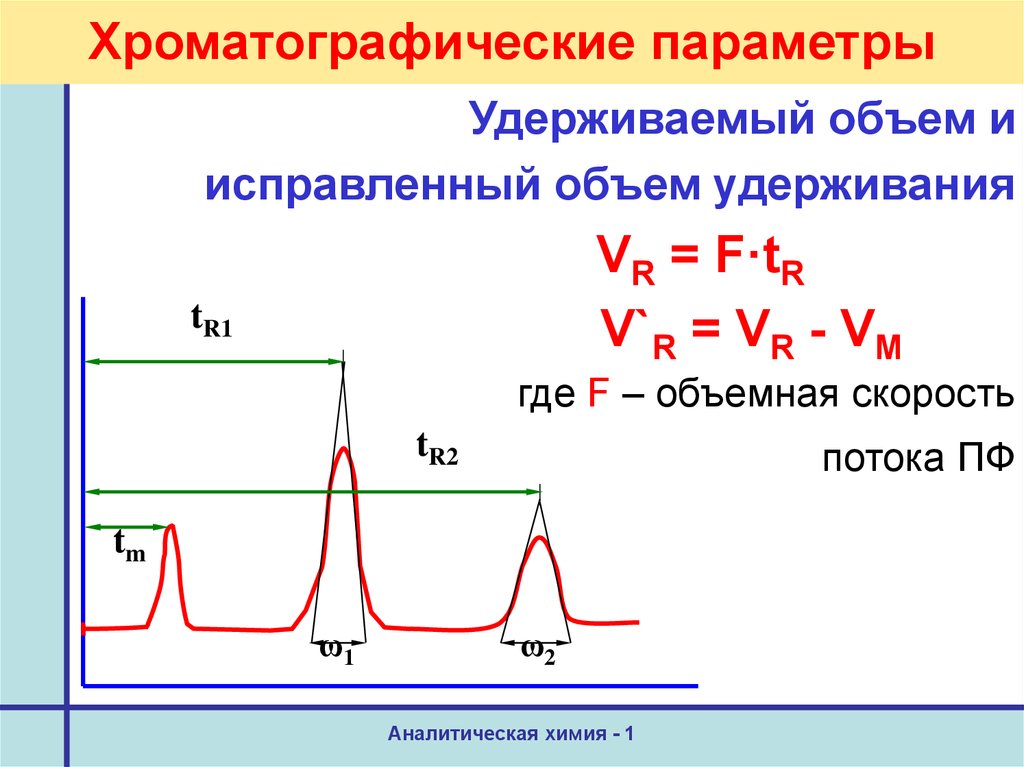
21. Хроматографические параметры
Удерживаемый объем иисправленный объем удерживания
VR = F·tR
V`R = VR - VМ
tR1
где F – объемная скорость
tR2
потока ПФ
tm
ω1
ω2
Аналитическая химия - 1
22. Хроматографические параметры
Коэффициент удерживания(замедления)
R = tM/tR = 1/(1+ tS/tM) =
1/(1+DVS/VМ) = VM/(VM + DVS)
Аналитическая химия - 1
23. Хроматографические параметры
Коэффициент ёмкостиk` = t`R/tM = DVS/VM
1.5 < k` < 4
Аналитическая химия - 1
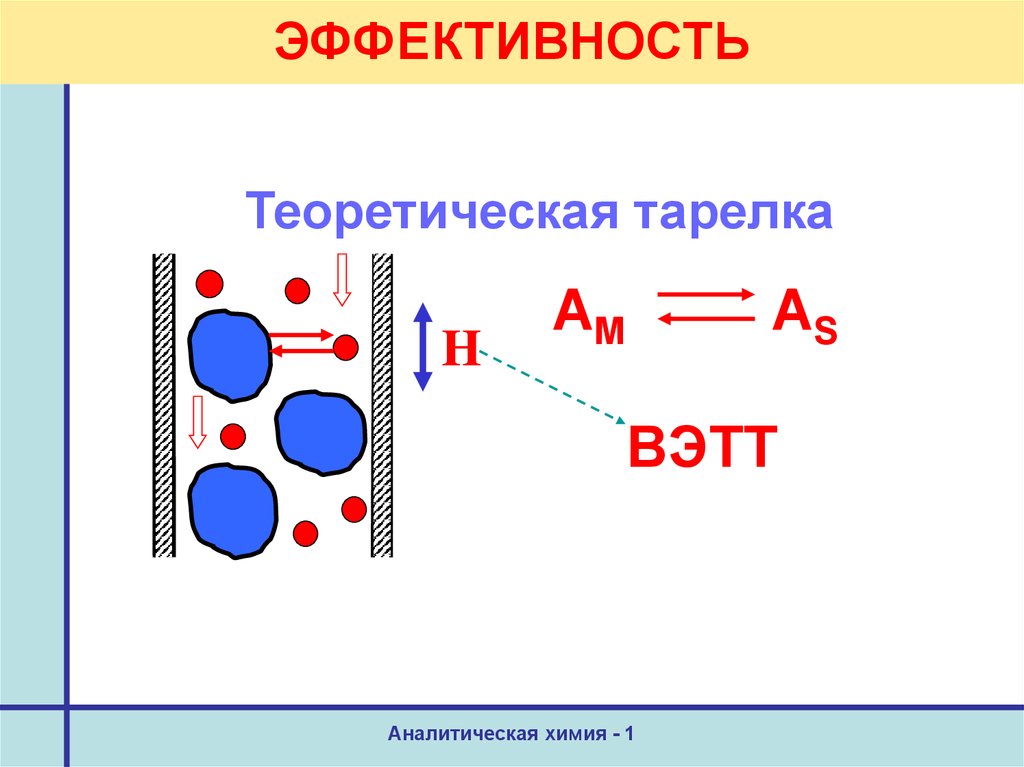
24. ЭФФЕКТИВНОСТЬ
Теоретическая тарелкаH
АM
AS
ВЭТТ
Аналитическая химия - 1
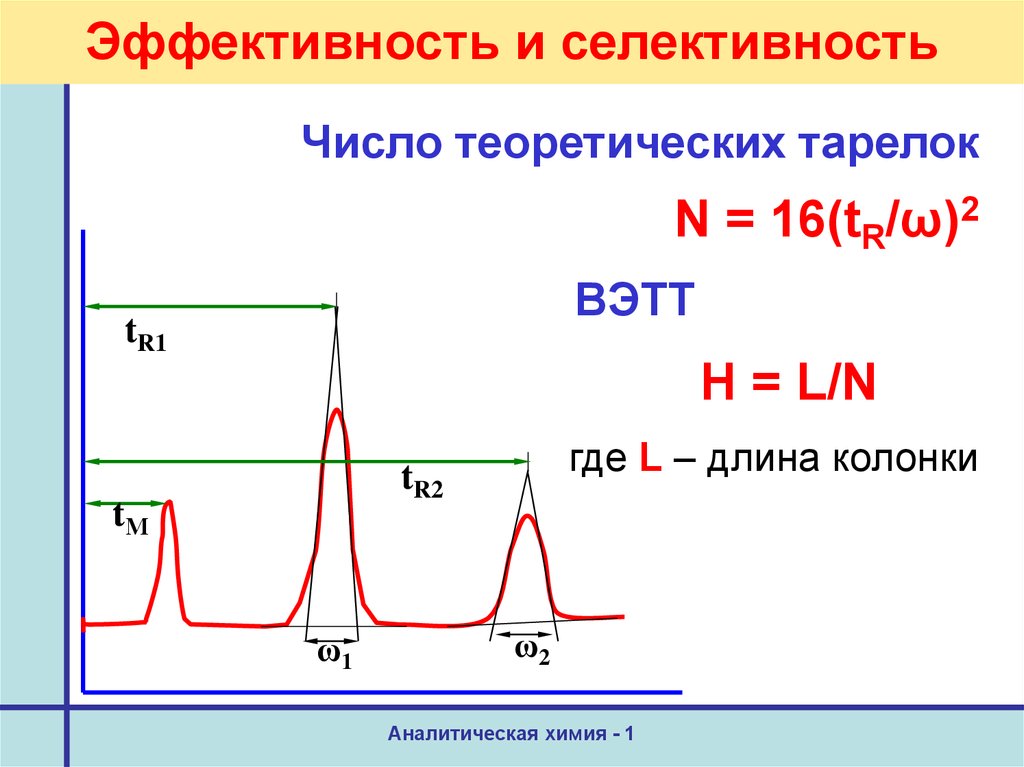
25. Эффективность и селективность
Число теоретических тарелокN = 16(tR/ω)2
ВЭТТ
tR1
Н = L/N
где L – длина колонки
tR2
tМ
ω1
ω2
Аналитическая химия - 1
26. Разделение пиков
РазрешениеRS = 2(tR2 – tR1)/(ω1 + ω2)
селективность
RS ≥ 1.5
размывание
Фактор разделения, или
коэффициент селективности
= kА/kB = t`R2/t`R1
Аналитическая химия - 1
27. Эффективность и селективность
Зависимость разрешения от коэффициентаёмкости, селективности и числа
теоретических тарелок:
RS = 0.25√N[(α – 1)/α][k'/(1 + k')]
Необходимое для разделения число
теоретических тарелок
N = 16RS2[(1 + k')/k']2[α/(α – 1)]2
Аналитическая химия - 1
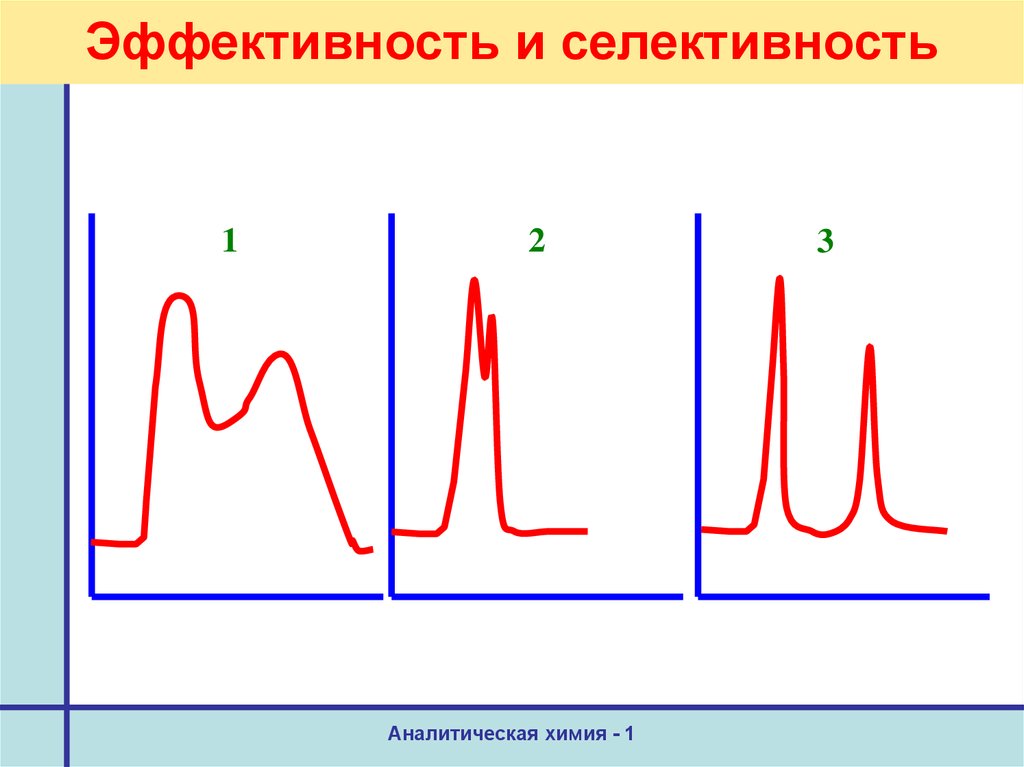
28. Эффективность и селективность
12
Аналитическая химия - 1
3
29. Качественный анализ
Времена удерживанияКорреляционные зависимости
параметров удерживания
- зависимость времени удерживания от
физико-химических характеристик
- зависимости времён удерживания на
колонках с разными НФ
- индекс удерживания Ковача
Аналитическая химия - 1
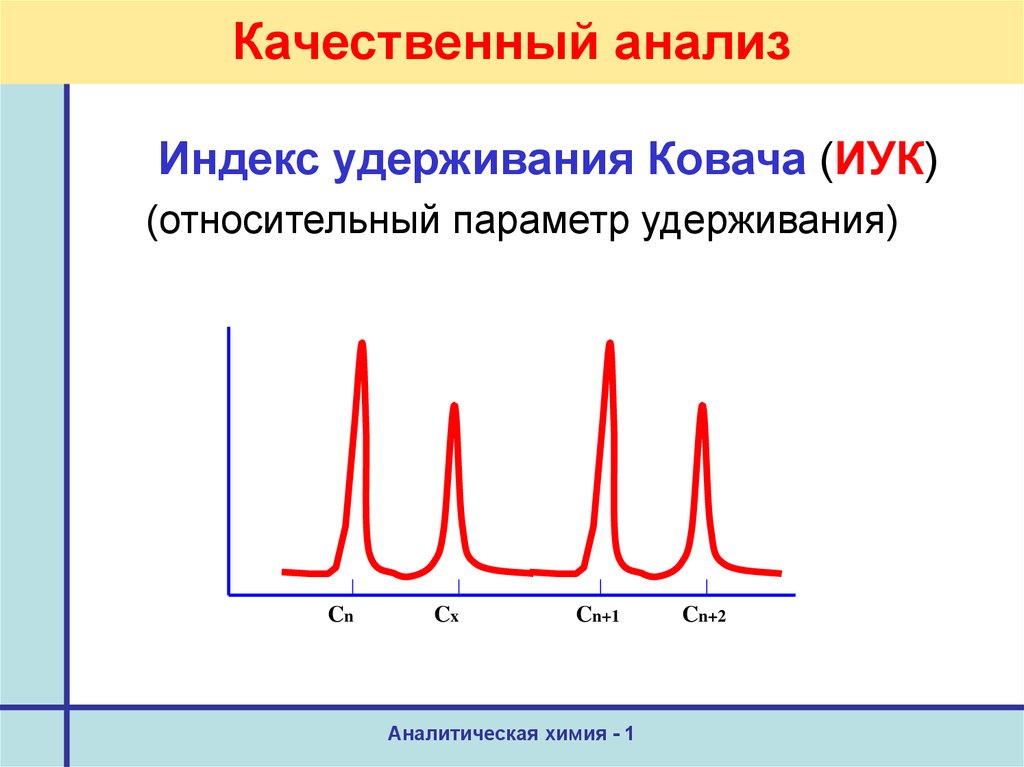
30. Качественный анализ
Индекс удерживания Ковача (ИУК)(относительный параметр удерживания)
Cn
Cx
Cn+1
Аналитическая химия - 1
Cn+2
31. Качественный анализ
Индекс удерживания Ковача (ИУК)In = 100n
t`Rn < t`Rx < t`R(n+1)
(lgt`Rx – lgt`Rn)
Ix = 100n + 100 ————————
(lgt`R(n+1) – lgt`Rn)
Аналитическая химия - 1
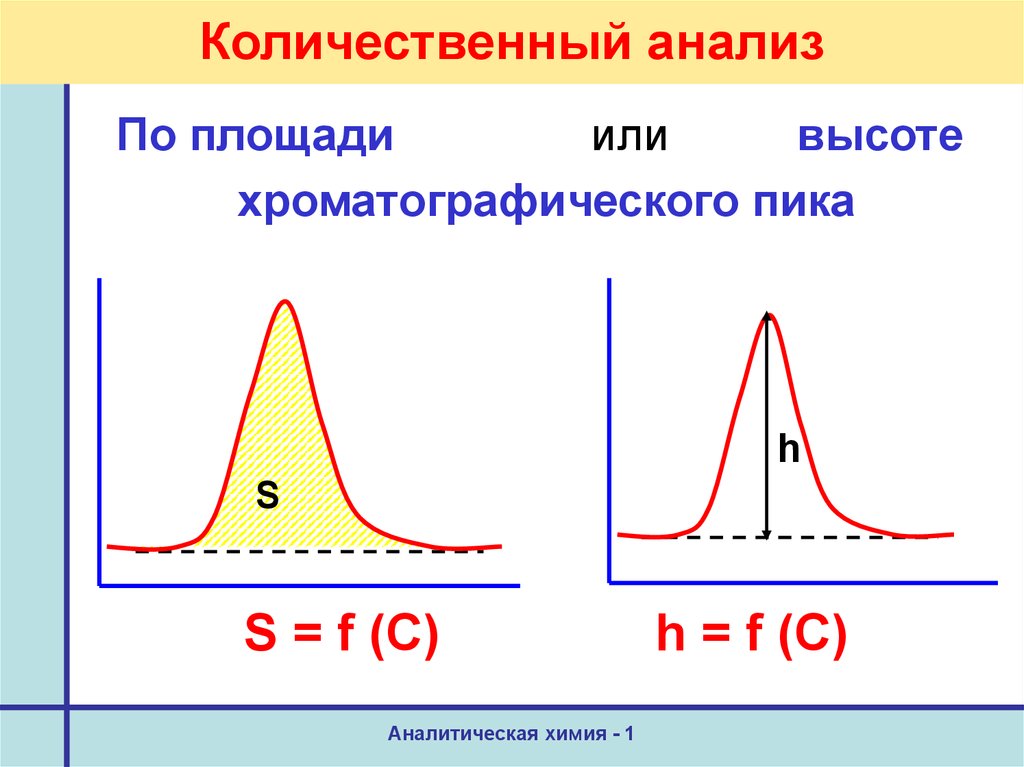
32. Количественный анализ
По площадиили
высоте
хроматографического пика
h
S
S = f (C)
Аналитическая химия - 1
h = f (C)
33. Количественный анализ
Методы количественногоанализа
Метод нормировки
Метод абсолютной калибровки
Метод внутреннего стандарта
Аналитическая химия - 1
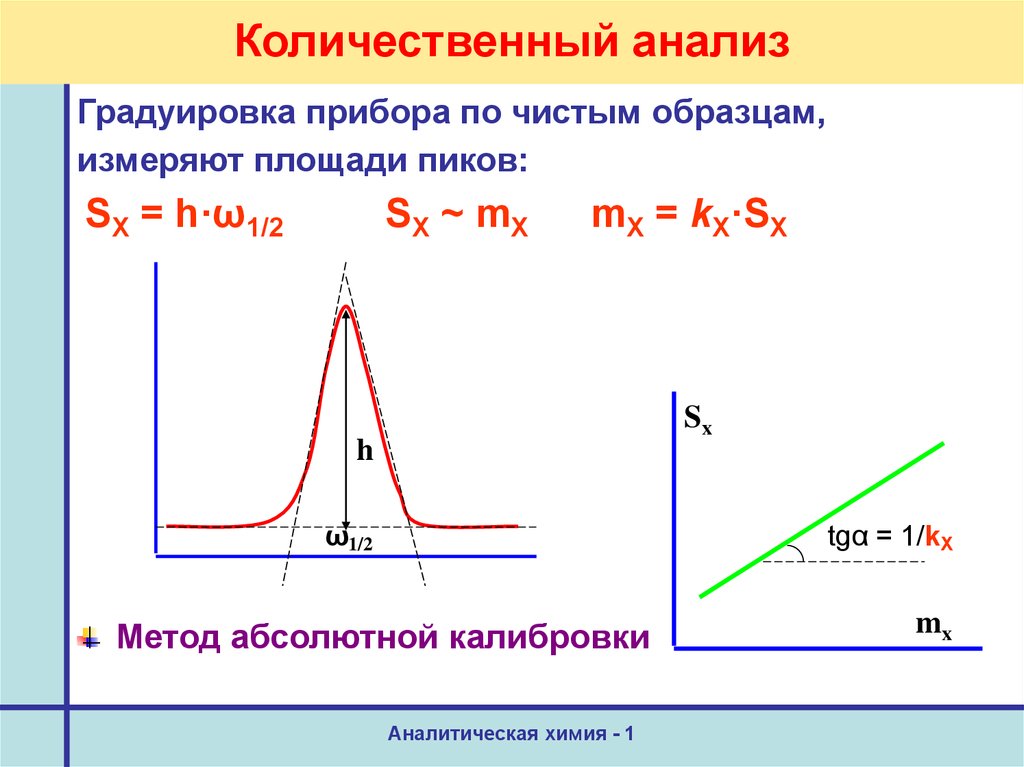
34. Количественный анализ
Градуировка прибора по чистым образцам,измеряют площади пиков:
SX = h·ω1/2
SX ~ mX
mX = kX·SX
Sx
h
ω1/2
tgα = 1/kX
Метод абсолютной калибровки
Аналитическая химия - 1
mx
35. Количественный анализ
Метод внутренней нормализации (нормировки)Х% = 100·SX/ST
Метод внутреннего стандарта.
mX = kX·SX
mМ = kМ·SМ
mX/mM = KX·SX/SM, KX = kX/kМ
mX = mM·KX·SX/SM
Аналитическая химия - 1
36. Теории хроматографии. Сорбция.
Физическая адсорбция.Происходит за счет
- сил Ван-дер-Ваальса,
- водородных связей,
- электростатических взаимодействий.
Характеризуется:
- большой скоростью,
- обратимостью,
- уменьшением количества поглощенного
адсорбата с повышением температуры.
Аналитическая химия - 1
37. Теории хроматографии. Сорбция.
Неполярный на неполярном – за счетдисперсионных сил притяжения и
отталкивания
Полярный на неполярном (и наоборот) – за
счет индукционных взаимодействий
Полярный на полярном – за счет
ориентационных диполь-дипольных
взаимодействий или водородного связывания
Аналитическая химия - 1
38. Теории хроматографии. Сорбция.
Сорбционные свойства сорбентазависят от:
- удельной поверхности,
- пористости,
- структуры пор,
- природы сорбента и среды, из
которой происходит сорбция
Аналитическая химия - 1
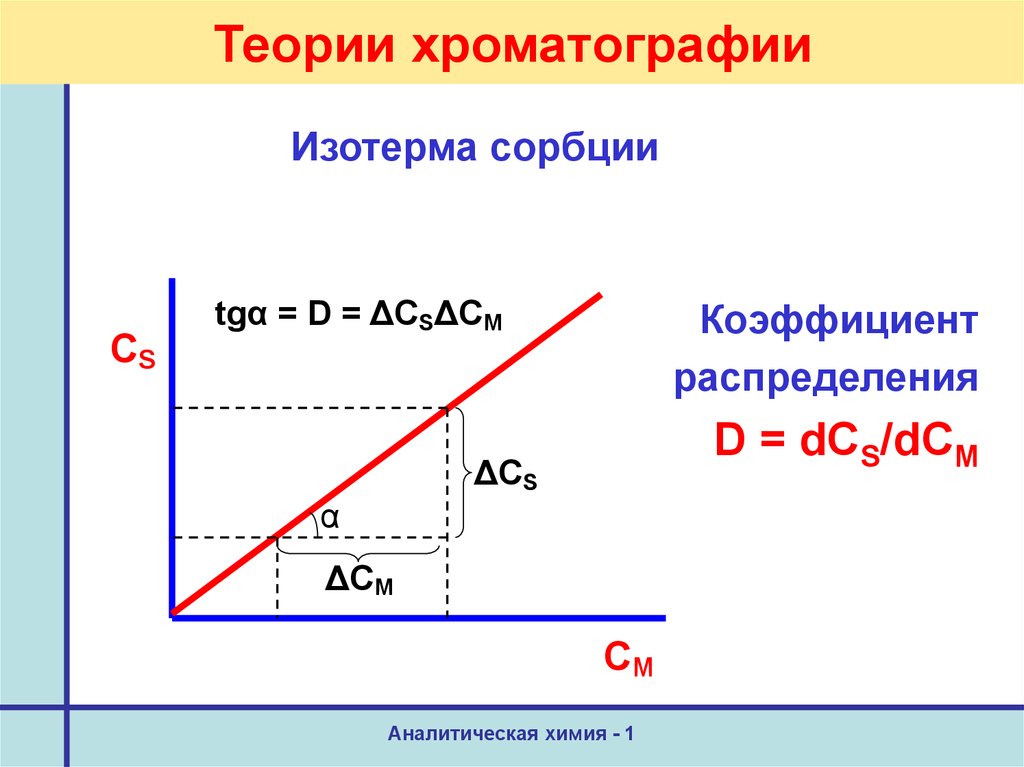
39. Теории хроматографии
Изотерма сорбцииCS
tgα = D = ΔCSΔCM
Коэффициент
распределения
D = dCS/dCM
ΔCS
α
ΔCM
CM
Аналитическая химия - 1
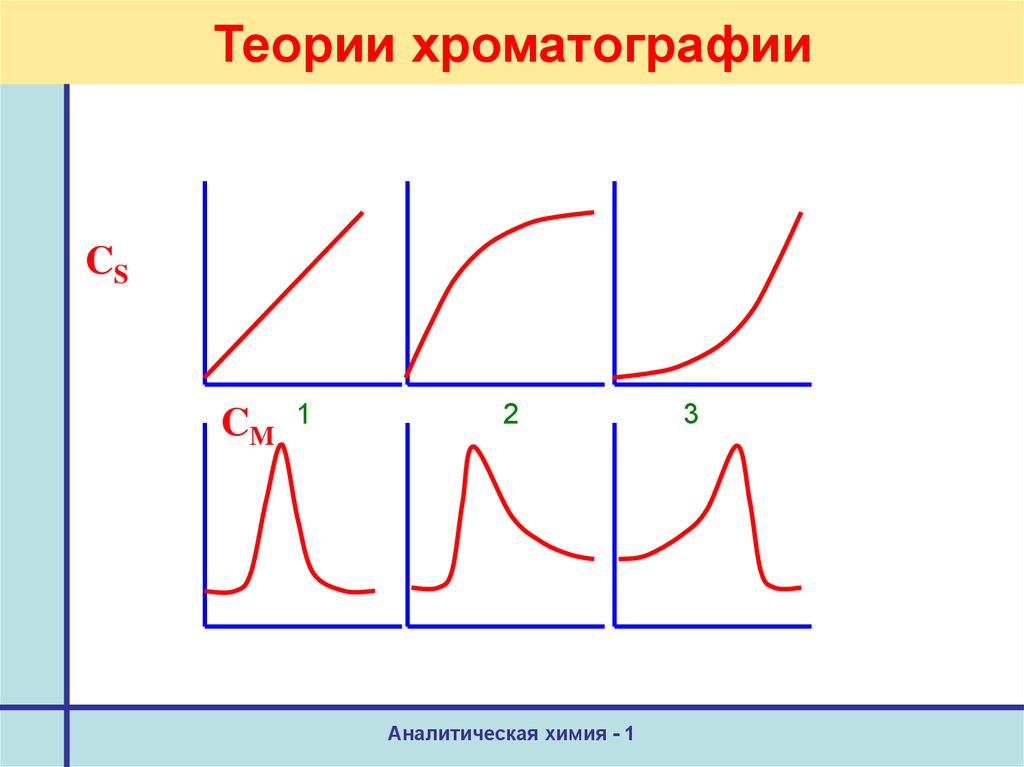
40. Теории хроматографии
CSCM
1
2
Аналитическая химия - 1
3
41. Теории хроматографии
ТЕОРИЯ ТЕОРЕТИЧЕСКИХ ТАРЕЛОК- колонка состоит из определенного числа ТТ
- равновесие на каждой ТТ считается
достигнутым до того, как ПФ переместится
на следующую ТТ (т.е. мгновенно)
- на каждой ТТ число сорбируемых частиц
веществ < числа сорбируемых частиц
элюента
- все процессы в колонке независимы друг от
друга
Аналитическая химия - 1
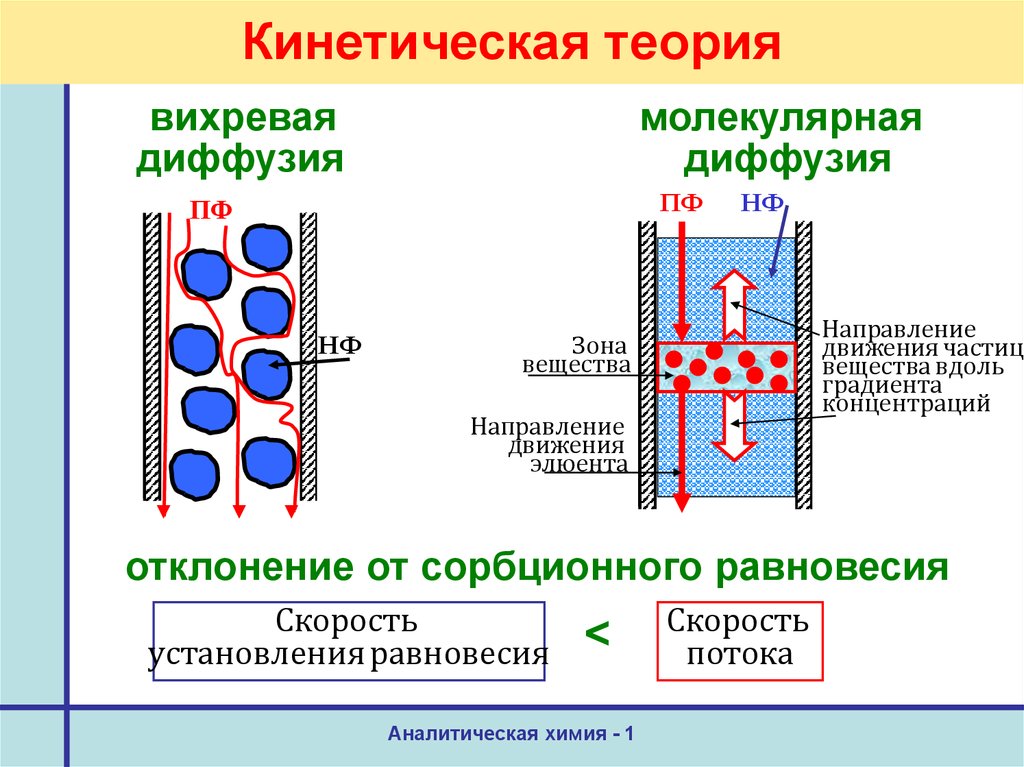
42. Теории хроматографии
Кинетическая теорияКинетические параметры:
- объемная скорость ПФ,
- диаметр частиц сорбента,
- геометрия частиц,
- коэффициент диффузии.
Аналитическая химия - 1
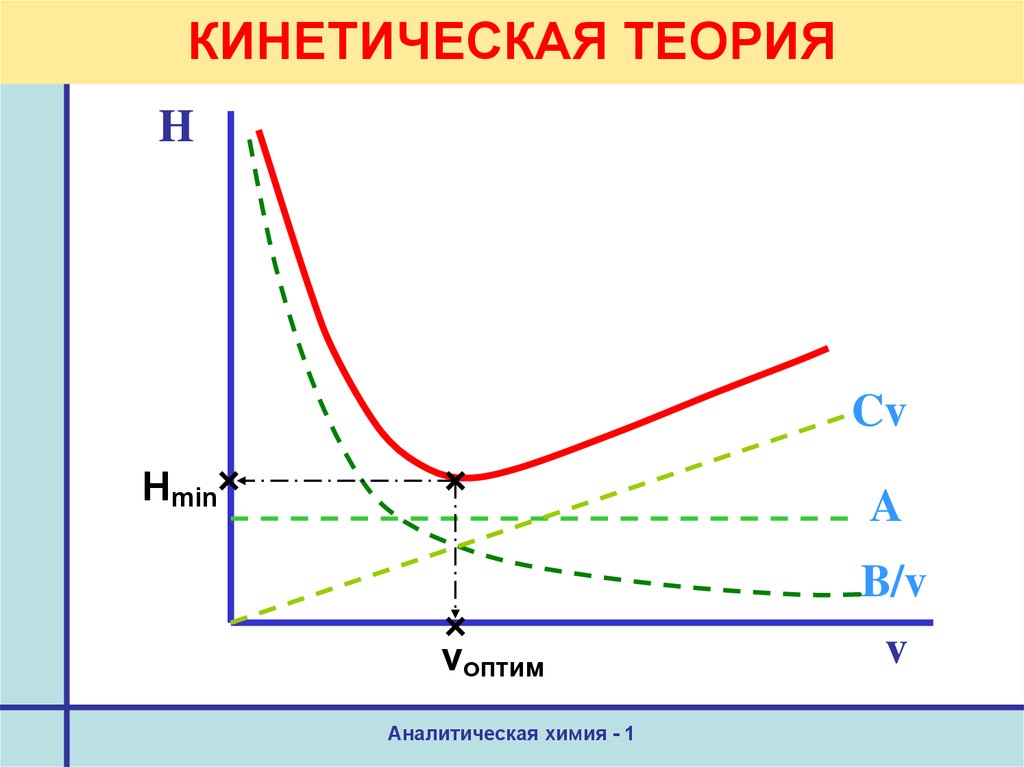
43.
Теории хроматографии. КинетическаяУравнение Ван-Деемтера
H = A + B/v + Cv
где А –вихревая диффузия,
B/v – молекулярная диффузия,
Cv – отклонение от сорбционного
равновесия (сопротивление
массопереносу),
v – скорость потока
Аналитическая химия - 1
44. Кинетическая теория
вихреваядиффузия
молекулярная
диффузия
ПФ
ПФ
НФ
НФ
Направление
движения частиц
вещества вдоль
градиента
концентраций
Зона
вещества
Направление
движения
элюента
отклонение от сорбционного равновесия
Скорость
установления равновесия
<
Аналитическая химия - 1
Скорость
потока
45. КИНЕТИЧЕСКАЯ ТЕОРИЯ
HCv
Нmin
A
vоптим
Аналитическая химия - 1
B/v
v

























 Физика
Физика








