Похожие презентации:
Кристаллические решетки. Химия. 8 класс
1.
Химия 8 класс2.
Цель презентации:Сформировать представления об
аморфных
и
кристаллических
веществах, типах кристаллических
решеток, установить взаимосвязь
между строением и свойствами
веществ, видами химической связи.
3.
Распределите веществана 2 группы
Шоколад
Стекло
Горный хрусталь
Сера
Алмаз
Жевательная резинка
Поваренная соль
Пластилин
4.
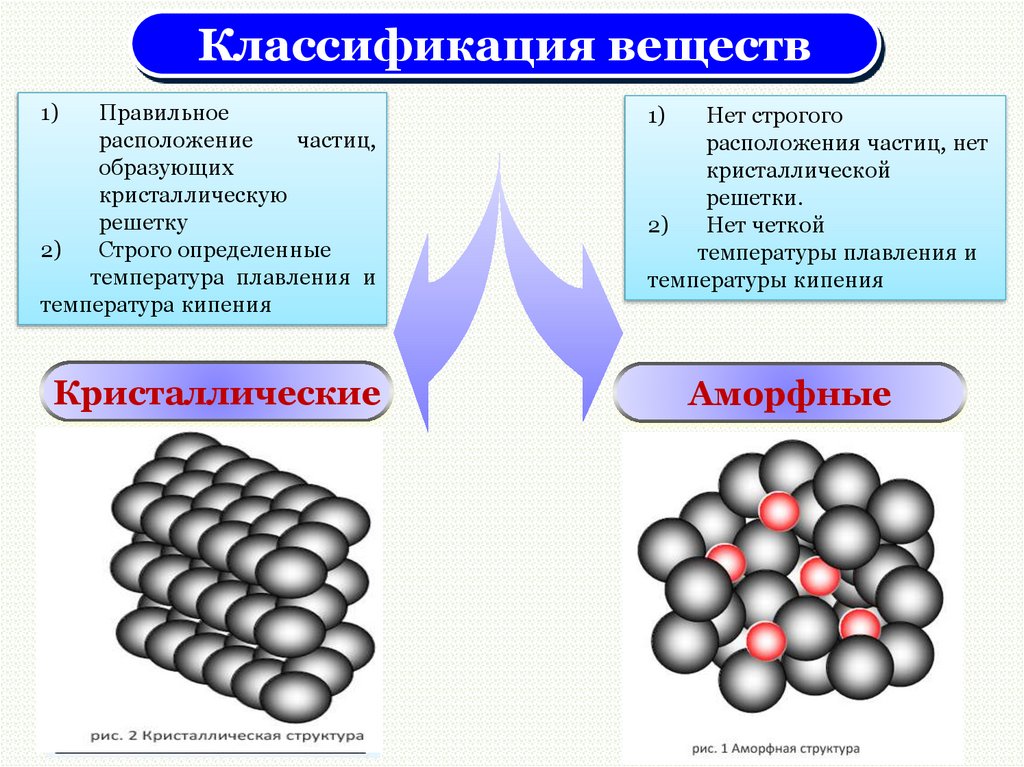
Классификация веществ1)
Правильное
Сера
расположение
частиц,
образующих
Алмаз
кристаллическую
решетку
Горный хрусталь
2)
Строго определенные
Поваренная
соль
температура
плавления
и
температура кипения
Кристаллические
1)
Нет строгого
Стекло
расположения
частиц, нет
кристаллической
Шоколад
решетки.
2) Пластилин
Нет четкой
температуры плавления и
Жевательная резинка
температуры
кипения
Аморфные
5.
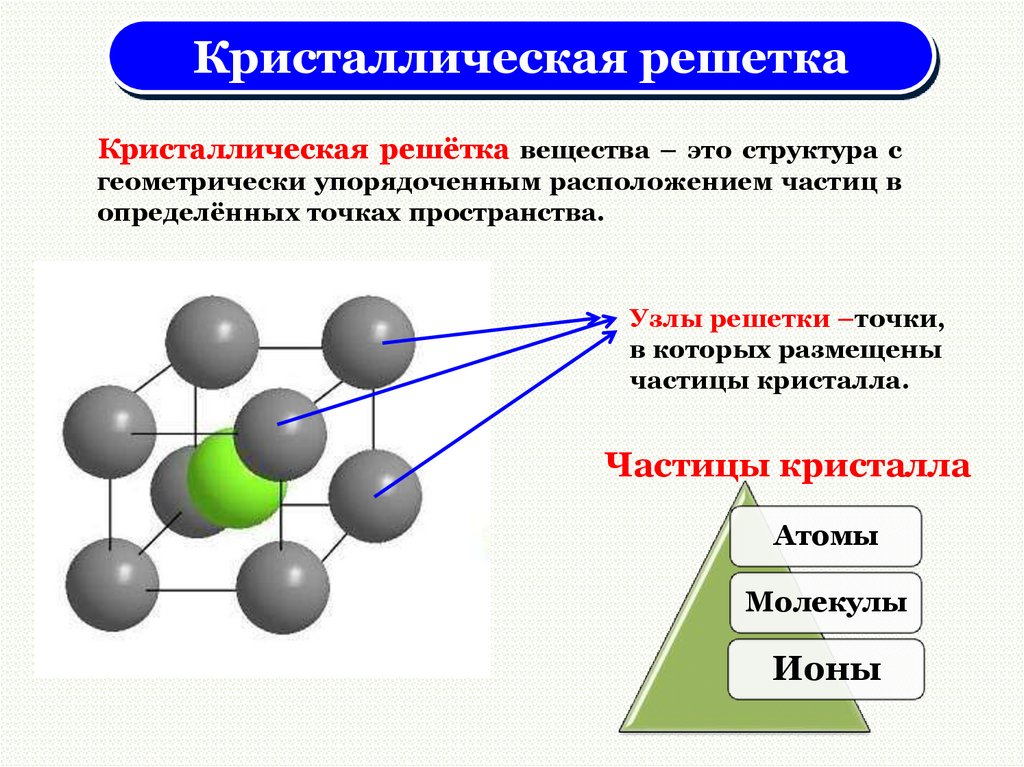
Кристаллическая решеткаКристаллическая решётка вещества – это структура с
геометрически упорядоченным расположением частиц в
определённых точках пространства.
Узлы решетки –точки,
в которых размещены
частицы кристалла.
Частицы кристалла
Атомы
Молекулы
Ионы
6.
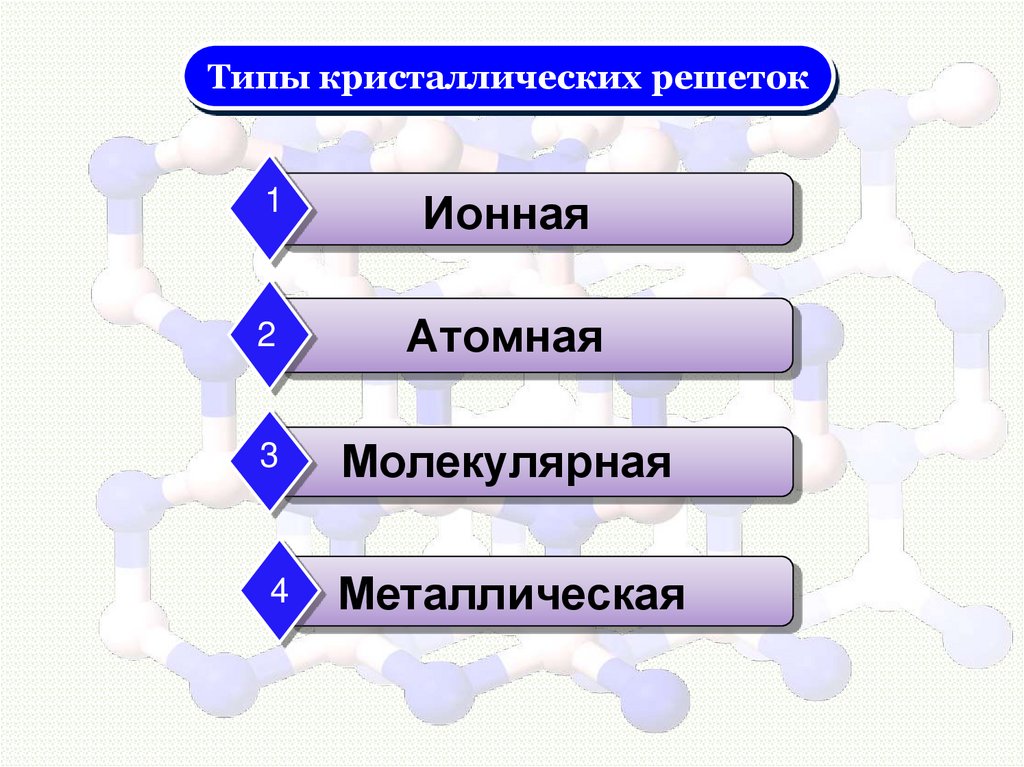
Типы кристаллических решеток1
Ионная
2
Атомная
3
Молекулярная
4
Металлическая
7.
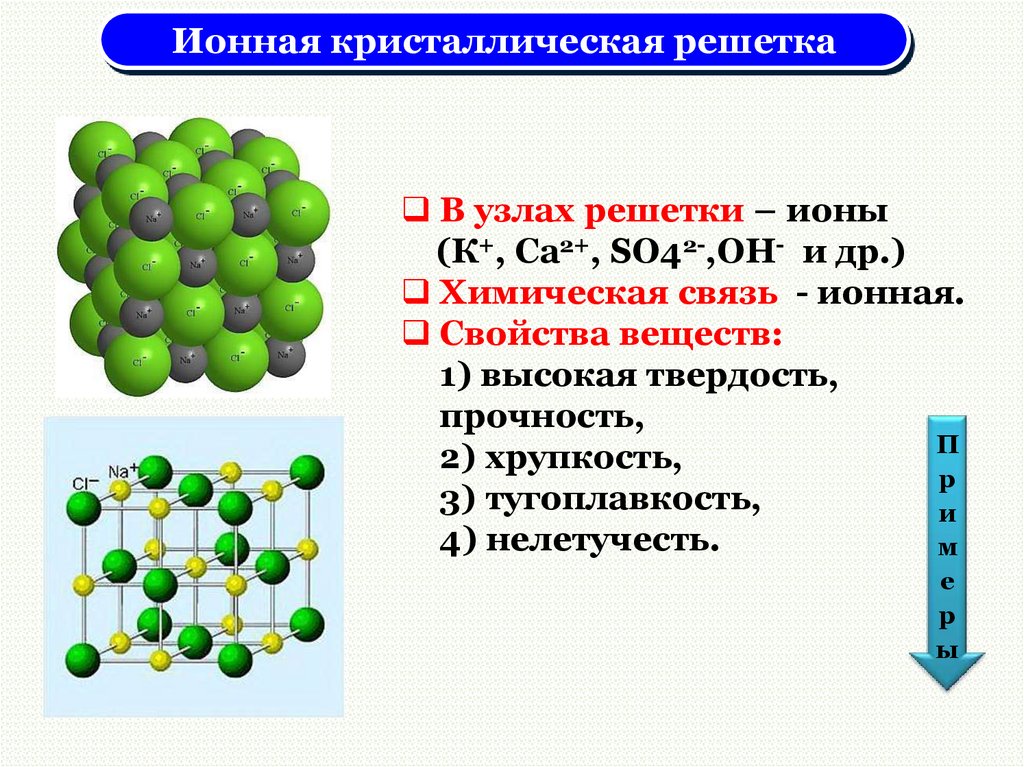
Ионная кристаллическая решеткаВ узлах решетки – ионы
(К+, Сa2+, SO42-,OH- и др.)
Химическая связь - ионная.
Свойства веществ:
1) высокая твердость,
прочность,
П
2) хрупкость,
р
3) тугоплавкость,
и
4) нелетучесть.
м
е
р
ы
8.
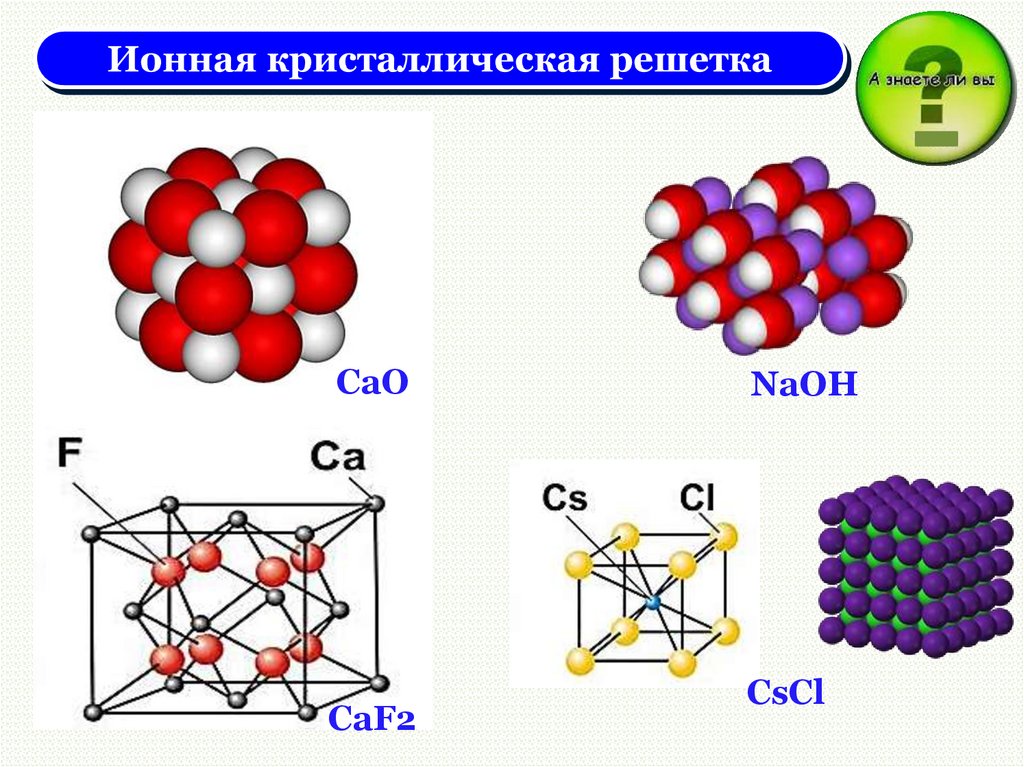
CaOCaF2
NaOH
CsCl
9.
Самые большие кристаллы• Пещера Куэва де лос Кристалес (Cueva de los
Cristales), в шахте Найка (Naica), расположенная
на юге мексиканского штата Чихуахуа на глубине
300
метров,
знаменита
поражающими
воображение гигантскими кристаллами. Это
нерукотворное чудо создала сама Природа.
Совершенные по форме и огромные по размерам,
эти
кристаллы
действительно
невероятно
прекрасны и пока единственные на планете.
Такие кристаллы весят по 50-60 тонн, и имеют
внушительные размеры до 12 метров в длину.
Кристаллы состоят из прозрачной разновидности
кристаллического гипса — селенита.
Фото
10.
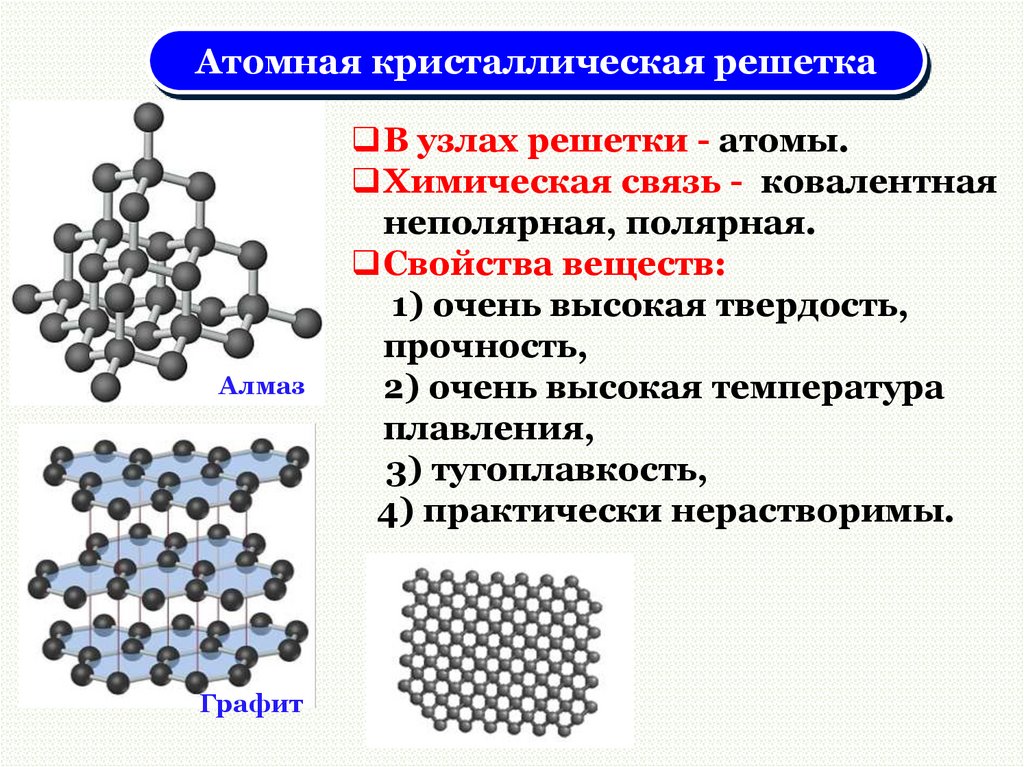
Атомная кристаллическая решеткаАлмаз
Графит
В узлах решетки - атомы.
Химическая связь - ковалентная
неполярная, полярная.
Свойства веществ:
1) очень высокая твердость,
прочность,
2) очень высокая температура
плавления,
3) тугоплавкость,
4) практически нерастворимы.
11.
Оксид кремния SiO2Бор B
Карбид кремния SiC
Кремний Si
12.
Самый большой алмазАлмаз «Куллинан» —
самый большой
природный алмаз.
(Южная Африка, 1905 г.,
вес-3106,75 каратов
(621,35 г.).
При огранке его
раскололи на 9 крупных
частей и порядка 100
мелких осколков.
«Куллинан I» или «Большая
Звезда Африки»
13.
Самый большой бриллиантЖелто-коричневый
бриллиант (Южная
Африка), под
названием «The
Golden Jubilee»
"Золотой Юбилей" .
Его вес составляет
545,67 карата
(109,13 г).
14.
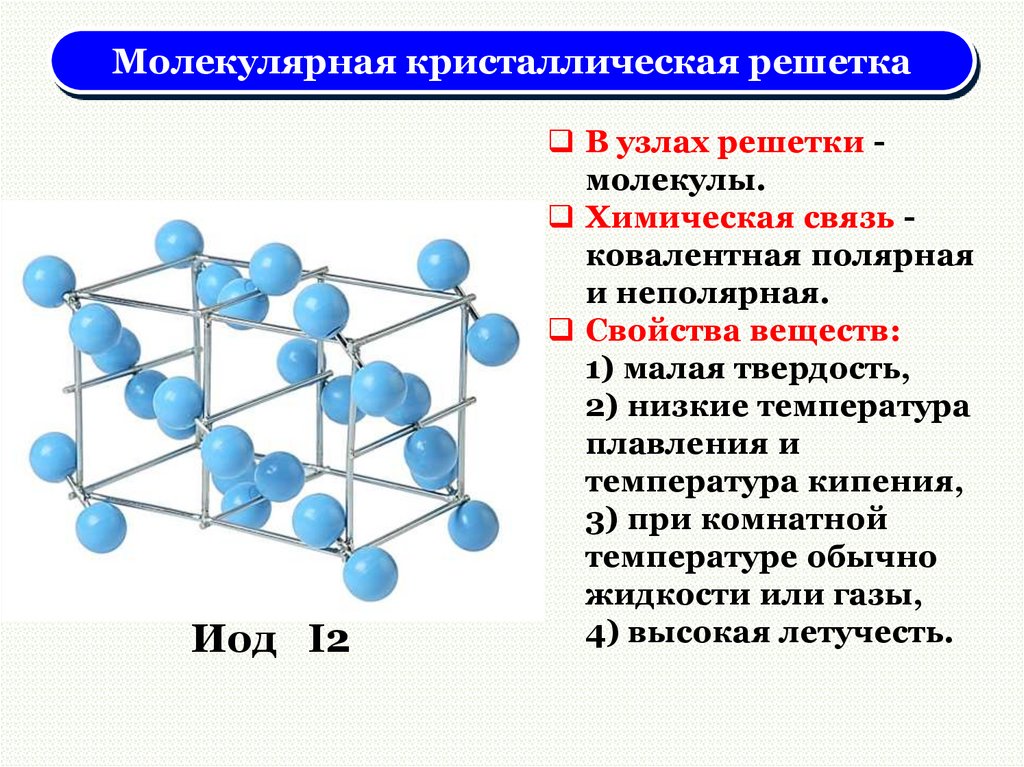
Молекулярная кристаллическая решеткаИод I2
В узлах решетки молекулы.
Химическая связь ковалентная полярная
и неполярная.
Свойства веществ:
1) малая твердость,
2) низкие температура
плавления и
температура кипения,
3) при комнатной
температуре обычно
жидкости или газы,
4) высокая летучесть.
15.
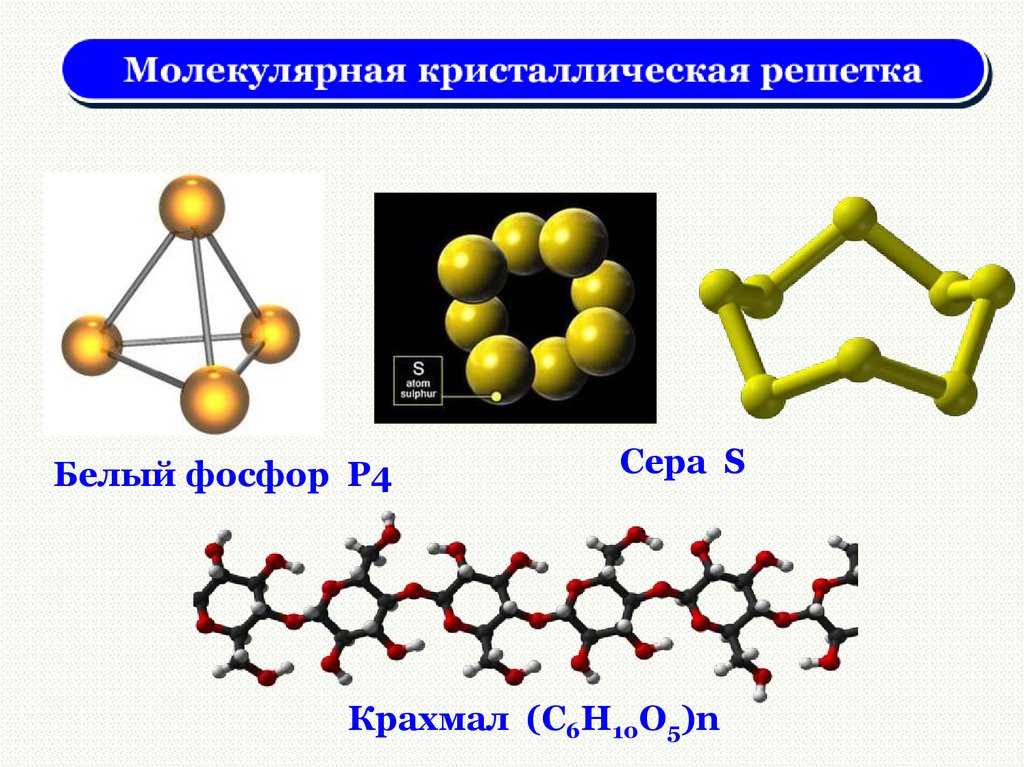
Белый фосфор P4Сера S
Крахмал (C6H10O5)n
16.
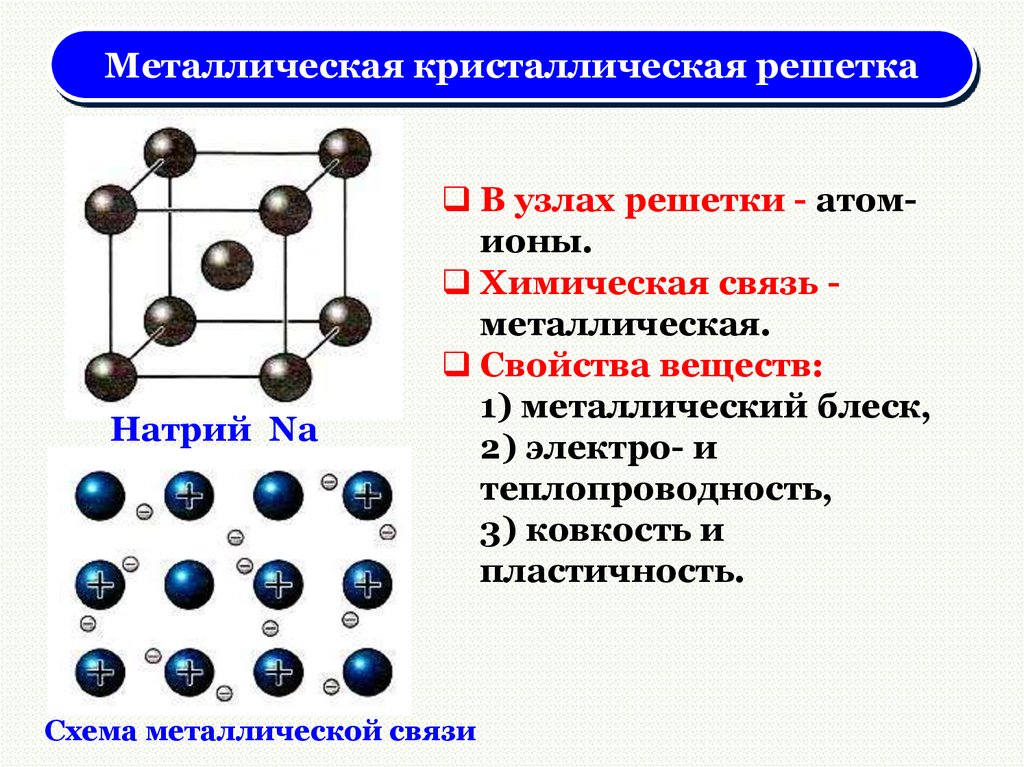
Металлическая кристаллическая решеткаНатрий Na
В узлах решетки - атомионы.
Химическая связь металлическая.
Свойства веществ:
1) металлический блеск,
2) электро- и
теплопроводность,
3) ковкость и
пластичность.
Схема металлической связи
17.
Типы металлических решетокКубическая
Объемно-центрированная
Fе, Cr, V, W
Гексагональная
Mg, Zn, Cd, Ti
Гранецентрированная
Fe, Al, Cu, Ni, Pb
18.
Закон постоянства состава веществМолекулярные химические
соединения независимо
от способа их получения
имеют постоянный
состав и свойства.
Например, состав воды в
атмосфере, Мировом
океане, ледниках и живых
организмах отражает
формула H2O.
Ж.Л. Пруст
1799-1803
19.
Алмаз ССахар С12Н22О11 Кварц SiO2
Шоколад
Аморфное
вещество
Атомная
Молекулярная
Ионная
Поваренная соль
Углекислый газ
NaCl
Атомная
Металлическая
Молекулярная
Лед Н2О
Медь Cu
20.
Тест Строение веществаИнструкция
1.Интерактивный тест включает в себя 10 вопросов.
2. Для начала работы перейдите к следующему слайду.
3.Выберите 1 правильный ответ из предложенных вариантов и
щелкните по нему.
4.При правильном ответе появляется зелёный
,
при неправильном – красный
.
5.Для перехода к следующему вопросу используйте кнопку
6.По окончании работы подсчитайте количество набранных
баллов.
21.
7.Верны
ли следующие
следующие суждения
суждения
о веществах
веществах
с молекулярной
ковалентной
1.Верны
ли
о
с
6. Четырёххлористый
углерод
плавится
при
комнатной
3.Вещество
светло-серого
цвета,
пластично,
хорошо
полярной
связью?
кристаллической
решёткой?
0
2)
Понятие
«молекула»
неприменимо
по
отношению
к
температуре,
акристаллической
поваренная соль
- при 800
С. Причина
такого
A.
В
узлах
решётки
находятся
атомы.
A.
Эти
вещества
тугоплавкие.
проводит
тепло
и
электрический
ток.
Его
8.
10.
Наибольшую
Вещества
с
температуру
металлическими
плавления
решётками
имеет
9. Наименьшую
4.том
Молекулярное
температуру
строение
плавления
имеет
имеет
5. в
Немолекулярное
строение
имеет
различия
, чтовещества
кристаллическая
решётка
у этихсвязью
веществ
структурной
единице
вещества:
B.
с высокой
ковалентной
полярной
B.Как
Этиправило,
вещества
обладают
электропроводностью.
кристаллическая
решётка
соответственно
тугоплавки.
Тест
Подсчитайте количество
1)
Хлороформа
Металлическая
Хлорид
Углекислый
калия
газ
1)
Ионная
и
атомная
Верно
1)
Серная
H2Oтолько
кислота
АА
1)1)
Хорошие
проводники
1)
Верно
только
правильных
ответов
электрического тока
Кислорода
Атомная
Йод
Кислород
2)
2)Верно
Молекулярная
2)
Хлорид
только
калия
ББи ионная
2)Графит
2)2)
Верно
только
2) Обладают низкими Т пл.
0 - 5 баллов – оценка «2»
3)
Азот
Сера
3)
3)Оба
Атомная
3)
Оба
Алмаза
Ионная
Гидроксид
Водород
суждения
суждения
и молекулярная
калия
верны
верны
3) Хорошо
растворяются
воде
6 - 7 баллов
– оценка в«3»
4)
4)8
Ионная
Оба
4)
Оба
Молекулярная
Озона
Графит
Железо
суждения
суждения
и молекулярная
неверны
неверны
4)
HCl
Алмаз
-9
баллов
– оценка
«4»
4) Летучие
10 баллов – оценка «5»










 Химия
Химия