Похожие презентации:
Соединения водорода
1.
Соединения водородаI. Вода
1. Нахождение в природе
2. Строение молекулы. Физические свойства
II. Пероксидсвойства
водорода
3. Химические
2.
ВОДАНахождение в природе
Вода в природе представлена в первую очередь гидросферой, 96%
которой составляет Мировой океан, покрывающий ¾ поверхности
земного шара. На долю пресной воды приходится только 2,6% от общего
содержания ее на планете. Большая часть пресной воды сосредоточена в
виде льда Северного и Южного полюсов и недоступна для потребления.
Доля жидкой пресной воды, доступной к применению, равна 0,014% от
общих запасов.
3.
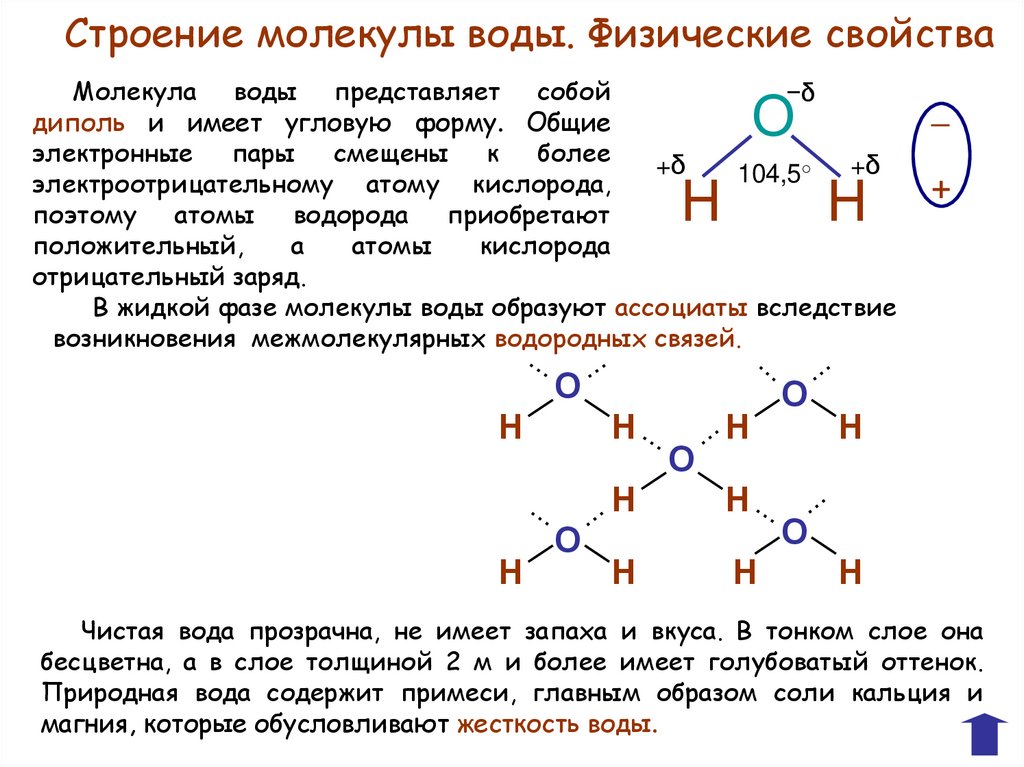
Строение молекулы воды. Физические свойстваМолекула воды представляет собой
−δ
диполь и имеет угловую форму. Общие
электронные пары смещены к более
+δ
+δ
104,5°
электроотрицательному атому кислорода,
поэтому атомы водорода приобретают
положительный,
а
атомы
кислорода
отрицательный заряд.
В жидкой фазе молекулы воды образуют ассоциаты вследствие
возникновения межмолекулярных водородных связей.
О
Н
Н
О
Н
Н
Н
О
О
Н
Н
Н
Н
Н
О
─
+
Н
О
Н
Чистая вода прозрачна, не имеет запаха и вкуса. В тонком слое она
бесцветна, а в слое толщиной 2 м и более имеет голубоватый оттенок.
Природная вода содержит примеси, главным образом соли кальция и
магния, которые обусловливают жесткость воды.
4.
Химические свойства водыДля воды характеры как окислительно-восстановительные свойства, так и
реакции, протекающие без изменения степеней окисления водорода и
кислорода.
Взаимодействие с металлами
Щелочные металлы взаимодействуют с водой при обычных условиях
с образованием щелочи и водорода.
Скорость реакции возрастает от лития к калию.
Составьте уравнения реакций.
Рассмотрите с т. зр. ОВР.
2Li0 + 2H+2O = 2Li+OH + H20 2Na0 +2H+2O =2Na+OH +H20 2K0 + 2H+2O = 2K+OH + H20
K0 ─ 1e → K+ 1 2
Li0 ─ 1e → Li+ 1 2
Na0 ─ 1e → Na+ 1 2
2H+ + 2e → H20 2 1
2H+ + 2e → H20 2 1
2H+ + 2e → H20
2 1
K ─ восстановитель,
Li ─ восстановитель,
Na ─ восстановитель,
процесс окисления
процесс окисления
процесс окисления
H2O (за счет Н+) ─
H2O (за счет Н+) ─
H2O (за счет Н+) ─
окислитель, процесс
окислитель, процесс
окислитель, процесс
восстановления.
восстановления.
восстановления.
5.
Взаимодействие щелочных металлов сводой
6.
Взаимодействие воды с кальциемСоставьте уравнение реакции.
Рассмотрите с т.зр. ОВР.
Ca0 + 2H+2O = Ca+2(OH)2 + H20
Ca0 ─2e → Ca+2 2 1
2H+ + 2e → H20 2 1
Ca ─ восстановитель, пр. окисления
H2O (за счет H+) ─ окислитель,
пр. восстановления.
Алюминий вступает в реакцию с водой лишь при условии, что его
поверхность будет освобождена от оксидной пленки.
2Al + 6H2O = 2Al(OH)3 + 3H2
Остальные металлы, стоящие в электрохимическом ряду напряжений
до водорода, взаимодействуют с водой лишь при значительном нагревании
с образованием оксида металла и водорода:
Zn + H2O = ZnO + H2
3Fe + 4H2O = Fe3O4 + 4H2
Металлы стоящие в электрохимическом ряду после водорода с
водой не реагируют!!!
7.
Пероксид водородаПероксид водорода – это бесцветная жидкость, представляет собой, так
же как и вода, соединение водорода с кислородом
Н2О2
Определите степень окисления и валентность кислорода, водорода:
Н+1 ─ О−1 ─ О−1 ─ Н+1
Степень окисления кислорода −1,
валентность II
Степень окисления водорода +1,
валентность I
На свету и под действием катализаторов (MnO2) легко разлагается (при
нагревании - со взрывом):
2H2O2 = 2H2O + O2
В воде пероксид растворяется неограниченно, его водные растворы более
устойчивы. В виде таких растворов пероксиды поступают в продажу: аптечный
3%-ный раствор. Для других целей используют пергидроль – 30%-ный раствор
Н2О2.
Применяется пероксид водорода для отбеливания текстильных
материалов и бумаги, в парикмахерском деле, в медицине, как окислитель
в ракетном топливе, при получении глицерина.
8.
Получение пероксида водородаВ лаборатории для получения пероксида водорода используют
реакцию взаимодействия пероксида бария с соляной кислотой:
BaO2 + 2HCl(конц., хол.)= BaCl2 + H2O2
В промышленности пероксид водорода изначально получали
электролизом серной кислоты или раствора сульфата аммония в
серной кислоте. В результате этого процесса образуется надсерная
кислота H2S2O8 гидролиз которой приводит к образованию
пероксида и серной кислоты:
H2S2O8 + 2H2O → H2O2 + 2H2SO4
9.
ХИМИЧЕСКИЕ СВОЙСТВА ПЕРОКСИДА ВОДОРОДАа) Кислотно-основные свойства
Пероксид водорода проявляет слабые кислотные
(Kд=1.78⋅10−12) и диссоциирует по двум ступеням:
свойства
H2O2 ↔ H+ + OOHOOH- ↔ H+ + O22Пероксид водорода является чуть более сильной кислотой, чем вода.
б) Пероксиды проявляют сильные окислительные свойства (O−I →
O−2):
4H2O2 + PbS(т) = 4H2O + PbSO4↓
Na2O2(т) + 2H2SO4 + 2KI = 2H2O + I2↓ + Na2SO4 + K2SO4
в) восстановительные свойства (O−I → O0):
2H2O2 + Ca(ClO)2 = CaCl2 + 2H2O + 2O2↑
5Na2O2(т) + 8H2SO4 + 2KMnO4 = 5O2↑ + 8H2O + 2MnSO4 + 5Na2SO4 + K2SO4
10.
Тест1. Молекула водорода имеет:
А) ковалентную полярную связь;
В) ионную связь;
Б) ковалентную неполярную связь;
Г) водородную связь.
2. Водород образуется при действии:
А) раствора соляной кислоты на магний;
Б) раствора серной кислоты на медь;
В) раствора бромоводородной кислоты на ртуть;
Г) концентрированной серной кислоты на серебро.
3. Какие утверждения относятся к простому веществу водороду:
А) бинарные соединения водорода с металлами называются гидридами;
Б) водород входит в состав кислот;
В) водород не образует аллотропных модификаций;
Г) перед работой с водородом необходимо проверить его на чистоту.
4. Какое из приведенных утверждений верно:
А) водород имеет резкий запах;
В) водород тяжелее воздуха;
Б) водород хорошо растворим в воде;
Г) водород легче воздуха.
5. С какими веществами реагирует водород:
А) оксид серы (IV);
В) сероводород;
Б) оксид олова (II);
Г) серная кислота.
6. К гидридам относится вещество с молекулярной формулой:
А) Ca(OH)2;
Б) CaH2;
В) CaC2;
Г) CaO
7. В какой реакции образуется чистый металл:
А) CuО + Н2→
Б) CuO + O2 →
В) Cu + H2O→
Г) Cu + О2→
Б
А
Г
Г
Б
Б
А









 Химия
Химия








