Похожие презентации:
Коррозия и защита металлов. Электрохимическая коррозия. Тема 2.3. Часть 2
1. Коррозия и защита металлов
Электрохимическая коррозия2. План
1. Определение и условия появленияэлектрохимической коррозии.
2. Схема коррозии.Деполяризация.
3. Коррозия стали.
4. Методы защиты.
3. Электрохимическая коррозия
Электрохимическая коррозия - самопроизвольноенеобратимое разрушение металла в среде
электролита при работе короткозамкнутого
необратимого микро или макро ХИТ.
Условия ЭХ коррозии:
• Наличие разности потенциалов на металлической
конструкции .
• Контакт
металлической
конструкции
с
электролитом.
4. Схема электрохимической коррозии
анодный процесс переход ионов из металла с меньшим потенциалом в
раствор электролита.
катодный процесс проходит на поверхности металла с большим
потенциалом (катодного участка), заключается в присоединении избыточных
электронов деполяризатором (Д) - окислителем, присутствующим в данной
среде.
Катодный процесс называется ДЕПОЛЯРИЗАЦИЯ.
5.
1. Водородная деполяризацияпри рН 4:
2Н+ + 2 ē = Н2;
при рН от 4 до 7:
4Н+ + О2 + 4ē = 2Н2О.
2. Кислородная деполяризация
при рН 7: О2 + 2Н2О + 4ē = 4ОН .
6. Микроструктура углеродистой стали
Светлые участки кристаллы феррита ( Fe), темныеперлит: смесь феррита и цементита (Fe3C).
7.
Феррит|Деполяризатор, Н2О|ПерлитFe|O2; H2O|Fe3C
0(Fe) = 0,44B < 0 0,1B(Fe3С )
На аноде:Fe 2 ē = Fe2+
На катоде:Fe3С О2 + 2 Н2О + 4 ē = 4 ОН .
Bторичные процессы:
Fe2+ + 2 ОН = Fe(ОН)2,
4 Fe(ОН)2 + О2 + 2 Н2О = 4 Fe(ОН)3,
Fe(ОН)2 = FeО + Н2О,
2 Fe(ОН)3 = Fe2О3 + 3 Н2О,
хFeО + уFe2О3 + zН2О = (FeО)х . (Fe2О3)у . (Н2О)z
Ржавчина
8. Методы защиты от коррозии
Принцип защиты - прекращение или подавление работыкороткозамкнутых микро макро ХИТ.
Методы защиты:
1. Изолирование поверхности (применение покрытий:
металлических, неметаллических);
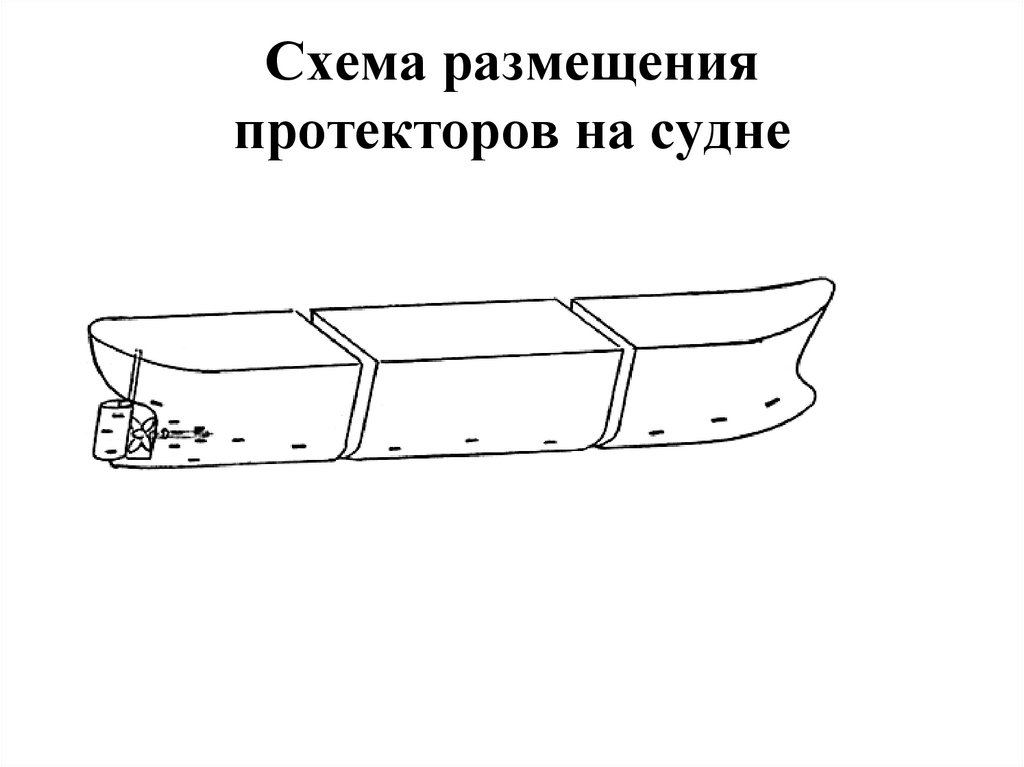
2. Электрохимическая защита: катодная, протекторная;
3. Подбор коррозионностойких в данной среде металлов и
сплавов (введение легирующих присадок в углеродистые
стали);
4. Ингибирование (ингибиторы вводятся в агрессивную
среду или наносятся на поверхность металла);
5. Разработка и применение новых конструкционных
решений, исключающих или замедляющих процессы
коррозии.
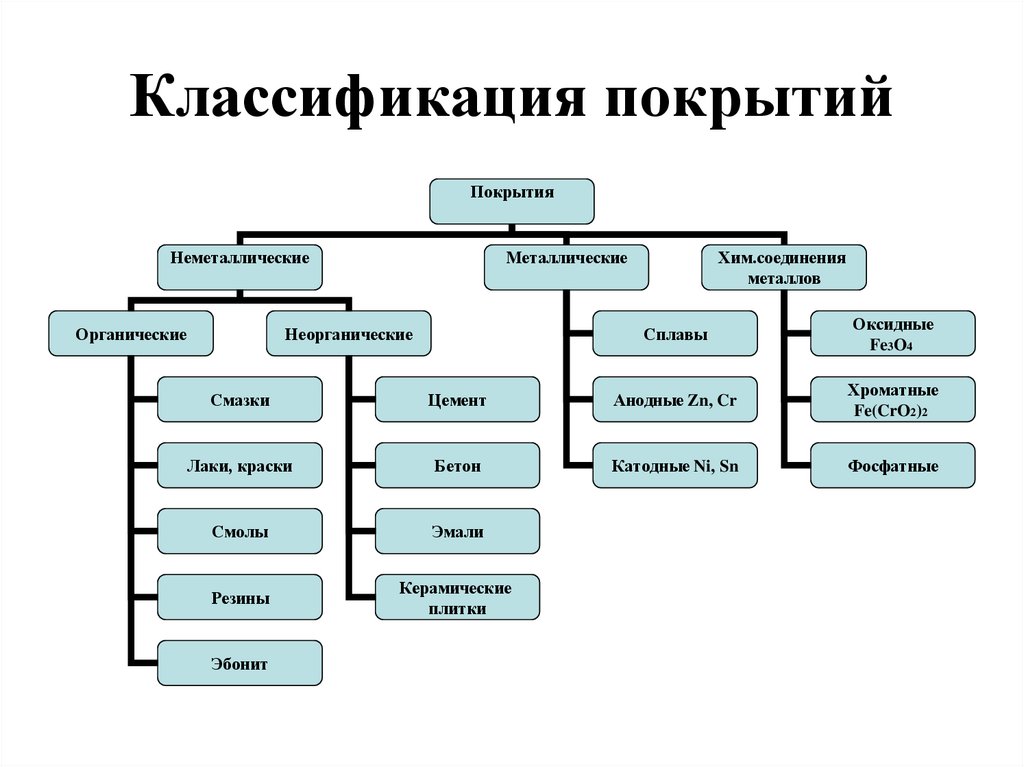
9. Классификация покрытий
ПокрытияНеметаллические
Органические
Металлические
Неорганические
Хим.соединения
металлов
Сплавы
Оксидные
Fe3O4
Смазки
Цемент
Анодные Zn, Cr
Хроматные
Fe(CrO2)2
Лаки, краски
Бетон
Катодные Ni, Sn
Фосфатные
Смолы
Эмали
Резины
Керамические
плитки
Эбонит











 Химия
Химия








