Похожие презентации:
Основания. Химические свойства оснований. Урок 9
1.
Основания. Химическиесвойства оснований.
Параграф 36
2.
Гидроксиды• Основание-сложное
вещество, которое состоит
из атомов металла и одной
или двух гидроксогрупп.
• Примеры
Cu(OH)2 гидроксид меди (II)
Mg(OH)2 гидроксид магния
NaOH гидроксид натрия
• Исключение (амфотерные)
Zn(OH)2 гидроксид цинка
Ве(OH)2 гидроксид бериллия
• Амфотерный гидроксид сложное вещество, которое
состоит из атомов металла и
трех или четырех
гидроксогрупп.
• Примеры
Al(OH)3 гидроксид алюминия
Fe(OH)3 гидроксид железа (III)
Cr(OH)3 гидроксид хрома (III)
Zn(OH)2
Ве(OH)2
гидроксид цинка
гидроксид бериллия
3.
Основания• Щелочи - растворимые в
воде основания
• Нерастворимые в воде
• Примеры
LiOH
Ca(OH)2
KOH
Ba(OH)2
NaOH
Sr(OH)2
RbOH
• Примеры
Cu(OH)2
Fe(OH)2
Mg(OH)2
Сильные основания, в водном
растворе диссоциируют
практически полностью
• Слабые основания, в водном
растворе практически не
диссоциируют
4.
Химические свойства щелочейИндикатор
лакмус
метилоранж
фенолфталеин
Универсальная
бумага
Нейтральная
(вода)
Кислая среда(в
кислоте)
Щелочная среда(в
щелочи)
5.
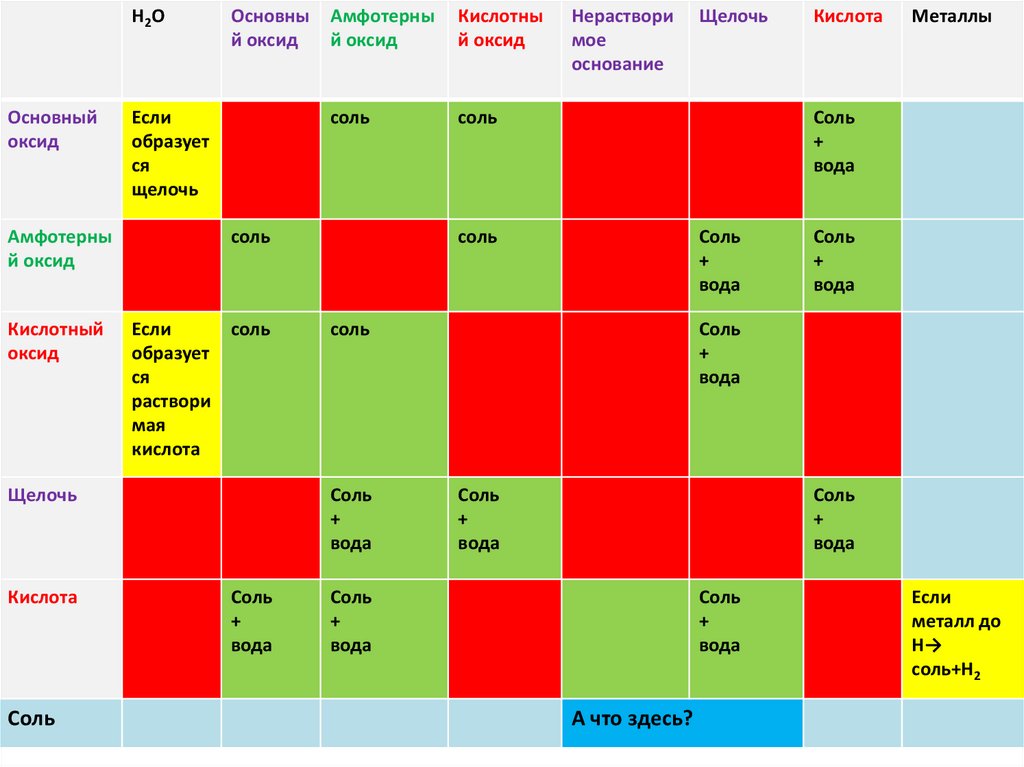
Н2 ООсновный
оксид
Основны
й оксид
Если
образует
ся
щелочь
Амфотерны
й оксид
соль
Кислотный
оксид
Если
соль
образует
ся
раствори
мая
кислота
Щелочь
Кислота
Соль
Амфотерны
й оксид
Кислотны
й оксид
соль
соль
Щелочь
Кислота
Металлы
Соль
+
вода
соль
Соль
+
вода
соль
Соль
+
вода
Соль
+
вода
Нераствори
мое
основание
Соль
+
вода
Соль
+
вода
Соль
+
вода
Соль
+
вода
Соль
+
вода
Соль
+
вода
А что здесь?
Если
металл до
Н→
соль+Н2
6.
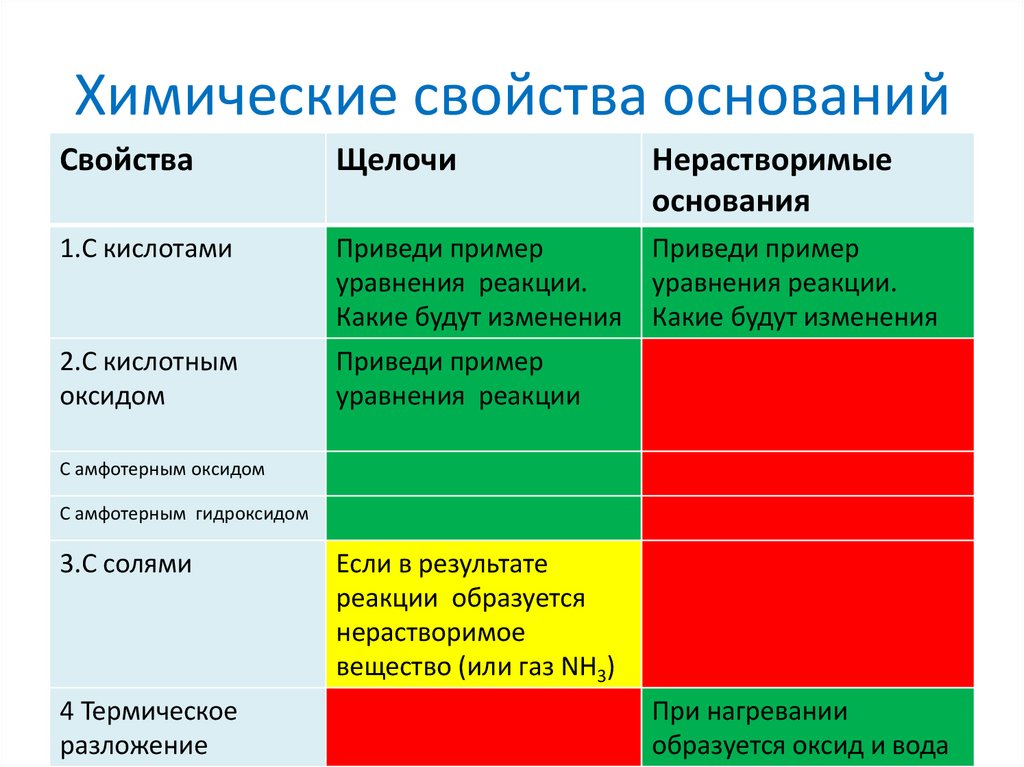
Химические свойства основанийСвойства
Щелочи
Нерастворимые
основания
1.С кислотами
Приведи пример
уравнения реакции.
Какие будут изменения
Приведи пример
уравнения реакции.
Какие будут изменения
2.С кислотным
оксидом
Приведи пример
уравнения реакции
С амфотерным оксидом
С амфотерным гидроксидом
3.С солями
4 Термическое
разложение
Если в результате
реакции образуется
нерастворимое
вещество (или газ NH3)
При нагревании
образуется оксид и вода
7.
Химические свойства оснований3.Взаимодействие щелочей с растворами солей:
Щелочь + соль1 = основание + соль2
При условии:
• соль1 - растворима в воде
основание или(и)соль2 нерастворимы в воде.
2КOH + CuSO4 = Cu(OH)2+K2SO4
Ba(OH)2 + K2SO4 = 2KOH+ BaSO4
Ba(OH)2 + CuSO4 = Cu(OH)2+ BaSO4
8.
Химические свойства оснований4.Термическое разложение нерастворимых оснований
2+
II
Cu(OH)2 =CuO + H2O (t)
2+
II
Fe(OH)2 = FeO + H2O (t)
3+
III
2 Fe(OH)3 = Fe2O3 +3 H2O (t) (амфотерные гидроксиды все
в воде не растворяются, поэтому тоже разлагаются при
нагревании). Щелочи не разлагаются при нагревании.
9.
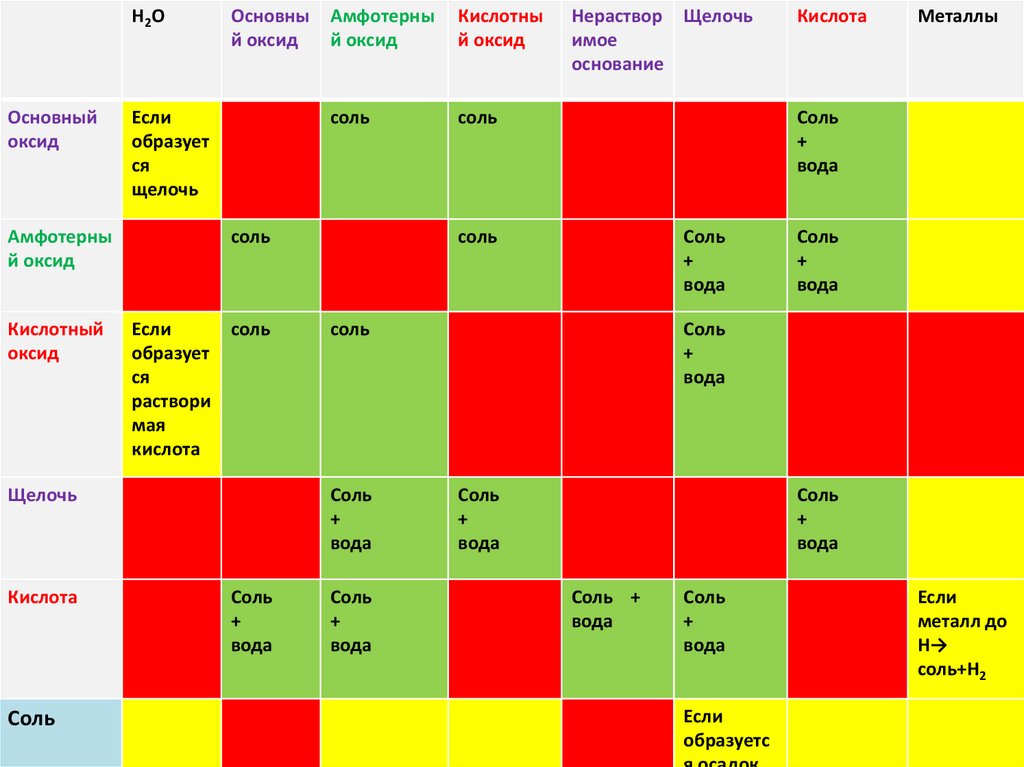
Н2 ООсновный
оксид
Основны
й оксид
Если
образует
ся
щелочь
Амфотерны
й оксид
соль
Кислотный
оксид
Если
соль
образует
ся
раствори
мая
кислота
Щелочь
Кислота
Соль
Амфотерны
й оксид
Кислотны
й оксид
соль
соль
Соль
+
вода
соль
Соль
+
вода
Кислота
Металлы
Соль
+
вода
соль
Соль
+
вода
Соль
+
вода
Нераствор Щелочь
имое
основание
Соль
+
вода
Соль
+
вода
Соль
+
вода
Соль
+
вода
Соль +
вода
Соль
+
вода
Если
образуетс
Если
металл до
Н→
соль+Н2
10.
Домашнее задание• Читать параграф 36
• Письменно:
составить уравнения химических реакций взаимодействия
гидроксида натрия и гидроксида меди (II) c веществами:
углекислый газ, соляная кислота, оксид магния, карбонат
натрия, хлорид железа (III), оксид фосфора (V) и
фосфорная кислота.
Правила выучить наизусть.
Дополнить записи в тетради материалами из презентации.
Таблицу с окраской индикаторов перенести в справочные
материалы тетради.







 Химия
Химия








