Похожие презентации:
Химические свойства кислот и оснований в свете представлений об электролитической диссоциации (9 класс)
1.
Химия 9 классУрок №12
11.10.2024г
Химические свойства кислот и
оснований в свете представлений об
электролитической диссоциации
www.themegallery.com
LOGO
2.
Кислоты – сложные вещества,молекулы которых состоят из
атомов водорода и кислотного
остатка (Н+Ас-)
Молекулы кислот образованы
элементами –неметаллами
LOGO
3.
Физические свойства кислотТвердые: H2SiO3 , H3PO4
Жидкие: H2SO4, HNO3, HCL
Газообразные – при растворении в воде
образуют растворы кислот:
HCL , H2S, HBr
Цвет кислот:
Желтая – H2CrO4
Малиновая – HMnO4
Бесцветные - все остальные
LOGO
4.
КЛАССИФИКАЦИЯКИСЛОТ
LOGO
5.
КИСЛОТЫ (по происхождению)НЕОРГАНИЧЕСКИЕ
Хлороводородная (соляная)
Сероводородная
Азотная
Азотистая
Серная
Сернистая
Угольная
Кремниевая
Фосфорная
HCL
H2S
HNO3
HNO2
H2SO4
H2SO3
H2CO3
H2SiO3
H3PO4
LOGO
6.
КИСЛОТЫ (по происхождению)ОРГАНИЧЕСКИЕ
Муравьиная
HCOOH
Уксусная
CH3COOH
Акриловая
CH2 = CH-COOH
Бензойная
C6H5 - COOH
Щавелевая
HOOC - COOH
Аминоуксусная
H2N-CH2-COOH
LOGO
7.
КЛАССИФИКАЦИЯ КИСЛОТ ПООСНОВНОСТИ
(числу атомов водорода)
Одноосновные : HNO3 HNO2 HCL HBr HF
Двухосновные :
H2SO4 H2SO3 H2CO3 H2SiO3
Трехосновные : H3PO4
LOGO
8.
КЛАССИФИКАЦИЯ КИСЛОТ ПОСОДЕРЖАНИЮ КИСЛОРОДА
БЕСКИСЛОРОДНЫЕ
Хлороводородная
(соляная) HCL
Бромоводородная
HBr
Фтороводородная
(плавиковая) HF
Сероводородная
H2S
КИСЛОРОДСОДЕР
ЖАЩИЕ
Азотная
HNO3
Угольная
H2CO3
Кремниевая
H2SiO3
Фосфорная
H3PO4
LOGO
9.
КЛАССИФИКАЦИЯ КИСЛОТ ПОРАСТВОРИМОСТИ
РАСТВОРИМЫЕ
В ВОДЕ
НЕРАСТВОРИМЫЕ
В ВОДЕ
HNO3
HCL
H2SO4
H3PO4
↓H2SiO3
LOGO
10.
КЛАССИФИКАЦИЯ КИСЛОТПО СТАБИЛЬНОСТИ
СТАБИЛЬНЫЕ
НЕСТАБИЛЬНЫЕ
H3PO4
(СУЩЕСТВУЮТ ТОЛЬКО В
РАСТВОРАХ)
H2SO4
HCL
H2CO3
H2S
H2SO3
HNO2
H2SiO3
LOGO
11.
КЛАССИФИКАЦИЯ КИСЛОТПО ЛЕТУЧЕСТИ
ЛЕТУЧИЕ
НЕЛЕТУЧИЕ
HCL
HNO3
CH3COOH
H2S
H2SO4
H3PO4
H2SiO3
LOGO
12.
Кислоты в свете ТЭДwww.themegallery.com
LOGO
13.
КислотыЭлектролиты, которые при
диссоциации образуют катионы
водорода и ионы кислотного
остатка;
HBr
H+ + Br H2S 2H+ + S2 HNO3 H++NO-3
H2SO4 2H+ + SO2-4
LOGO
14.
КислотыКатионы водорода придают кислотам
кислый вкус,
Изменяют окраску индикатора
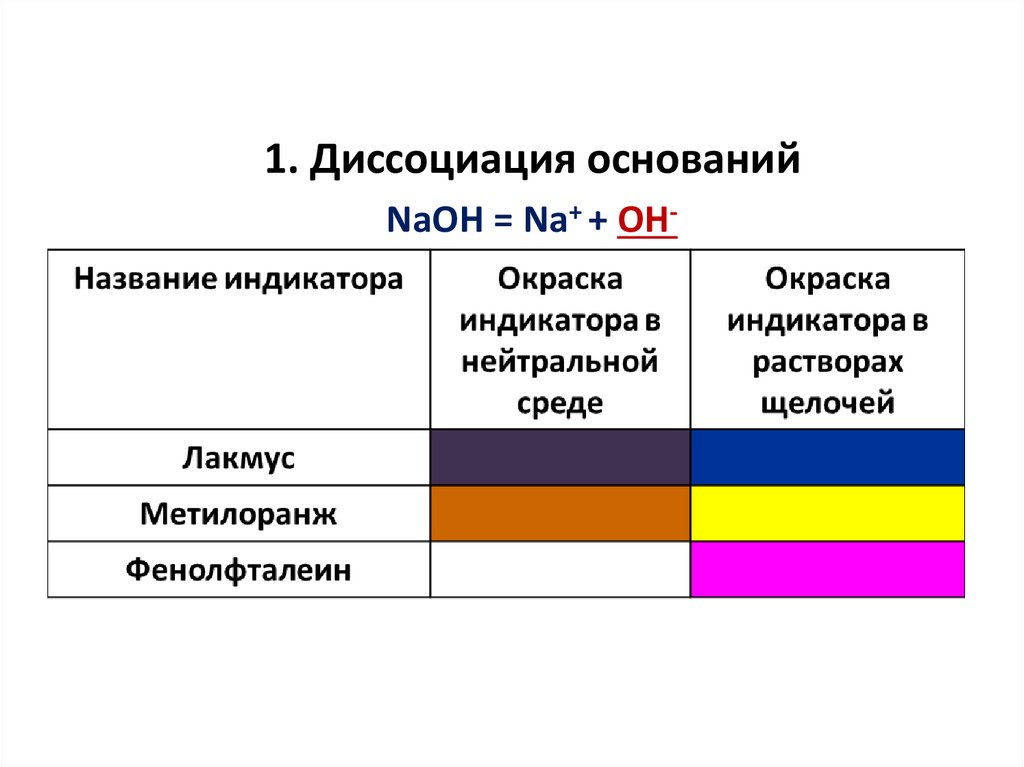
РАСПОЗНАВАНИЕ КИСЛОТ С ПОМОЩЬЮ
ИНДИКАТОРОВ
Среда /
Индикатор
Кислая
Лакмус
Метил
оранж
Красный
Розовый
Фенол
фталеин
Бесцветный
LOGO
15.
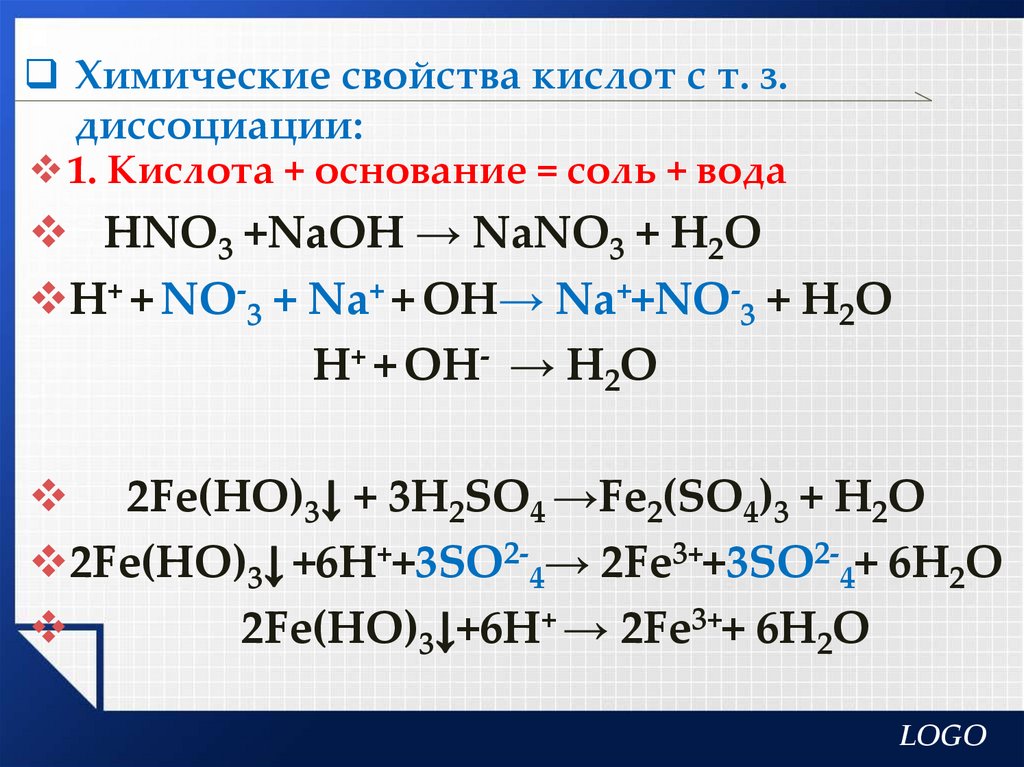
Химические свойства кислот с т. з.диссоциации:
1. Кислота + основание = соль + вода
НNО3 +NaOH → NaNO3 + H2О
Н+ + NО-3 + Na+ + OH→ Na++NO-3 + H2О
Н+ + OH- → H2О
2Fe(HO)3↓ + 3H2SO4 →Fe2(SO4)3 + H2О
2Fe(HO)3↓ +6H++3SO2-4→ 2Fe3++3SO2-4+ 6H2О
2Fe(HO)3↓+6H+ → 2Fe3++ 6H2О
LOGO
16.
Химические свойства кислот сточки зрения диссоциации:
2. Кислота + оксид металла = соль + вода:
Al2O3 + 6HCl → 2AlCl3 + 3H2О
Al2O3 + 6H+ +6Cl- → 2Al 3+ +6Cl- + 3H2О
Al2O3 + 6H+ → 2Al 3+ + 3H2О
LOGO
17.
Химические свойства кислот сточки зрения диссоциации:
3. Кислота + металл = соль + водород:
2 НСL + Zn0 →ZnСL2 + H02↑
2 Н+ +2СL-+ Zn0 →Zn2+ +2СL- + H02↑
2 Н+ + Zn0 →Zn2+ + H02↑
Условия протекания реакций:
Металл стоит в ряду напряжений стоит до Н
LOGO
18.
Химические свойства кислот с т. з.окисления - восстановления:
2 НСL + Zn0 →ZnСL2 + H02↑
2 Н+ + 2е → H02 2 1 – окислитель; вос-ся
Zn0 - 2 е → Zn2+ 2 1 - восстановитель; ок-ся
LOGO
19.
Каждый из металлов, расположенных в рядуактивности металлов до водорода, способен
вытеснять его из растворов кислот
Ряд активности
металлов
(в порядке убывания их химической активности)
Li K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H2↑
Вытесняют водород из кислот
Cu Ag Hg Au
Не вытесняют водород из кислот
LOGO
20.
Химические свойства кислот сточки зрения диссоциации:
Реакция не пойдет, если:
Pb + H2SO4 → ↓PbSO4 + H2↑
Соли тяжелых металлов не взаимодействуют
Должна получиться растворимая соль
Нерастворимые кислоты (H2SiO3)
не вступают в реакции с металлами
Концентрированные растворы серной и
азотной кислот с металлами реагируют по
другой схеме
LOGO
21.
Химические свойства кислот сточки зрения диссоциации:
4. Кислота + соль слабой кислоты =
н. соль + н. кислота(слабая)
А)Na2CO3 + 2HCl → 2NaCl + H2CO3
2Na ++ CO2-3 + 2H++2Cl- → 2Na++2Cl- +
H2CO3
CO2-3 + 2H+ → H2CO3 H2CO3 → Н2О + CO2↑
CO2-3 + 2H+ →Н2О + CO2↑
Б)
К2S + 2HCL → 2КCL + H2S↑
2К++S2- + 2H+ +2CL- → 2К++2CL- + H2S↑
S2- + 2H+ →H2S↑
LOGO
22.
КислотыРяд активности кислот:
H2SO4 HNO3HCL (сильные)
H3PO4 (средние)
HNO2; H2S↑;
H2SO3↑; H2CO3↑; H2SiO3↓(слабые)
Сила кислот убывает
LOGO
23.
СВОЙСТВАОСНОВАНИЙ
В СВЕТЕ ТЕОРИИ
ЭЛЕКТРОЛИТИЧЕСКОЙ
ДИССОЦИАЦИИ
LOGO
24.
Основания – это электролиты, при диссоциациикоторых в качестве катионов выступают катионы
металла (или аммония), а в качестве анионов –
гидроксид-ионы
Cu(OH)2
Са(ОН)2
Fe(OH)3
Ni(OH)2
25.
1. Диссоциация основанийNaOH = Na+ + OH-
26.
2. Реакции оснований с кислотами(реакции обмена)
Основание + кислота = соль + вода
NaOH + HCl = NaCl + H2O
ОН- + Н+ = Н2О
Кристаллы соли
27.
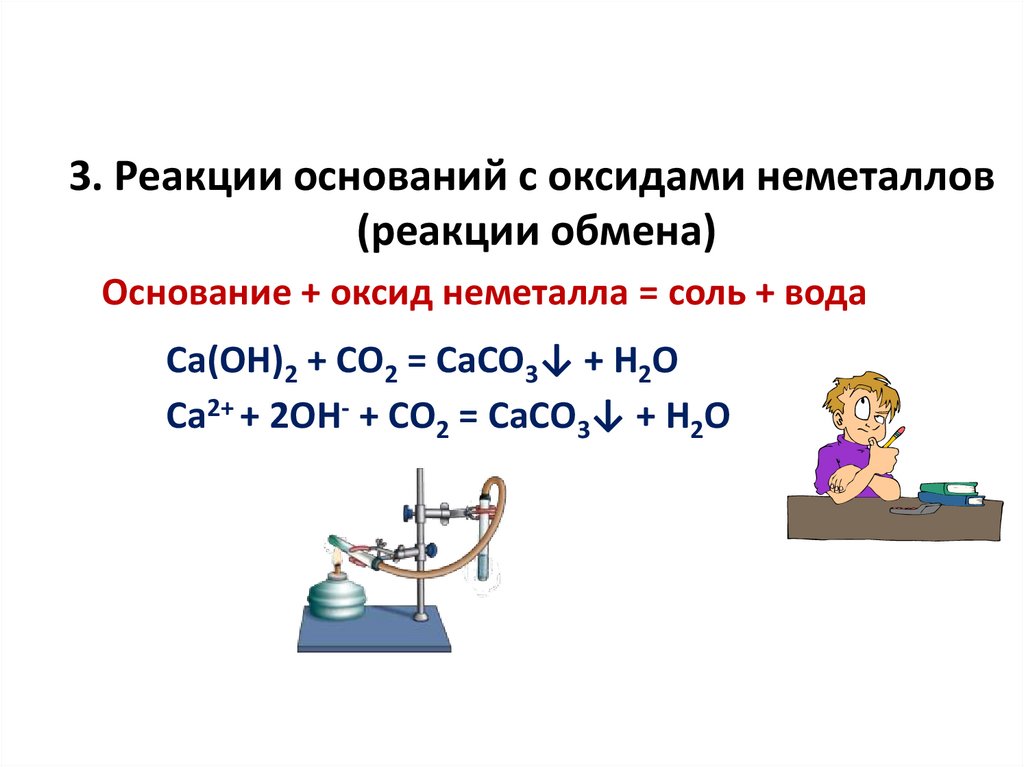
3. Реакции оснований с оксидами неметаллов(реакции обмена)
Основание + оксид неметалла = соль + вода
Са(ОН)2 + СО2 = СаСО3↓ + Н2О
Са2+ + 2ОН- + СО2 = СаСО3↓ + Н2О
28.
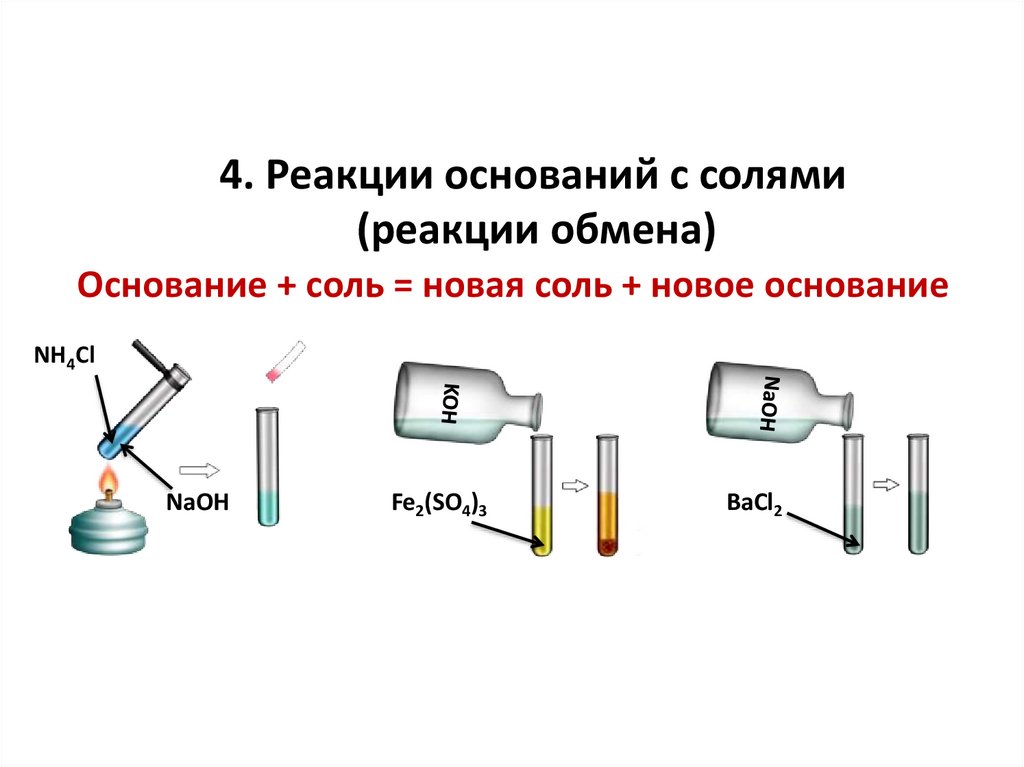
4. Реакции оснований с солями(реакции обмена)
Основание + соль = новая соль + новое основание
NH4Cl
NaOH
Fe2(SO4)3
BaCl2
29.
tNaOH + NH4Cl = NaCl + NH3↑ + H2O
OH- + NH4+ = NH3↑ + H2O
6KOH + Fe2(SO4)3 = 3K2SO4 +
2Fe(OH)3↓
3OH- + Fe3+ = Fe(OH)3↓
NaOH + BaCl2 ≠
LOGO
30.
5. Разложение нерастворимыхоснований
t
Fe(OH)2 = FeO + H2O
t
Cu(OH)2 = CuO + H2O
Cu(OH)2
CuO
LOGO
31.
Признакиклассификации
Наличие кислорода
Кислотность
(число групп OHв составе или число
присоединяемых H+)
Растворимость в воде
Группы оснований
Примеры
Кислородсодержащие
KOH, Ca(OH)2
Бескислородные
Аммиак NH3, F-
Однокислотные
KOH, NaOH, NH3,
Двухкислотные
Ca(OH)2, Mg(OH)2
Трёхкислотные
Аl(OH)3, Ti(OH)3
Растворимые
NaOH, Ba(OH)2,
H3C—NH2,
Нерастворимые
Cr(OH)2, Mn(OH)2
LOGO
32.
Амфотерность — это способностьнекоторых соединений проявлять как
кислотные, так и основные свойства в
зависимости от условий.
Неорганические амфотерные
соединения — оксиды и гидроксиды
алюминия, цинка, хрома, бериллия,
германия, олова, свинца и некоторых
других.
LOGO
33.
Взаимодействие амфотерных оксидов со щелочамиВ реакции между оксидом алюминия и
гидроксидом натрия образуются алюминат натрия и
вода:
Al2О3 + 2NaOH = 2NaAlO2 + H2O
В ионном виде:
Al2О3 + 2OH- = 2AlO2- + H2O
34.
Взаимодействие амфотерных гидроксидов со щелочамиПри взаимодействии гидроксида цинка с
гидроксидом натрия образуются цинкат натрия и
вода:
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
В ионном виде:
Zn(OH)2 + 2OH- = ZnO22- +2H2O
35.
Решаем• Упр. №5-6 стр.41
• Упр.№4 ,№5 (а) стр.45
36.
Домашнее задание:Параграф 6,7.
Конспект
LOGO
























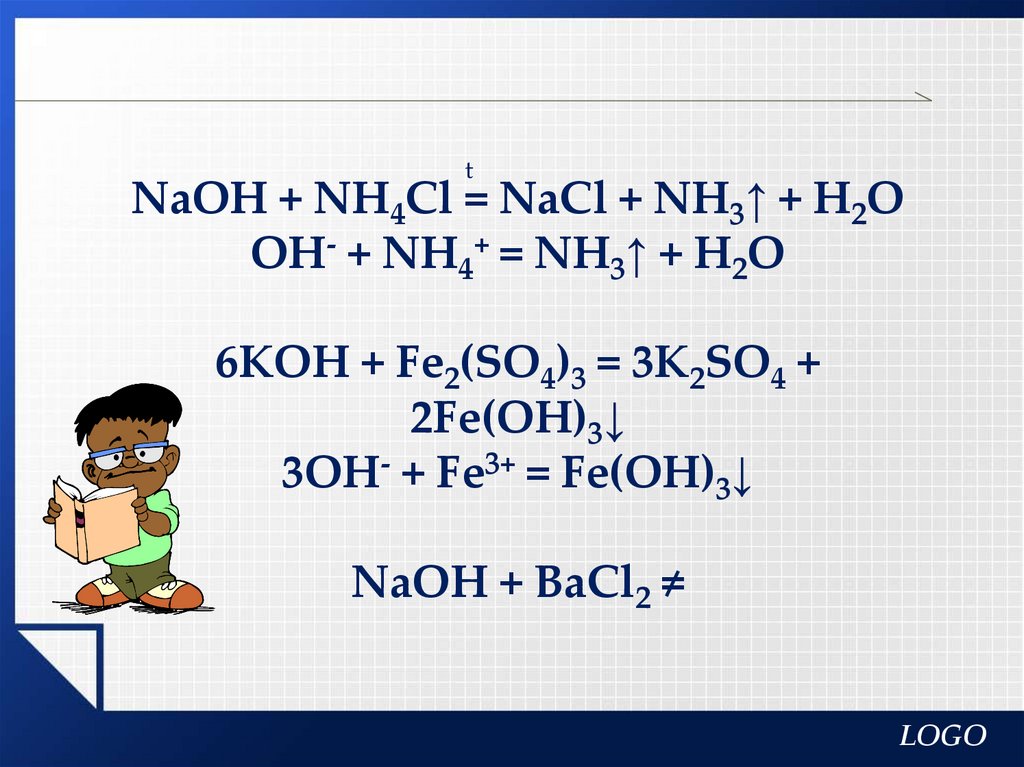







 Химия
Химия








