Похожие презентации:
Карбоновые кислоты
1. Выполните задания
1. Запишите уравнения реакций, с помощью которых можноосуществить следующие превращения:
СН4→С2Н2→ СН3-СОН →С2Н5ОН→СН3-СОН→СН3-СООН
Составьте структурные формулы всех органических веществ.
Назовите вещества в цепочке.
2. Решите задачу: Рассчитайте объем уксусного альдегида,
полученного при пропускании паров этанола объемом 5,6 л
над раскаленным оксидом меди (II) (н.у.).
Задание будет проверено на
следующем уроке!
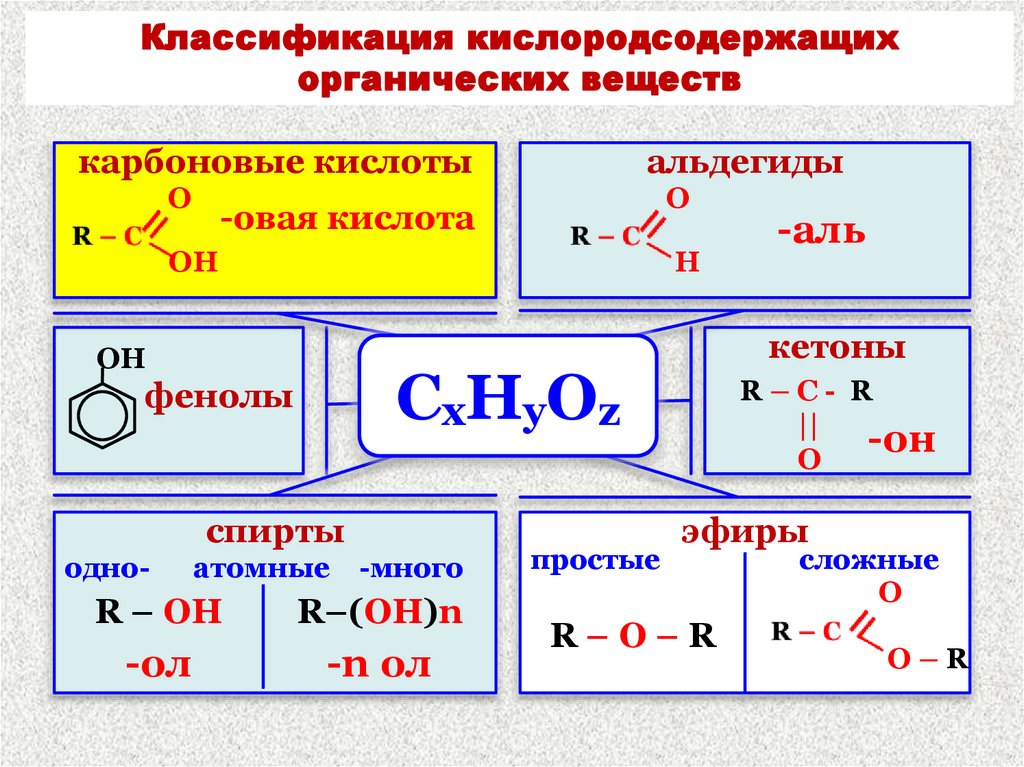
2. Классификация кислородсодержащих органических веществ
карбоновые кислотыO
альдегиды
O
-овая кислота
OH
H
OH
спирты
одно-
кетоны
СхНуОz
фенолы
атомные
-много
R – OH
R–(OH)n
-ол
-n ол
простые
-аль
R–C- R
||
-он
O
эфиры
R–O–R
сложные
O
O–R
3.
КАРБОНОВЫЕКИСЛОТЫ
4.
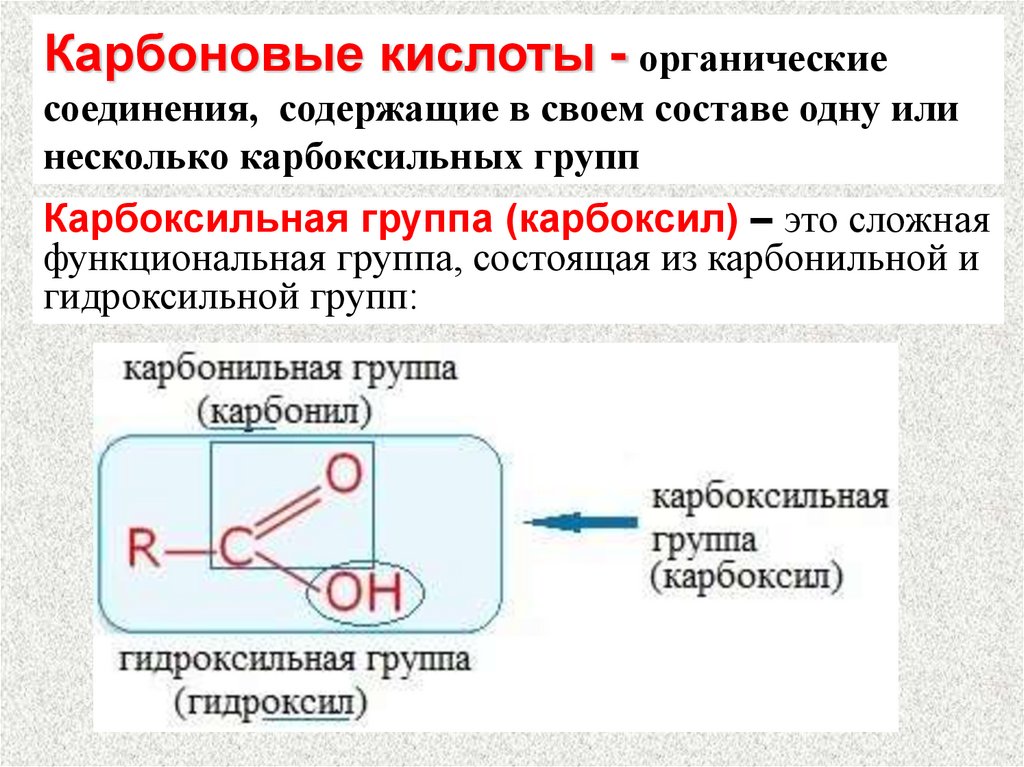
Карбоновые кислоты - органическиесоединения, содержащие в своем составе одну или
несколько карбоксильных групп
Карбоксильная группа (карбоксил) – это сложная
функциональная группа, состоящая из карбонильной и
гидроксильной групп:
5.
Одноосновныепредельные
карбоновые кислоты
Общая формула одноосновных карбоновых кислот
6.
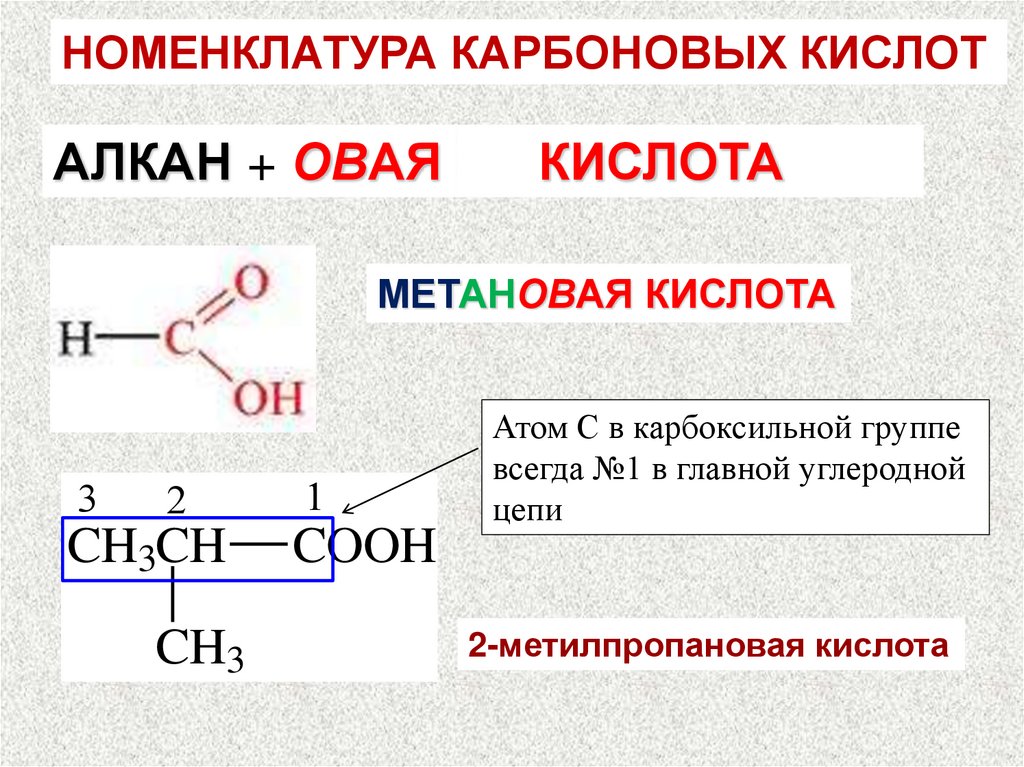
НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТАЛКАН + ОВАЯ
КИСЛОТА
МЕТАНОВАЯ КИСЛОТА
3
2
CH3CH
CH3
1
COOH
Атом С в карбоксильной группе
всегда №1 в главной углеродной
цепи
2-метилпропановая кислота
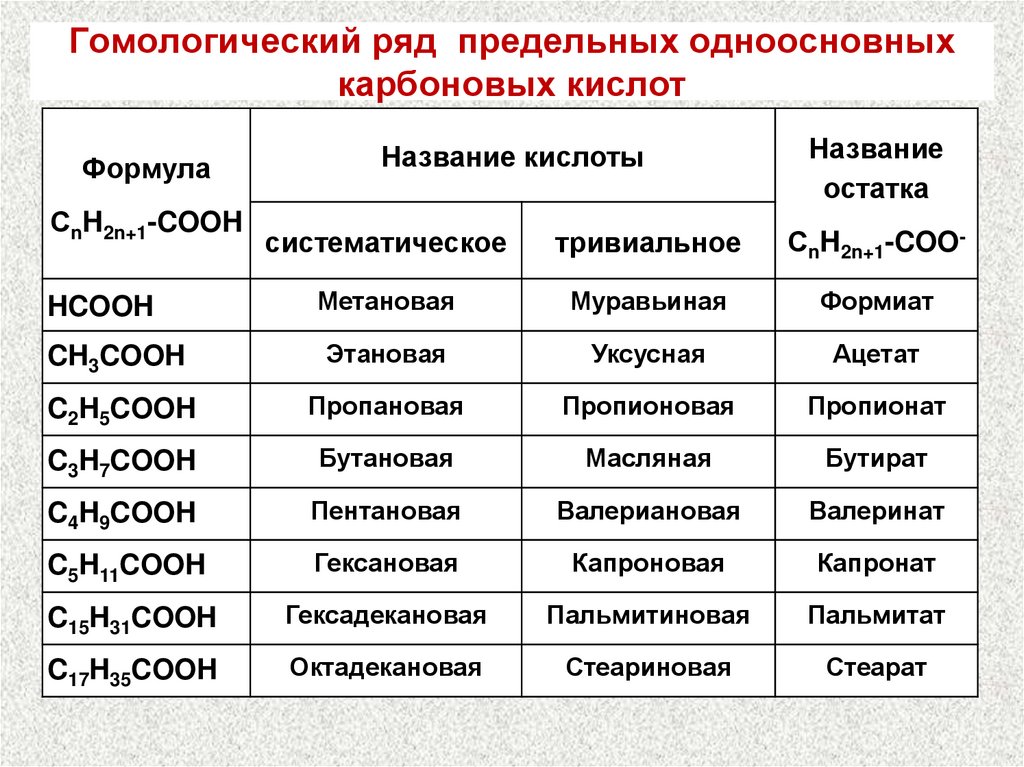
7. Гомологический ряд предельных одноосновных карбоновых кислот
ФормулаСnH2n+1-COOH
Название кислоты
Название
остатка
систематическое
тривиальное
СnH2n+1-COO-
HCOOH
Метановая
Муравьиная
Формиат
CH3COOH
Этановая
Уксусная
Ацетат
C2H5COOH
Пропановая
Пропионовая
Пропионат
C3H7COOH
Бутановая
Масляная
Бутират
C4H9COOH
Пентановая
Валериановая
Валеринат
C5H11COOH
Гексановая
Капроновая
Капронат
C15H31COOH
Гексадекановая
Пальмитиновая
Пальмитат
C17H35COOH
Октадекановая
Стеариновая
Стеарат
8. Изомерия
СТРУКТУРНАЯ ИЗОМЕРИЯИзомерия углеродного скелета.
Первые три гомолога гомологического ряда изомеров не
имеют.
Четвёртый представитель гомологического ряда имеет два
изомера:
С3Н7СООН
9.
ФИЗИЧЕСКИЕ СВОЙСТВАЖидкости с характерным
С1 – С3 резким запахом,
хорошо растворимые в воде
Вязкие маслянистые
жидкости с неприятным
С4 – С9 запахом, плохо
растворимые в воде
Твердые вещества,
имеющие запаха, не
C10 и > не
растворимые
в воде
10. МУРАВЬИНАЯ (метановая) КИСЛОТА
Впервые эту кислоту получил английский зоологДжон Рей (1670 г.) при нагревании муравьёв в
воде и перегонкой полученного водяного пара
В природе муравьиная кислота обнаружена в
хвое, крапиве, фруктах, едких выделениях
пчёл, муравьёв, медуз..
Бесцветная жидкость с резким запахом, самая
сильная и активная из всех карбоновых
кислот
Применяется
- в текстильной промышленности для протравы
при крашении тканей,
- как консервант в пищевой промышленности,
- как отбеливатель при дублении кожи,
- для получения пестицидов,
- как лекарственное средство.
11. УКСУСНАЯ (этановая) КИСЛОТА
Это самая первая кислота, которая стала известна человеку.При скисании вина получается уксус (раствор уксусной кислоты).
Выделена в чистом виде в 1700 г.
Получена синтетическим путем в 1845 г. Г.Кольбе.
Бесцветная кислота с резким кисловатым запахом. Слабая кислота.
50-80% раствор уксусной кислоты называется уксусной эссенцией,
5 – 9% раствор – столовым уксусом.
Применение
- приправа к пище (пищевая добавка E260) , консервант,
- растворитель в производстве душистых веществ,
- для получения ацетатного шелка, целлофана, аспирина,
- в книгопечатании и при покраске тканей (как протрава)
12. ПАЛЬМЕТИНОВАЯ (гексадекановая) КИСЛОТА
Входит в составмногих животных
жиров и растительных
CH3(CH2)14COOH масел (сливочное
масло содержит 25 %,
свиное сало — 30 %, в
C15H31COOH
пчелином воске 30 %).
Используют в
производстве
- напалма,
- моющих и
косметических средств.
13. СТЕАРИНОВАЯ (октадекановая) КИСЛОТА
Белые кристаллы,нерастворимые в воде. Не
имеет запаха. Очень слабые
кислотные свойства.
Была открыта в свином сале в
1816 году французским химиком
Шеврелем.
С17Н35COOH Распространённая в
природе жирная кислота,
входящая в состав липидов
- жиров животного
происхождения.
Используется в
- производстве мыла,
- производстве свечей
14. КИСЛОТЫ
НЕОРГАНИЧЕСКИЕКИСЛОТЫ
HnA
сложные вещества, в
состав которых входит один
или несколько атомов
водорода, способных
замещаться на атомы
металла, и кислотный
остаток
ПРЕДЕЛЬНЫЕ
ОДНООСНОВНЫЕ
КАРБОНОВЫЕ
КИСЛОТЫ
R-COOH
органические вещества,
молекулы которых
содержат
карбоксильную группу,
соединённую с
предельным
углеводородным
радикалом
15.
Зависимость кислотных свойств истроения вещества
Карбоновые кислоты значительно уступают по своим
кислотным свойствам сильным неорганическим кислотам
(серная, соляная…)
Из неорганических кислот лишь угольная слабее
органических кислот предельного ряда и может
вытесняться ими из её солей - карбонатов.
ПРИМЕР: процесс «гашения» уксусом питьевой соды,
сопровождающийся выделением пузырьков газа диоксида углерода.
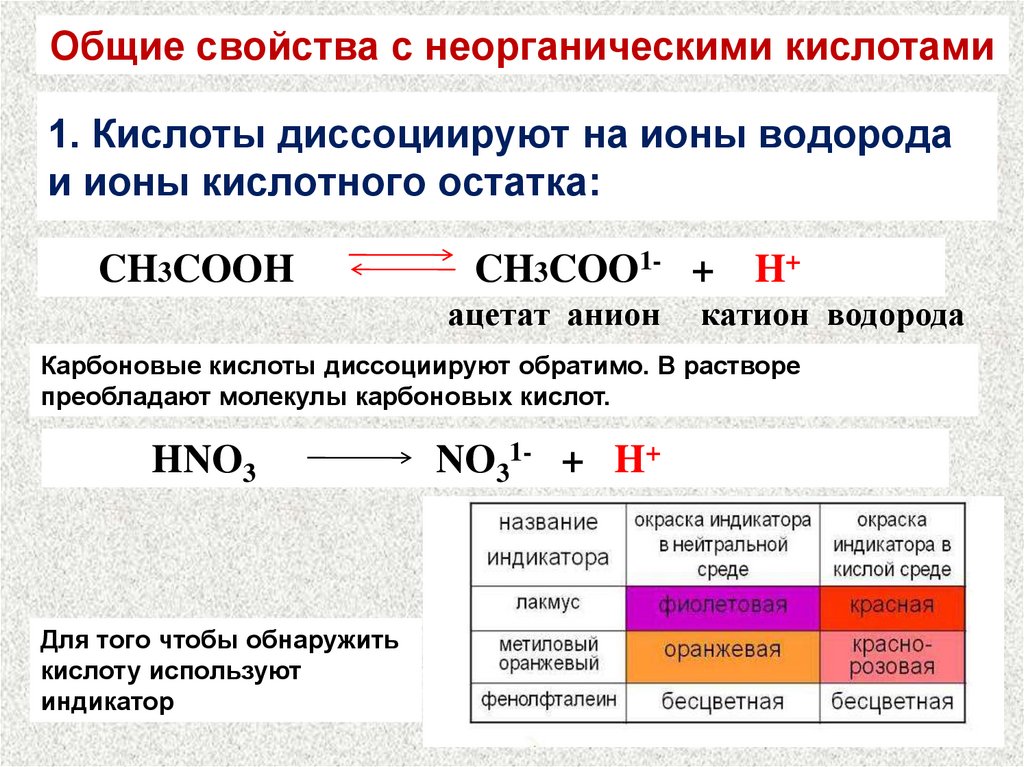
16. 1. Кислоты диссоциируют на ионы водорода и ионы кислотного остатка:
Общие свойства с неорганическими кислотами1. Кислоты диссоциируют на ионы водорода
и ионы кислотного остатка:
CH3COOH
CH3COO1- +
ацетат анион
H+
катион водорода
Карбоновые кислоты диссоциируют обратимо. В растворе
преобладают молекулы карбоновых кислот.
HNO3
Для того чтобы обнаружить
кислоту используют
индикатор
NO31- + H+
17.
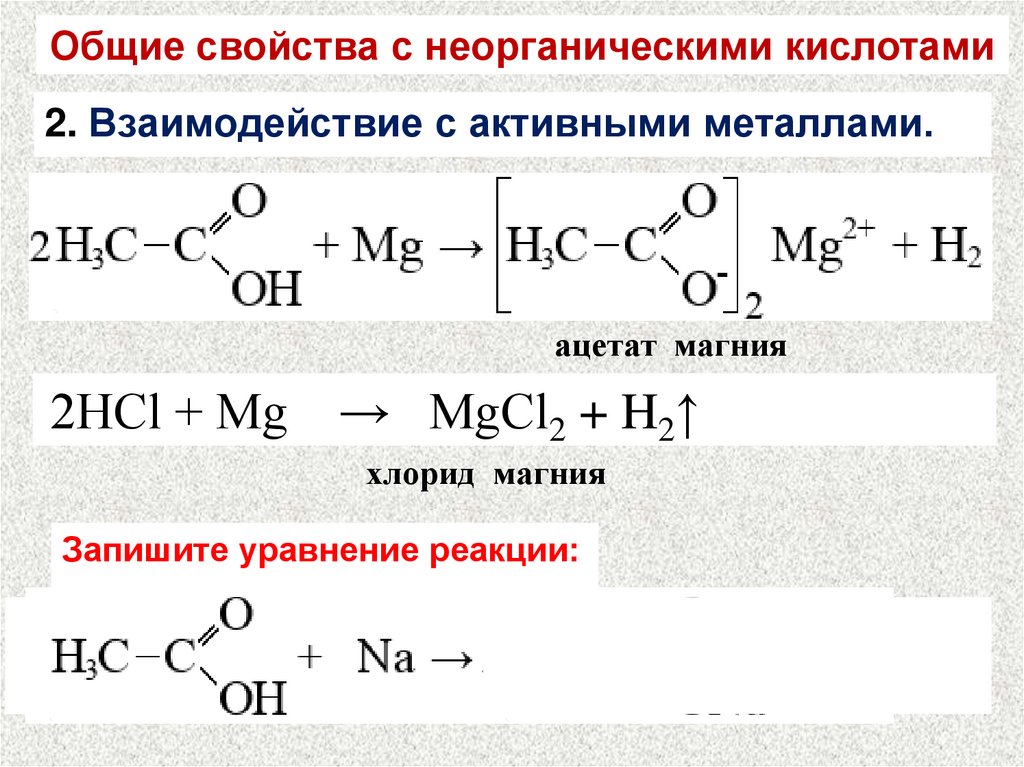
Общие свойства с неорганическими кислотами2. Взаимодействие с активными металлами.
ацетат магния
2HCl + Mg
→ MgCl2 + H2↑
хлорид магния
Запишите уравнение реакции:
18.
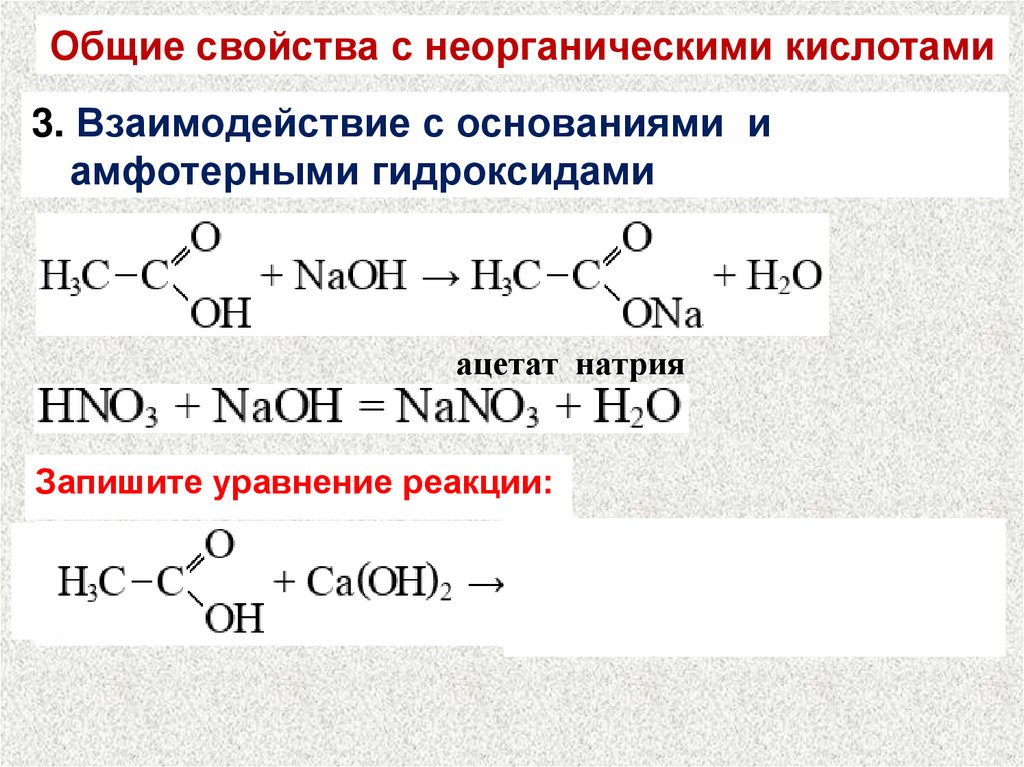
Общие свойства с неорганическими кислотами3. Взаимодействие с основаниями и
амфотерными гидроксидами
ацетат натрия
Запишите уравнение реакции:
19.
Общие свойства с неорганическими кислотами4. Взаимодействие с основными и
амфотерными оксидами.
ацетат цинка
Запишите уравнение реакции:
20.
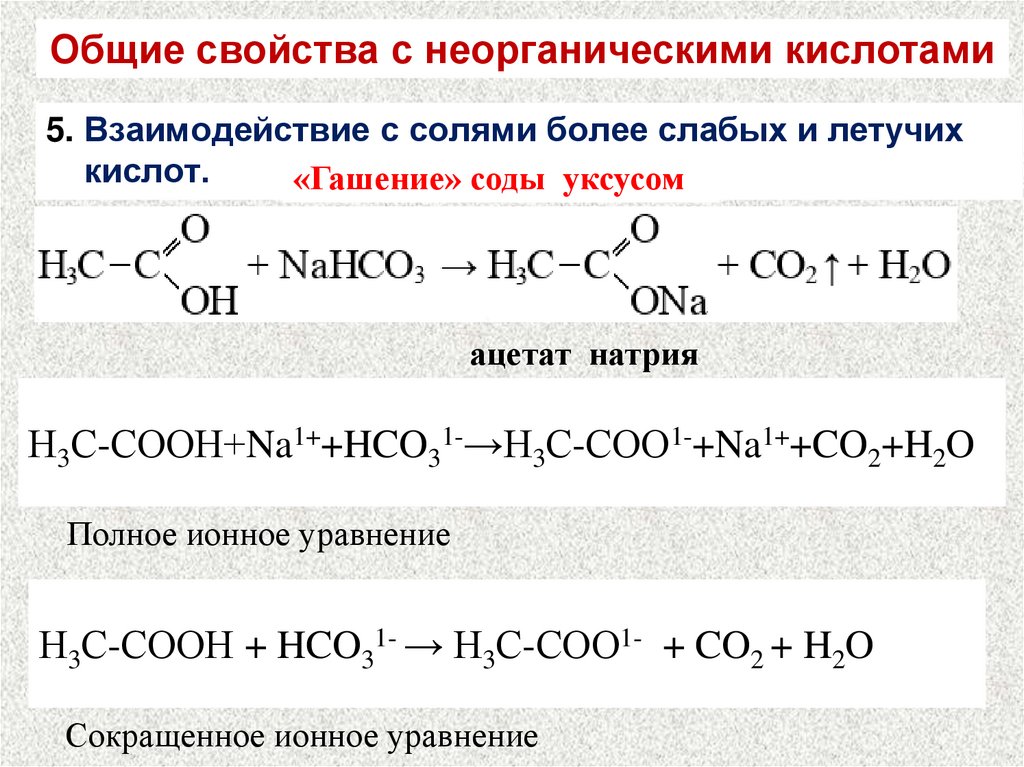
Общие свойства с неорганическими кислотами5. Взаимодействие с солями более слабых и летучих
кислот.
«Гашение» соды уксусом
ацетат натрия
Н3С-СООН+Na1++HCO31-→Н3С-СОО1-+Na1++CO2+H2O
Полное ионное уравнение
Н3С-СООН + HCO31- → Н3С-СОО1- + CO2 + H2O
Сокращенное ионное уравнение
21.
Общие свойства с неорганическими кислотами5. Взаимодействие с солями более слабых и летучих
кислот.
Запишите уравнения реакции в молекулярном и
ионном видах :
CH3COOH + Na2SiO3 →
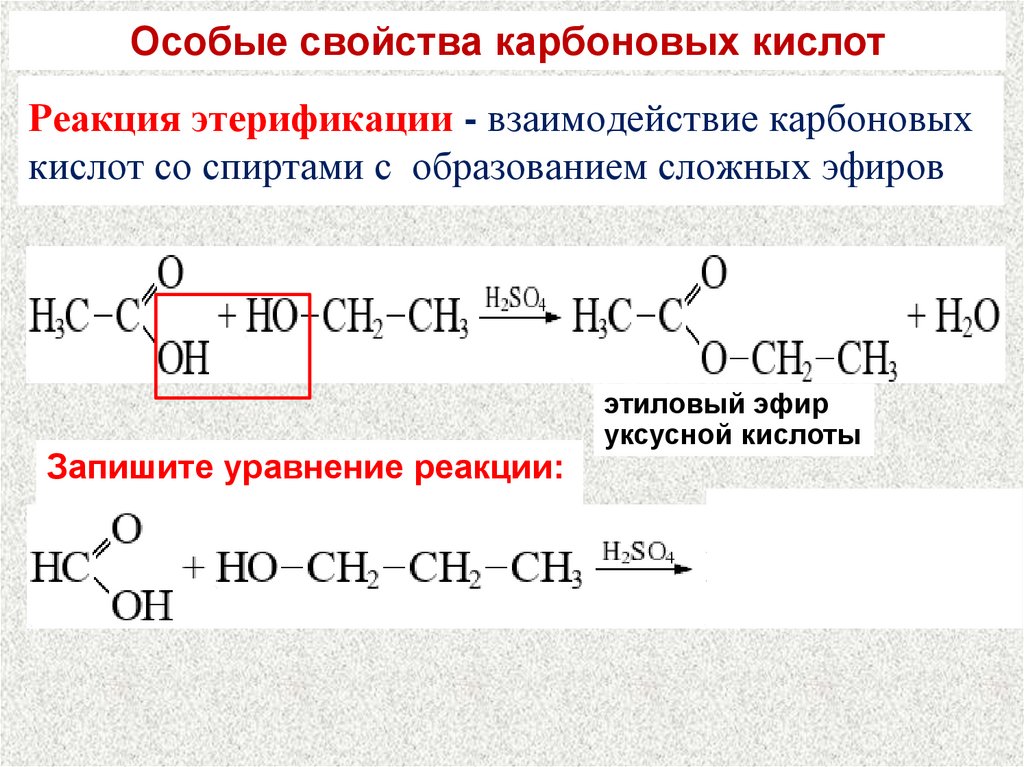
22. Реакция этерификации - взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров
Особые свойства карбоновых кислотРеакция этерификации - взаимодействие карбоновых
кислот со спиртами с образованием сложных эфиров
Запишите уравнение реакции:
этиловый эфир
уксусной кислоты
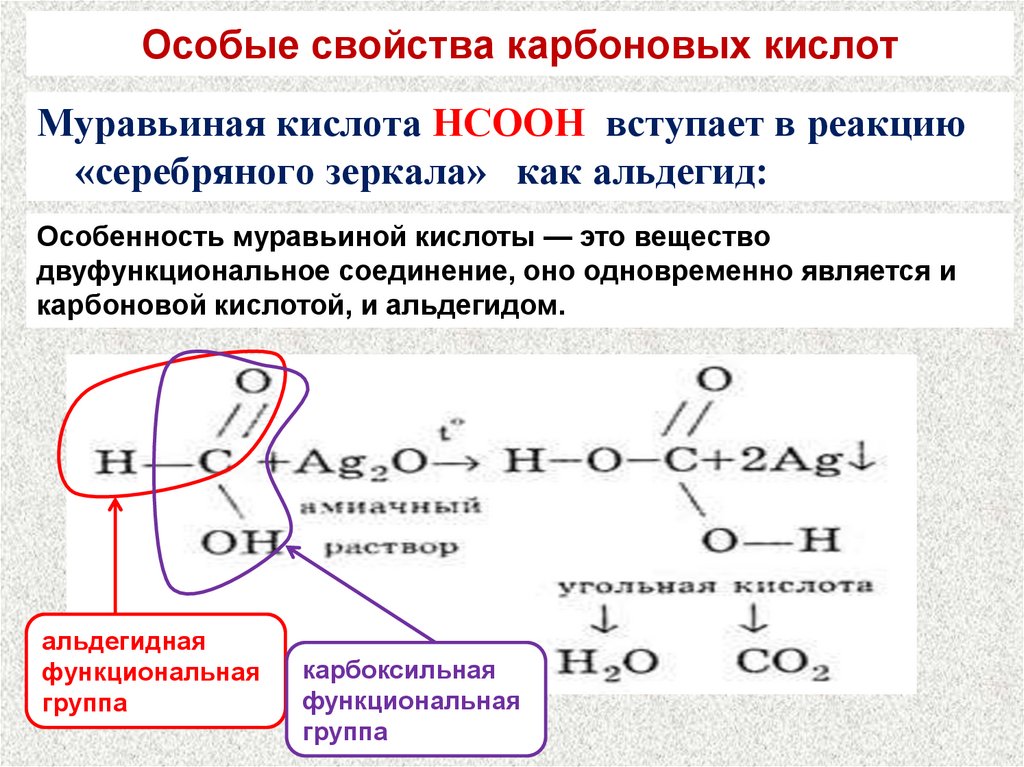
23. Особые свойства карбоновых кислот
Муравьиная кислота НСООН вступает в реакцию«серебряного зеркала» как альдегид:
Особенность муравьиной кислоты — это вещество
двуфункциональное соединение, оно одновременно является и
карбоновой кислотой, и альдегидом.
альдегидная
функциональная
группа
карбоксильная
функциональная
группа
24.
Получение карбоновых кислотДействие на соли карбоновых кислот сильных
неорганических кислот (лабораторный способ)
t
2 СН3СООNa + Н2SO4 →Na2SO4 + 2 CH3COOH
ацетат натрия
уксусная кислота
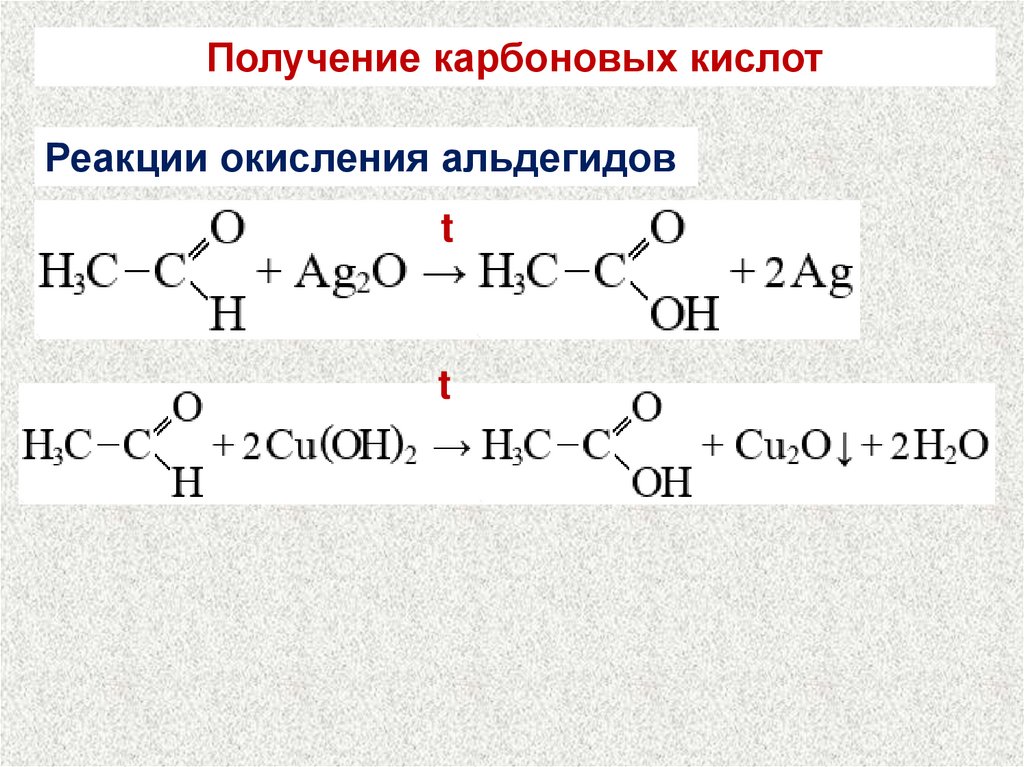
25.
Получение карбоновых кислотРеакции окисления альдегидов
t
t
26.
Какое веществовызывает жалящее
действие крапивы и
стрекательных клеток
медузы? Как снять
боль от ожогов,
вызванных
выделениями этих
организмов?
27.
Царица Клеопатра посовету придворных
медиков растворила в
уксусе самую крупную
из известных
ювелирам жемчужину,
а затем принимала
полученный раствор в
течение некоторого
времени. Какую
реакцию осуществила
Клеопатра? Какое
соединение она
принимала?
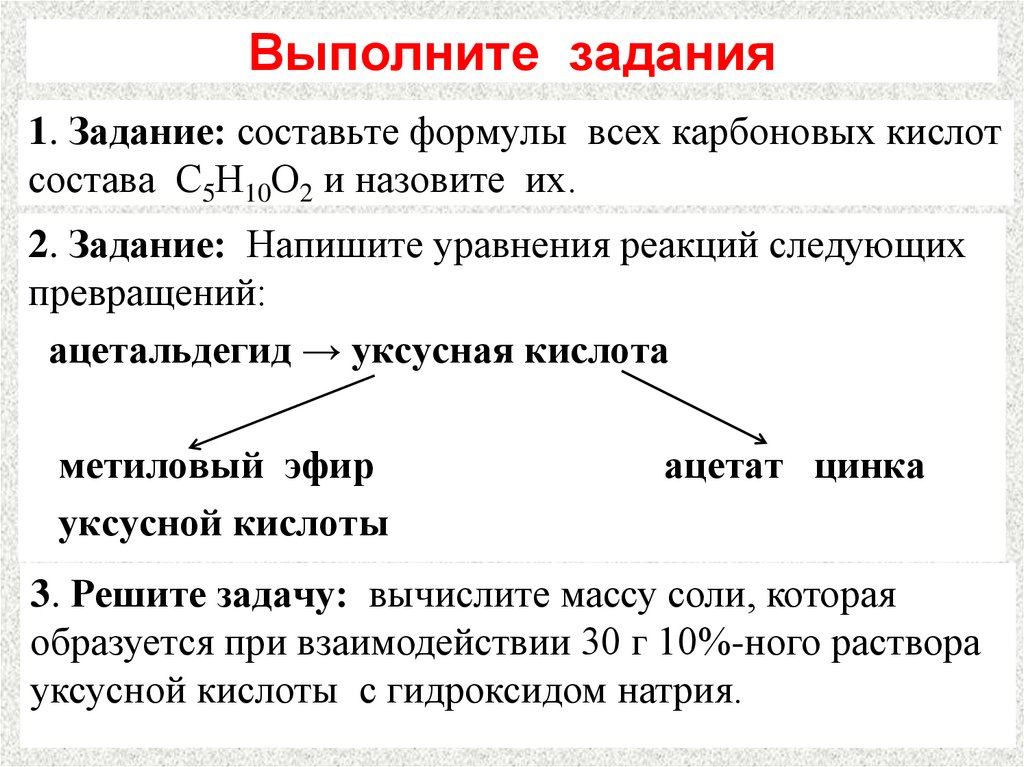
28. Выполните задания
1. Задание: составьте формулы всех карбоновых кислотсостава С5Н10О2 и назовите их.
2. Задание: Напишите уравнения реакций следующих
превращений:
ацетальдегид → уксусная кислота
метиловый эфир
уксусной кислоты
ацетат цинка
3. Решите задачу: вычислите массу соли, которая
образуется при взаимодействии 30 г 10%-ного раствора
уксусной кислоты с гидроксидом натрия.
















 Химия
Химия








