Похожие презентации:
Валентність хімічних елементів
1.
2.
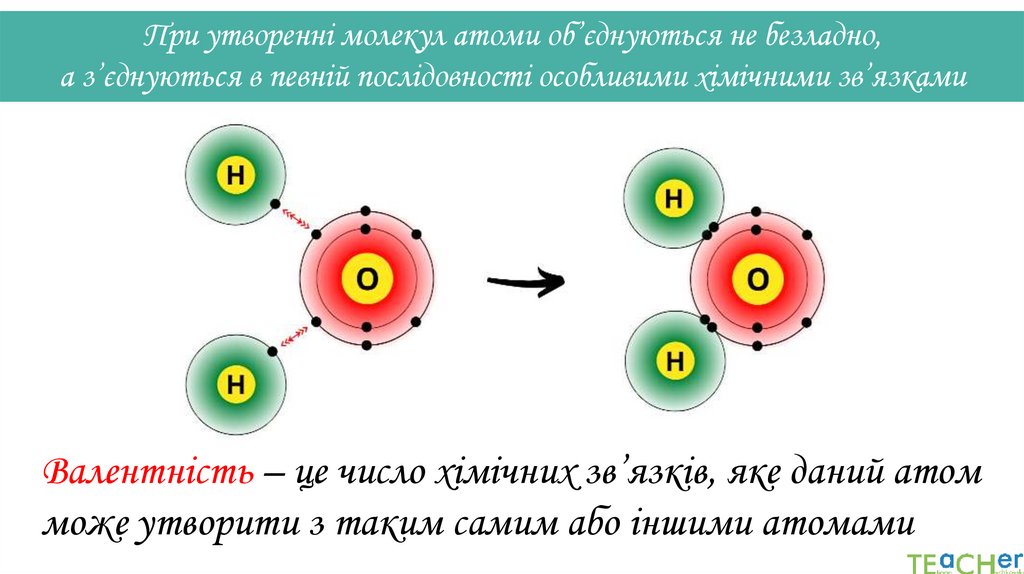
При утворенні молекул атоми об’єднуються не безладно,а з’єднуються в певній послідовності особливими хімічними зв’язками
Валентність – це число хімічних зв’язків, яке даний атом
може утворити з таким самим або іншими атомами
3.
Щоб показати, як атоми з’єднані в молекулі, використовують структурні формулиСтруктурна формула - хімічна формула, яка показує не лише атомнi
спiввiдношення в сполуцi, але й послідовність їх сполучення та
взаєморозташування в хімічній частинці
Молекула води Н2О
О
Н
Н
4.
Щоб показати, як атоми з’єднані в молекулі, використовують структурні формулиСтруктурна формула - хімічна формула, яка показує не лише атомнi
спiввiдношення в сполуцi, але й послідовність їх сполучення та
взаєморозташування в хімічній частинці
Молекула води Н2О
О
Н
Н
Атом оксигену утворює
два зв’язки,
тому оксиген двовалентний
5.
Щоб показати, як атоми з’єднані в молекулі, використовують структурні формулиСтруктурна формула - хімічна формула, яка показує не лише атомнi
спiввiдношення в сполуцi, але й послідовність їх сполучення та
взаєморозташування в хімічній частинці
Молекула води Н2О
О
Н
Н
Атоми гідрогену утворюють
по одному зв’язку,
тому гідроген одновалентний
6.
Щоб показати, як атоми з’єднані в молекулі, використовують структурні формулиСтруктурна формула - хімічна формула, яка показує не лише атомнi
спiввiдношення в сполуцi, але й послідовність їх сполучення та
взаєморозташування в хімічній частинці
Молекула вуглекислого газу СО2
О
С
О
7.
Щоб показати, як атоми з’єднані в молекулі, використовують структурні формулиСтруктурна формула - хімічна формула, яка показує не лише атомнi
спiввiдношення в сполуцi, але й послідовність їх сполучення та
взаєморозташування в хімічній частинці
Молекула вуглекислого газу СО2
Атоми оксигену утворюють
по два зв’язки,
тому оксиген двовалентний
О
С
О
8.
Щоб показати, як атоми з’єднані в молекулі, використовують структурні формулиСтруктурна формула - хімічна формула, яка показує не лише атомнi
спiввiдношення в сполуцi, але й послідовність їх сполучення та
взаєморозташування в хімічній частинці
Молекула вуглекислого газу СО2
Атом карбону утворює
чотири зв’язки,
тому карбон чотиривалентний
О
С
О
9.
У йонних кристалах неможливо виокремити ізольовані структури подібнодо молекул, тому їх неможливо описати за допомогою структурних формул
Кристал натрій хлориду NaCl
Натрій і хлор одновалентні
У йонних сполуках валентність елемента
чисельно дорівнює заряду йона,
який присутній у кристалі сполуки
10.
У йонних кристалах неможливо виокремити ізольовані структури подібнодо молекул, тому їх неможливо описати за допомогою структурних формул
Кристал магній хлориду MgCl2
Магній двовалентний
і хлор одновалентний
У йонних сполуках валентність елемента
чисельно дорівнює заряду йона,
який присутній у кристалі сполуки
11.
Деякі елементи проявляють сталу валентність,інші елементи проявляють різну валентність у різних сполуках
Елементи зі сталою
валентністю
Одновалентні:
H, K, Na, Ag, F
Двовалентні:
O, Ba, Ca, Mg, Zn
Тривалентні:
Al, B
Елементи зі змінною
валентністю
Fe – II, III
Cu – I, II
As, P – III, V
Pb, Sn, C – II, IV
S – II, IV, VI
Cl, Br, I – I, III, V, VII
12.
Максимальне значення валентності елемента дорівнює номеру групи (у сполукахметалічних елементів ІА, ІІА, ІІІА груп і неметалічних елементів з оксигеном)
13.
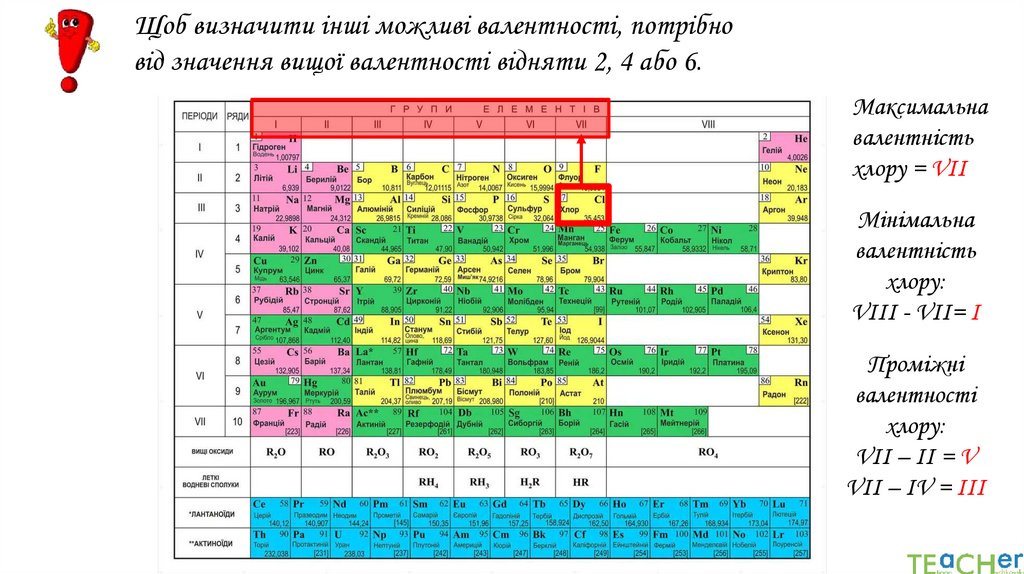
Мінімальне значення валентності дорівнює різниці між числом 8 і номером групиелемента (у сполуках неметалічних елементів з гідрогеном або металами)
Максимальна
валентність
фосфору = V
Мінімальна
валентність
фосфору:
VIII - V = ІІІ
14.
Мінімальне значення валентності дорівнює різниці між числом 8 і номером групиелемента (у сполуках неметалічних елементів з гідрогеном або металами)
Максимальна
валентність
хлору = VIІ
Мінімальна
валентність
хлору:
VIII - VIІ= І
15.
Щоб визначити інші можливі валентності, потрібновід значення вищої валентності відняти 2, 4 або 6.
Максимальна
валентність
сульфуру = VI
Мінімальна
валентність
сульфуру:
VIII - VI= ІІ
Проміжна
валентність
сульфуру:
VI – IІ = IV
16.
Щоб визначити інші можливі валентності, потрібновід значення вищої валентності відняти 2, 4 або 6.
Максимальна
валентність
хлору = VIІ
Мінімальна
валентність
хлору:
VIII - VIІ= І
Проміжні
валентності
хлору:
VII – IІ = V
VII – IV = III
17.
За відомою валентністю одного хімічного елементаможна встановити валентність інших елементів у сполуці
Молекула гідроген хлориду HCl
Молекула амоніаку
NH3
Атом гідрогену одновалентний,
атом хлору також одновалентний
N
Н
Cl
Н
Н
Н
Атом гідрогену
одновалентний,
атом нітрогену
трьохвалентний
18.
Для позначення валентності використовують римські цифриI I
I II
III I
IV II
HCl, H2O, NH3, CO2
19.
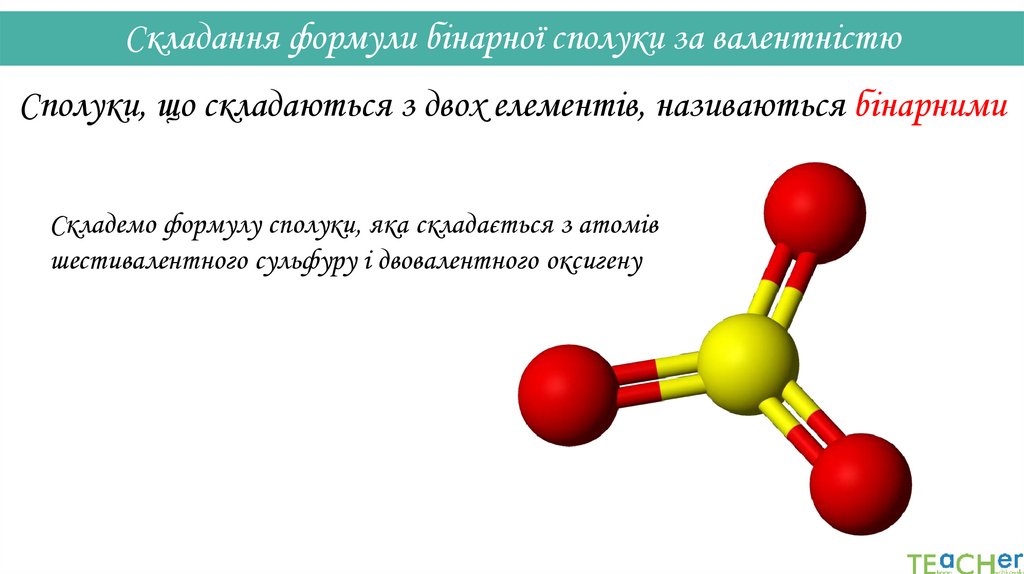
Складання формули бінарної сполуки за валентністюСполуки, що складаються з двох елементів, називаються бінарними
Складемо формулу сполуки, яка складається з атомів
шестивалентного сульфуру і двовалентного оксигену
20.
Складання формули бінарної сполуки за валентністюСполуки, що складаються з двох елементів, називаються бінарними
Аглоритм складання формул.
1. Записуємо символи у необхідному порядку
Перший спосіб
і надписуємо їхню валентність:
VІ II
SO
На першому місці пишеться символ того
елемента, який у періодичній системі
розташований лівіше або нижче
(винятки: NH3, PH3, SiH3)
21.
Складання формули бінарної сполуки за валентністюСполуки, що складаються з двох елементів, називаються бінарними
Аглоритм складання формул.
Перший спосіб
2. Знаходимо найменше спільне кратне
для значень валентностей елементів:
6
VІ II
SO
НСК (ІІІ і ІІ) = 6
22.
Складання формули бінарної сполуки за валентністюСполуки, що складаються з двох елементів, називаються бінарними
Аглоритм складання формул.
Перший спосіб
6
3. Поділимо найменше спільне кратне на
валентність кожного елемента:
VІ II
SO
6:6=1
6:2=3
23.
Складання формули бінарної сполуки за валентністюСполуки, що складаються з двох елементів, називаються бінарними
Аглоритм складання формул.
Перший спосіб
4.Записуємо індекси після символів
елементів:
6
VІ II
SO3
6:6=1
6:2=3
24.
Складання формули бінарної сполуки за валентністюСполуки, що складаються з двох елементів, називаються бінарними
Аглоритм складання формул.
Другий спосіб
1. Записуємо символи у необхідному
порядку і надписуємо їхню валентність:
VІ II
SO
25.
Складання формули бінарної сполуки за валентністюСполуки, що складаються з двох елементів, називаються бінарними
Аглоритм складання формул.
Другий спосіб
2. Записуємо валентність першого
елемента у вигляді індекса другого
елемента арабською цифрою.
VІ II
S O6
26.
Складання формули бінарної сполуки за валентністюСполуки, що складаються з двох елементів, називаються бінарними
Аглоритм складання формул.
Другий спосіб
3. Записуємо валентність другого
елемента у вигляді індекса першого
елемента арабською цифрою.
II
S 2O6
27.
Складання формули бінарної сполуки за валентністюСполуки, що складаються з двох елементів, називаються бінарними
Аглоритм складання формул.
Другий спосіб
4. Якщо індекси є парними числами, то
ділимо обидва індекси на менший:
S 2O6
2
2
28.
Складання формули бінарної сполуки за валентністюСполуки, що складаються з двох елементів, називаються бінарними
Аглоритм складання формул.
Другий спосіб
4. Записуємо отримані індекси:
S 2O63
2
2
29.
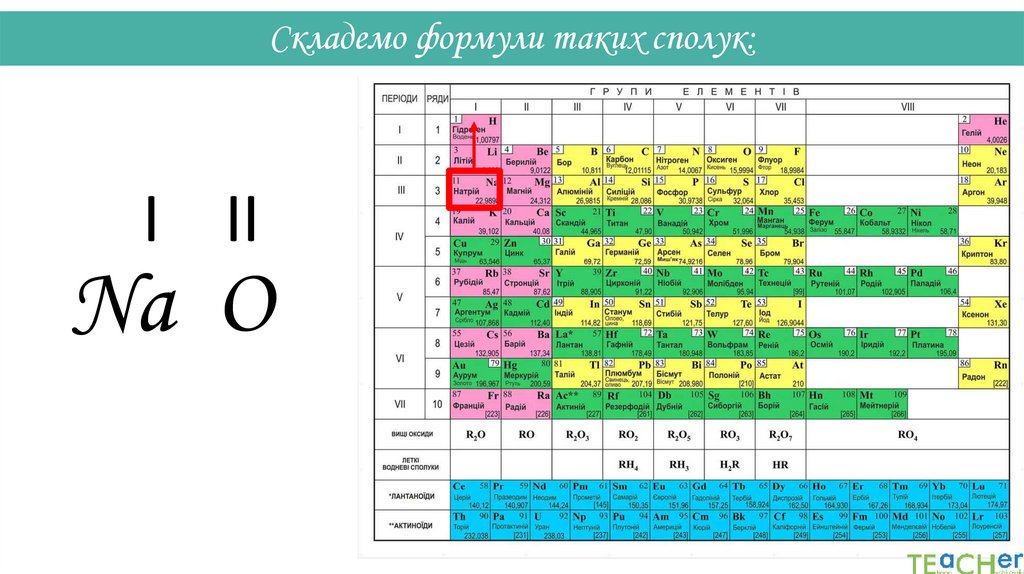
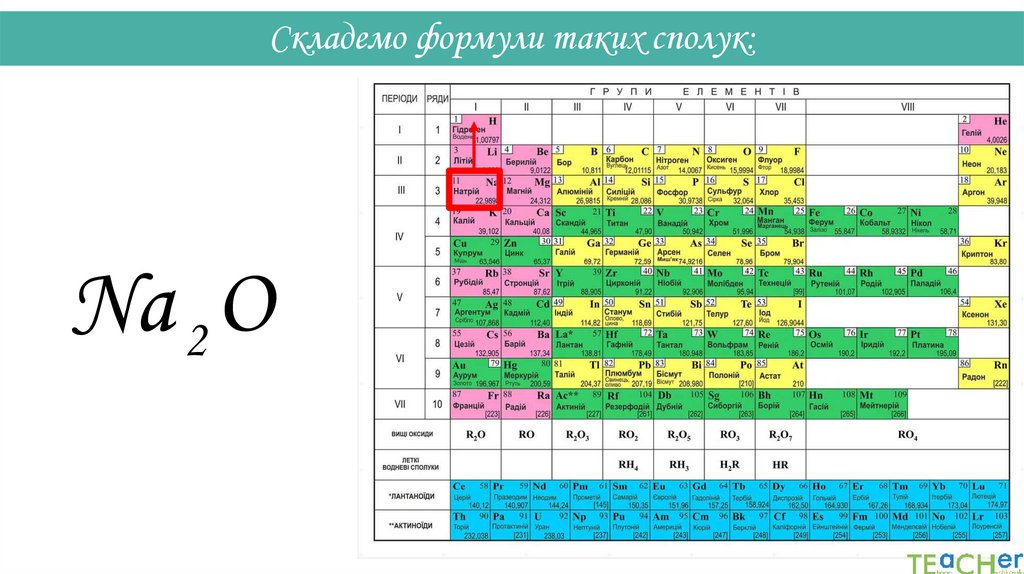
Складемо формули таких сполук:2
I
II
Na2 O
2:1=2
2:2=1
30.
Складемо формули таких сполук:I II
Na O
31.
Складемо формули таких сполук:NaII2 OI
32.
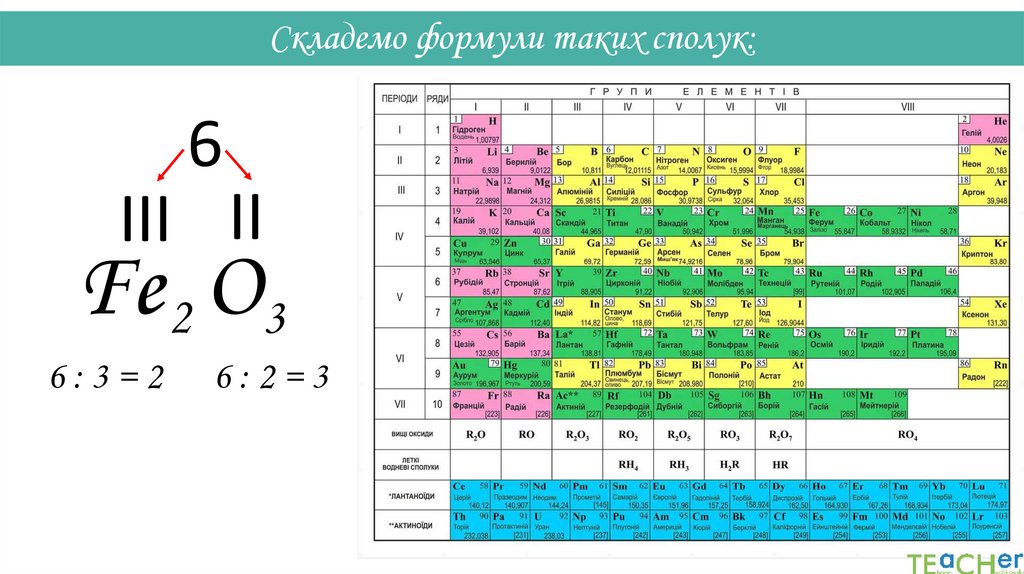
Складемо формули таких сполук:6
III II
Fe 2 O3
6:3=2
6:2=3
33.
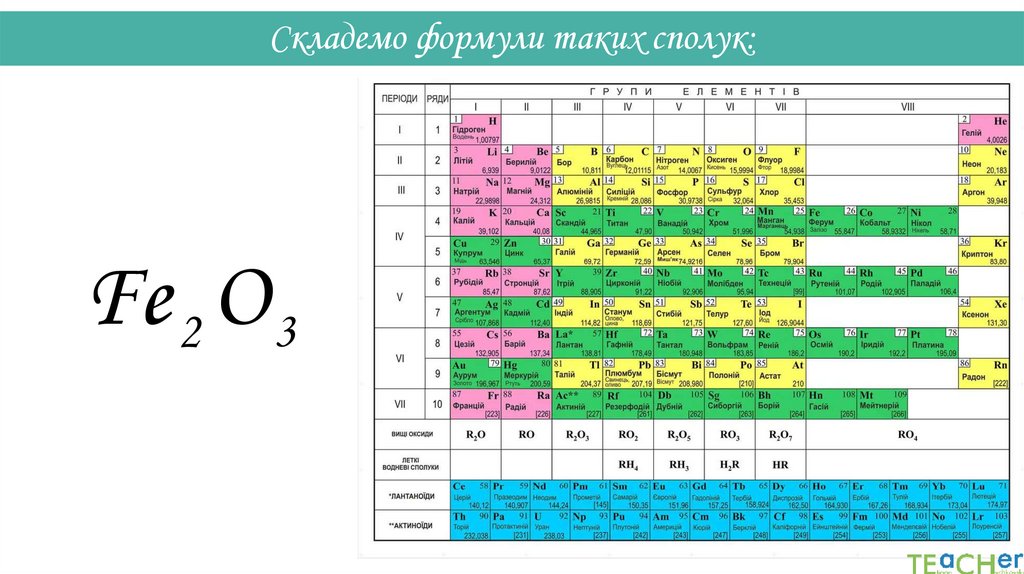
Складемо формули таких сполук:III II
Fe O
34.
Складемо формули таких сполук:Fe II2 OIII3
35.
Складемо формули таких сполук:II I
IV I
IV II
III II
Ba Cl2, C H4 , C S2 , Al2O3
36.
Назви бінарних сполук:Назва бінарних сполук складається з двох слів:
перше слово – назва першого елемента сполуки,
друге слово – основа другого елемента сполуки + суфікс -ід (-ид).
Якщо перший елемент має змінну валентність, після його символа у дужках
вказується валентність.
Н2О - гідроген оксид
СО2 - карбон (IV) оксид
MgCl2 - магній хлорид
K2S - калій сульфід
37.
Підіб’єм підсумки!1. Валентність – це число хімічних зв’язків, яке даний атом здатний утворити
з іншими атомами.
2. Валентність гідрогену дорівнює І, оксигену – ІІ, флуору – І.
3. Максимальна валентність елемента дорівнює номеру групи, мінімальна –
для неметалів дорівнює різниці числа 8 і номеру групи, у якій стоїть елемент.
4. У формулах бінарних сполук на першому місці ставлять символ елементів,
які у періодичній системі розміщені лівіше або нижче, на другому – які правіше
або вище (винятки: NH3, PH3, SiH3).






























 Химия
Химия








