Похожие презентации:
Соли аммония
1. СОЛИ АММОНИЯ
ТЕСТРешите альтернативный тест –
выбор правильного ответа из
множества.
I вариант выбирает правильные ответы
для азота,
II вариант - для аммиака:
2. ТЕСТ
1. Газообразный при обычных условиях.2.Не имеет запаха.
3.Бесцветный.
4.Степень окисления азота -3
5. Взаимодействует с кислотами с образованием солей
6. В молекуле между атомами ковалентная полярная связь
7. Взаимодействует с водородом в присутствии катализатора
8. Он является важнейшим биогенным элементом.
9. Он проявляет только восстановительные свойства
10. В атмосфере этого газа хранят рукописи
11. Жидкий … прекрасное азотное удобрение.
12. Легче воздуха.
13. Используют в медицине.
14. Хорошо растворим в воде.
15. Инертный газ.
3.
Взаимопроверкаазот
аммиак
1,2,3,7,8,10,12,13,15
1,3,4,5,6,9,11,12,13,14
4. Взаимопроверка
Первая мировая война.Морское сражение немцев с англичанами.
5.
Тема урока «Соли аммония»Во время I мировой войны английский крейсер вел
преследование поврежденного в бою немецкого
эсминца. Цель была почти достигнута, как вдруг
между кораблями появилось плотное белое облако
дыма. Экипаж крейсера почувствовал удушливый
запах, раздражающий горло и легкие. Крейсер был
вынужден дать задний ход и выйти из дымового
облака. Уже после обнаружили, что пострадали не
только люди, но и металлические части корабля.
Что это было за вещество?
6. Тема урока «Соли аммония»
7. Тема урока «Соли аммония»
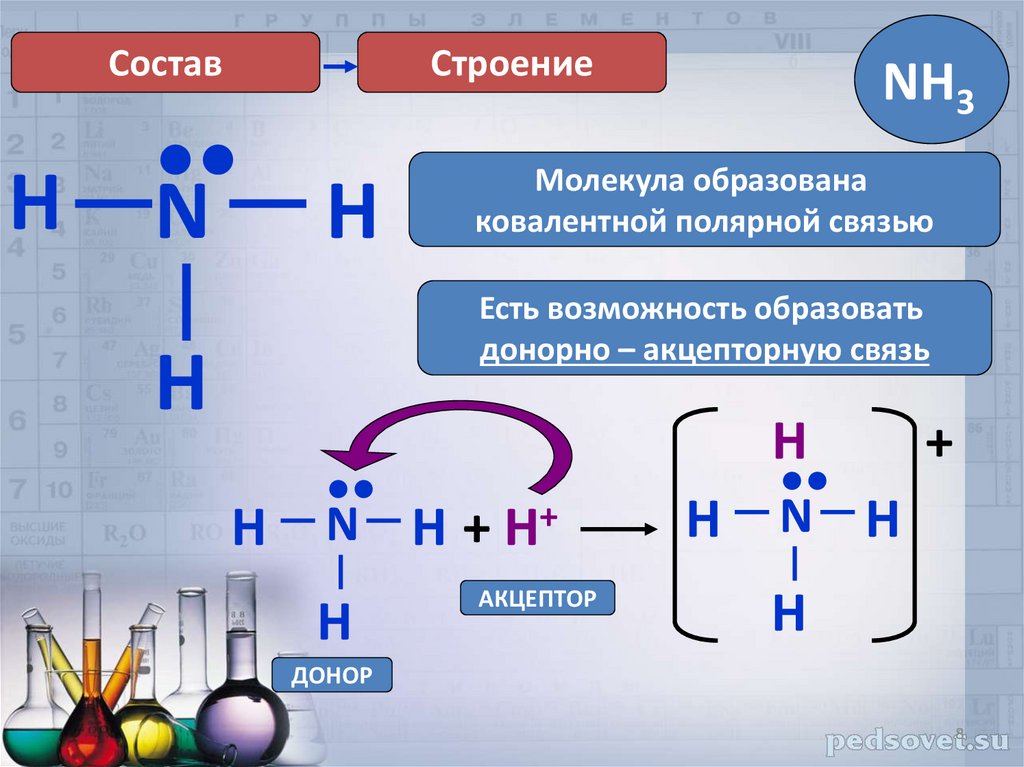
СоставH
Строение
•
N
H
NH3
Молекула образована
ковалентной полярной связью
Есть возможность образовать
донорно – акцепторную связь
H
H
•
N H + H+
H
АКЦЕПТОР
H
H
•
N H
+
H
ДОНОР
8
8.
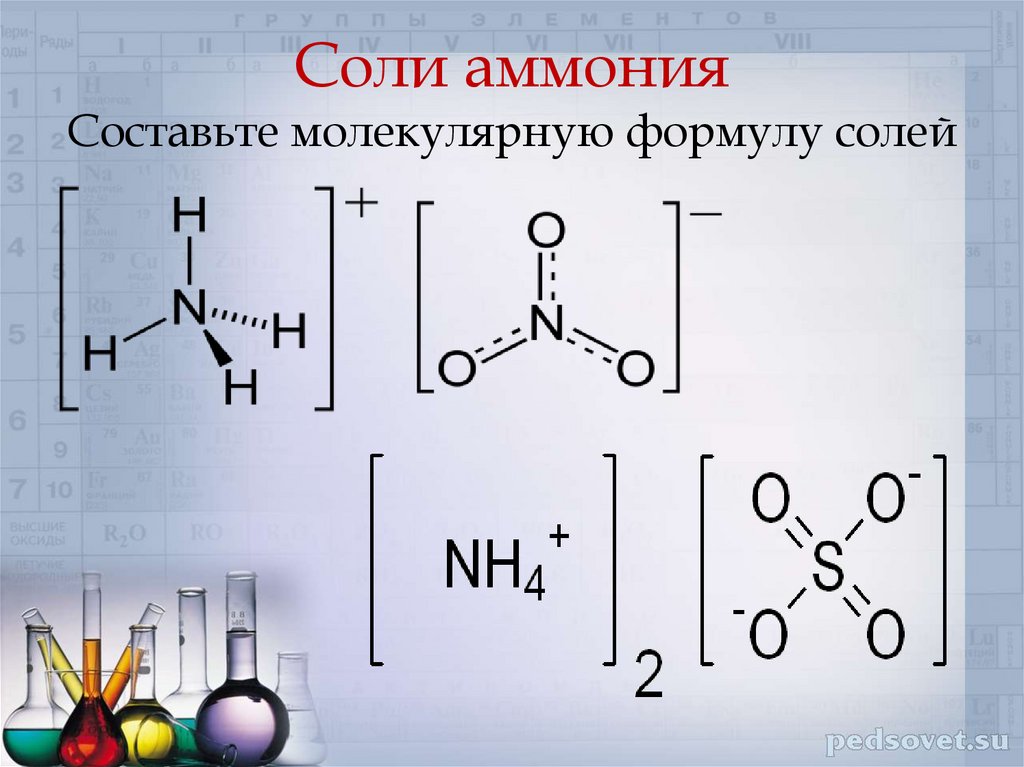
Соли аммонияСоставьте молекулярную формулу солей
9. Соли аммония Составьте молекулярную формулу солей
Физические свойства солейаммония.
а) твёрдые вещества;
б) имеют кристаллическое строение (ионные
кристаллические решётки);
в) хорошо растворимые в воде.
10. Физические свойства солей аммония.
Химические свойства солейаммония
Вспомните правила Т/Б!
11. Химические свойства солей аммония
Химические свойства солейаммония.
1. Взаимодействие с солями.
хлорид аммония + нитрат серебра
NH4Cl + AgNO3 NH4NO3 + AgCl
NH4+ + Cl- + Ag+ + NO3- NH4+ + NO3- + AgCl
Cl- + Ag+ AgCl
12. Химические свойства солей аммония.
Сульфат аммония + хлорид бария(NH4)2SO4 + BaCl2 2NH4Cl + BaSO4
2NH4 ++SO42- + Ba2+ +2Cl - 2NH4 + +2Cl - + BaSO4
Ba2+ + SO42- BaSO4
13.
2. Взаимодействие с кислотами.Карбонат аммония + соляная кислота
(NH4 )2СО3 + 2HCl 2NH4Cl + CO2 + H2O
2NH4 + + СО32- + 2H ++2Cl- 2NH4 + + 2Cl- + CO2 + H2O
СО32- + 2H + CO2 + H2O
14.
3. Взаимодействие с щелочами.NH4Cl+ NaOH NH3 + H2O + NaCl
Взаимодействие с щелочами – это
качественная реакция на соли аммония
(признак реакции: выделение газа с характерным
запахом, окрашивающий влажную лакмусовую
бумажку в синий цвет)
15.
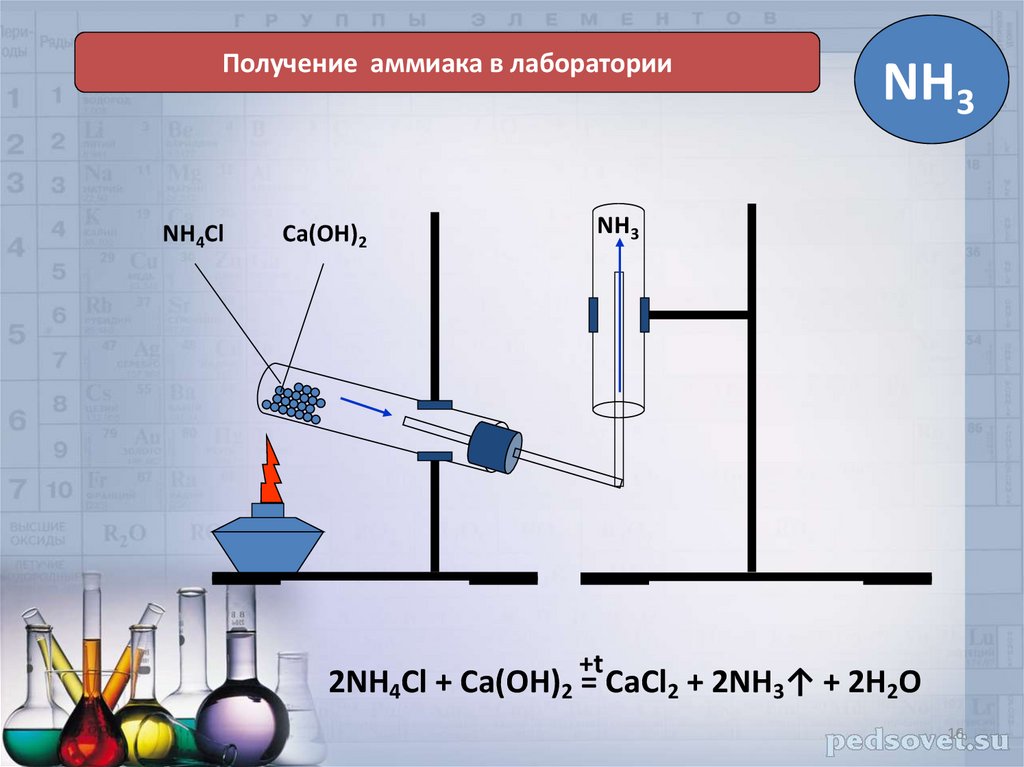
Получение аммиака в лабораторииNH4Cl
Ca(OH)2
NH3
NH3
+t
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
16
16.
4. Термическое разложение.Все аммонийные соли при нагревании разлагаются.
(NH4)2CO3 = 2NH3 + H2O + CO2
NH4Cl
NH3 + HCl
NH4NO2 = 2H2O + N2
(NH4)2Cr2O7 = Cr2O3 + 4H2O + N2
соли летучих
кислот
соли
кислот
окислителей
17.
Получение солей аммония• Получают их при взаимодействии NH3 или
NH4 OH с кислотами:
NH3 + HCl = NH4 Сl
NH3+HNO3→NH4 NO3
2NH4 OH+H2 SO4→(NH4)2 SO4+2Н2O
18. Получение солей аммония
Применение солейаммония.
19. Применение солей аммония.
Русский химик Д.Н ПрянишниковСоли аммония
Азотные удобрения
20.
Аммиачная селитра(нитрат аммония)
- прекрасное азотное удобрение.
NH4NO3
21. Аммиачная селитра (нитрат аммония) - прекрасное азотное удобрение.
Аммиачная селитра(нитрат аммония)
– взрывчатое вещество.
22. Аммиачная селитра (нитрат аммония) – взрывчатое вещество.
Смесь нитрата аммония с алюминием иуглем - аммонал (взрывные работы, в
пиротехнике)
23.
Нашатырь (хлорид аммония)• Паяние, лужение
металлов
Хлорид аммония NH4Cl
используют при паянии, так как
он очищает поверхность
металла от оксидной плёнки и
к ней хорошо пристаёт припой.
• Изготовление
гальванических
элементов
24. Нашатырь (хлорид аммония)
Гидрокарбонат аммонияNH4HCO3 и карбонат
аммония (NH4)2CO3
применяют в кондитерском деле,
так как они легко разлагаются при
нагревании и образуют газы,
разрыхляющие тесто и делающие
его пышным, например:
NH4HCO3 = NH3↑ + Н2O↑ + CO2↑
25.
Знаете ли вы...Теннисные мячи не надувают, а вводят в
них
«вздуватели»
специальные
вещества, которые при нагревании
разлагаются
с
образованием
газообразных продуктов. В теннисные
мячи (заготовки которых в виде двух
полусфер изготовлены предварительно и
смазаны
клеем)
кладут
таблетки,
содержащие смесь нитрита натрия и
хлорида аммония. Склеенные половинки
мяча
помещают
в
форму
для
вулканизации и нагревают. Выделившийся
азот создает в мяче повышенное
давление.
26. Знаете ли вы...
Задания на развитие творческогомышления
•Объясните, можно ли весной вносить в
почву аммиачную селитру (нитрат
аммония) с известью?
27. Задания на развитие творческого мышления
Повторим:1.Выбрать и назвать соли аммония
NaNO3
H2SO4
NH4HSO4
K2CО3
(NH4)2CО3
H3PО4
NaCL
AgNO3
Ca(OH)2
NH4Cl
HNO3
NH4H2PО4
CaCl2
(NH4)2SO4
H2S
NH4NO3
H2SiO3
(NH4)2S
2. Перечислите химические свойства
солей аммония.
3. Назовите физические свойства
солей аммония.
28. Повторим:
V. Домашнее задание.§26.
Составить уравнения реакций, с помощью которых можно
осуществить превращения:
N2 NH3 (NH4)3РO4 NH4Cl NH4NO3
Составьте полное и краткое ионные уравнения для
превращений 3 и 4.
Для превращения 1 (окислительно–восстановительная
реакция)
расставьте
коэффициенты
методом
электронного баланса.

























 Химия
Химия








