Похожие презентации:
Углеводороды
1.
Презентация учителя школы №383Г. Санкт-Петербурга
Виноградовой Н. В.
По теме:
УГЛЕВОДОРОДЫ
2.
План презентации:•Понятие «Углеводороды»
•Классификация углеводородов
•Основные гомологические ряды
•Типичные представители рядов
•Общие химические свойства
углеводородов
•Типичные реакции алканов
•Типичные реакции непредельных
углеводородов
3.
Уже название этого класса веществявляется описанием их качественного
состава:
«Углеводороды» - вещества, состоящие из
атомов углерода и атомов водорода.
Общая формула: CxHy
Соотношение между количеством атомов углерода и
количеством атомов водорода разное в разных
гомологических рядах углеводородов.
4.
В зависимости от строенияуглеводороды бывают:
•линейными и разветвленными;
•ациклическими и карбоциклическими.
5.
В зависимости от строения, аименно: от количества и вида
кратных связей в молекуле
углеводороды делят на
гомологические ряды.
Важнейшие из гомологических рядов
ациклических углеводородов:
•Алканы
•Алкены
•Алкадиены
•Алкины
6.
Краткое представление об этихгомологических рядах можно
представить схемой:
Нециклические углеводороды CxHy
Алканы
Алкены
Алкадиены
Алкины
CnH2n+2,где
n=1,2,…
CnH2n, где
n=2,3,…
CnH2n-2, где
n=(3)4,5,…
CnH2n-2,
где
n=2,3,…
7.
Чуть подробнее это можнорассмотреть в таблице:
Гомологический
ряд УВ
Алканы
Алкены
Алкадиены
Алкины
Общая
формула
CnH2n+2, где
n=1,2,…
CnH2n, где
n=2,3,…
CnH2n-2, где
n=(3),4,…
CnH2n-2, где
n=2,3,…
Кратные связи
Нет
Одна
двойная
Две двойные
Одна
тройная
У всех
атомов
углерода sp3
У атомов
углерода,
связанных
двойной
связью sp2 ,
у остальных
sp3
У атомов
углерода,
связанных
двойной
связью sp2 ,
у остальных
sp3
У атомов
углерода,
связанных
тройной
связью sp , у
остальных
sp3
Гибридизация
атомов
углерода
8.
Типичнымипредставителями алканов
являются:
метан CH4
и
этан CH3-CH3
Все атомы в их молекулах связаны прочными одинарными
связями. Поэтому присоединение к алканам невозможно.
9.
Типичными представителяминепредельных углеводородов
являются:
для гомологического ряда
алкенов
этилен (этен)
CH2=CH2
для гомологического ряда
алкинов
ацетилен (этин) CH=CH
10.
Из гомологического рядаалкадиенов наибольший интерес
в связи с особенностями
строения и практическим
применением имеют
сопряженные алкадиены, в молекулах
которых происходит чередование: двойная
связь – одинарная связь – двойная связь
между атомами углерода.
Типичный сопряженный алкадиен это дивинил (бутадиен-1,3)
CH2=CH-CH=CH2
Правда изображение двойных и
одинарных связей, как Вы
узнаете дальше, в этом случае
условно.
11.
Для всех углеводородов характерныхимические реакции:
• горение (реакция быстрого
окисления углеводорода кислородом
воздуха, при этом водород
окисляется до воды, а углерод –
до углекислого газа, угарного газа
или сажи; в последнем случае
говорят о коптящем пламени);
• полное ( до простых веществ
сажа и водород) и неполное (с
частичным отщеплением водорода)
термическое разложение.
12.
Рассмотрим эти реакции на примереэтана C2H6 и этилена C2H4.
1) Горение до углекислого газа и воды
t
2C2H6+7O2 → 4CO2+6H2O
t
C2H4+3O2 →
2CO2+2H2O
2) Полное термическое разложение до сажи и
водорода
t
C2H6 → 2C+3H2
t
C2H4 → 2C+2H2
Так как при этом в молекулах углеводородов разрушаются
все химические связи, графические формулы в уравнениях
реакций излишни.
13.
При неполном термическом разложенииотщепляются часть атомов водорода,
появляются дополнительные π-связи
между атомами углерода, и
увеличивается непредельность вещества.
•Разложение этилена до ацетилена и водорода:
•Двухстадийное разложение этана до этилена и
водорода с последующим разложением образовавшегося
этилена:
14.
В каких же реакциях (кромерассмотренных ранее) участвуют
алканы?
Типичным является замещение атомов
водорода на другие атомы и группы атомов.
По типу замещения проходят реакции:
•с галогенами на свету – реакция галогенирования
CH4+Cl2 → CH3-Cl+HCL
•С горячей концентрированной азотной кислотой – реакция
нитрования (или реакция Коновалова)
CH4+HO-NO2 → CH3-NO2+H2O
15.
Помимо замещения атомовводорода алканы могут:
Участвовать в реакциях крекинга (с разрывом σсвязи между атомами углерода под термическим
воздействием) и изомеризоваться при
нагревании с катализатором.
Правда для участия в этих реакциях в молекуле алкана
должно быть достаточно (не менее трех для крекинга и не
менее четырех для изомеризации) атомов углерода.
16.
Какие же реакции характерны длянепредельных углеводородов?
Несмотря на то, что двойная связь прочнее, чем
одинарная, а тройная связь прочнее, чем двойная,
в молекулах непредельных углеводородов есть
«слабое место».
Дело в том, что в состав кратных связей входят
как прочные σ-связи, образованные гибридными
орбиталями атомов углерода, так и непрочные
π-связи, образованные негибридными pорбиталями.
17.
Непрочность π-связей и определилатипичные реакции непредельных
углеводородов.
Согласно русской поговорке: «Где тонко, там и
рвется», непредельные углеводороды активно
участвуют в реакциях присоединения по месту
разрыва π-связей.
Какие же частицы будут к ним присоединятся?
При нормальных условиях происходит
присоединение галогенов и галогеноводородов.
18.
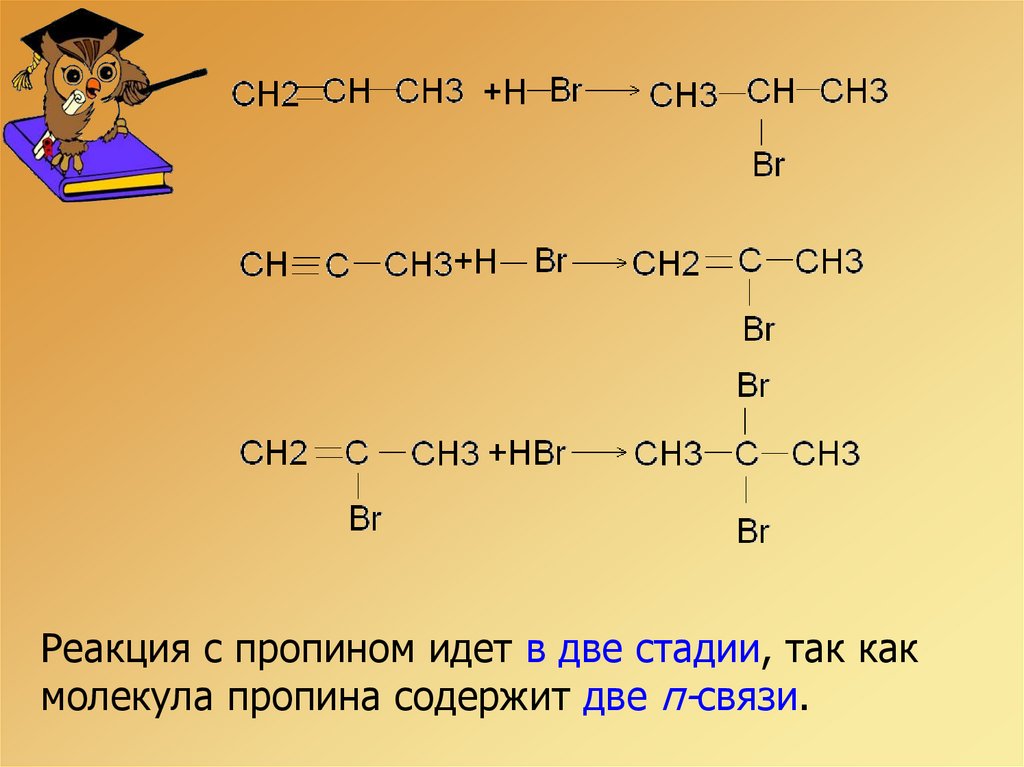
Рассмотрим эти реакции на примерепропена и пропина.
19.
Реакция с бромом интереснатем, что она качественная на
наличие в молекуле π-связей
между атомами углерода.
Так как продукты присоединения брома к
органическому веществу бесцветны,
обесцвечивание бромной воды при добавлении ее
к органическому веществу неизвестного строения
является доказательством наличия в его молекуле
π-связей между атомами углерода.
20.
Реакция с пропином идет в две стадии, так какмолекула пропина содержит две π-связи.
21.
Реакция с водой требуетдополнительных условий.
Алкены присоединяют воду при нагревании с
катализатором (неорганической кислотой), для
газообразных алкенов реакцию проводят под
давлением.
Рассмотрим этот процесс опять на примере
пропена:
22.
Логично было бы предположить,что алкины будут присоединять две
молекулы воды с поочередном
разрывом двух π-связей.
Однако это не так.
Сначала к молекуле алкина в присутствии
катализатора – раствора соли ртути (II) в
кислой среде – присоединяется молекула воды,
после этого происходит перегруппировка
атомов, и образовавшийся непредельный спирт
превращается в кетон (или - в случае с
ацетиленом – в альдегид).
23.
Так пропин сначала образуетнепредельный спирт пропенол-2,
который перегруппировывается в
кетон ацетон.
Конечный продукт является
кислородсодержащим карбонильным
органическим соединением.
24.
Если Вы внимательно рассмотрелипродукты присоединения
бромоводорода и воды к пропену и
пропину, то обратили внимание, что
атом водорода присоединился к
первому атому углерода, а атом
брома и гидроксильная группа –
ко второму.
Такое присоединение не случайно. В таких
реакциях непредельные углеводороды
несимметричного строения присоединяют
преимущественно согласно правилу
Марковникова.
25.
ПравилоМарковникова:
«При присоединении к алкену
несимметричного строения
водород присоединяется к более
гидрированному атому углерода,
то есть к атому, при котором уже
находится больше атомов
водорода…»
26.
Вышеперечисленными реакциямитипичные химические свойства
непредельных углеводородов не
ограничиваются.
В дальнейшем Вы изучите:
•реакцию гидрирования
•реакцию окисления
•и, несомненно, реакцию полимеризации
А также выясните, что такое явление
сопряжения и как оно повлияло на свойства
сопряженных алкадиенов.
27.
Успехов в изучениихимии углеводородов!
Спасибо за внимание!

























 Химия
Химия








