Похожие презентации:
Непредельные углеводороды: алкены
1. НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
АлкеныДиены (Алкадиены)
Алкины
2.
Непредельные углеводороды —углеводороды с открытой цепью, в
молекулах которых между атомами
углерода имеются двойные или
тройные связи.
Алкены
CnH2n
Диены (алкадиены)
CnH2n-2
Алкины
CnH2n-2
3. Гомологические ряды
• К непредельным углеводородам принадлежитнесколько гомологических рядов: этилена
(алкены), ацетилена (алкины), диены.
• Ряд этилена (алкены) общая формула СnН2n .
Число связей: одна двойная связь.
• Диеновые углеводороды (алкадиены) общая
формула СnН2n-2 . Число связей: две двойные
связи.
• Ряд ацетилена (алкины) общая формула
СnH2n-2 . Число связей: одна тройная связь.
4. Источники непредельных углеводородов
Непредельные углеводороды могут бытьполучены из предельных путём
каталитического отщепления водорода
(реакция дегидрирования, или
дегидрогенизации). Например, из этана,
содержащегося в попутном нефтяном газе,
получают этилен, из бутана —
бутадиен; изопрен может быть получен
дегидрированием изопентана. Непредельные
углеводороды образуются из предельных
при крекинге нефтяных продуктов.
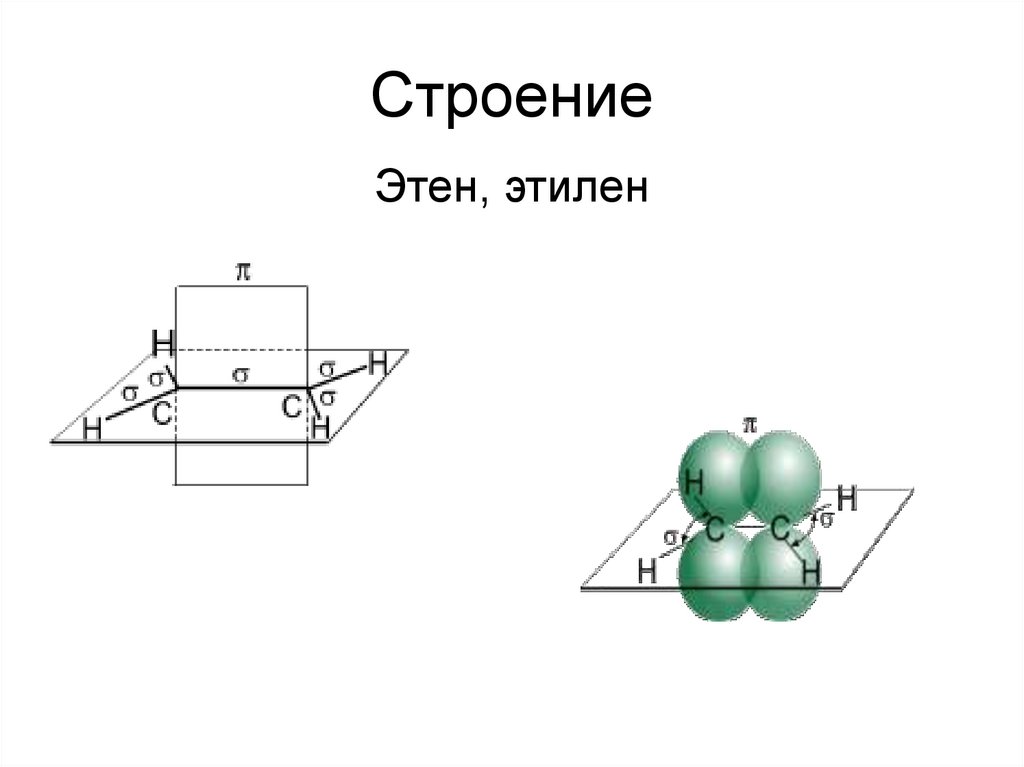
5. Строение
Углеродные атомы вмолекуле этилена находятся в
состоянии sp2- гибридизации,
т.е. в гибридизации участвуют
одна s- и две p -орбитали.
6. Строение
Этен, этилен7. Изомерия
Как и для предельных углеводородов,для непредельных характерна
структурная изомерия.
Существует межклассовая изомерия:
между алкенами и циклоалканами,
между алкинами и алкадиенами.
8. Виды изомерии
• Структурная:• изомерия углеродного скелета,
• изомерия положения заместителя или
кратной связи.
• Пространственная (геометрическая или цистранс; для алкенов и алкадиенов).
Межклассовая (например: алкены и
циклоалканы или алкины и алкадиены).
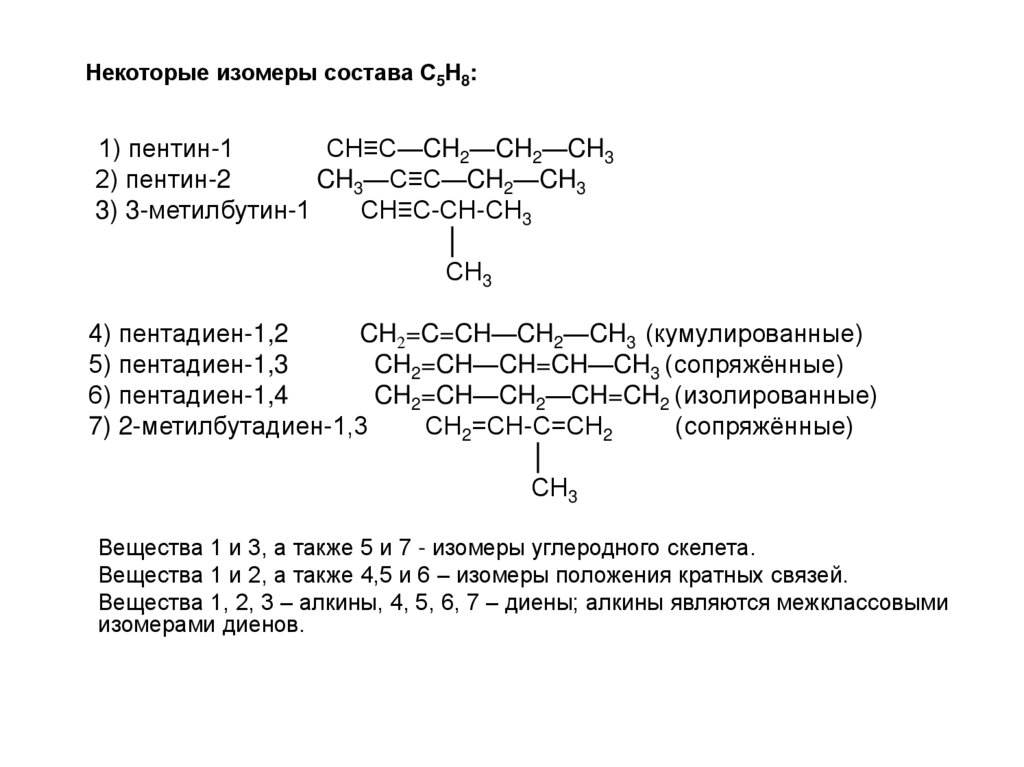
9.
Некоторые изомеры состава C5H8:1) пентин-1
CH≡C—CH2—CH2—CH3
2) пентин-2
CH3—C≡C—CH2—CH3
3) 3-метилбутин-1
СН≡С-СН-СН3
│
СН3
4) пентадиен-1,2
CH2=C=CH—CH2—CH3 (кумулированные)
5) пентадиен-1,3
CH2=CH—CH=CH—CH3 (сопряжённые)
6) пентадиен-1,4
CH2=CH—CH2—CH=CH2 (изолированные)
7) 2-метилбутадиен-1,3
СН2=СН-С=СН2
(сопряжённые)
│
СН3
Вещества 1 и 3, а также 5 и 7 - изомеры углеродного скелета.
Вещества 1 и 2, а также 4,5 и 6 – изомеры положения кратных связей.
Вещества 1, 2, 3 – алкины, 4, 5, 6, 7 – диены; алкины являются межклассовыми
изомерами диенов.
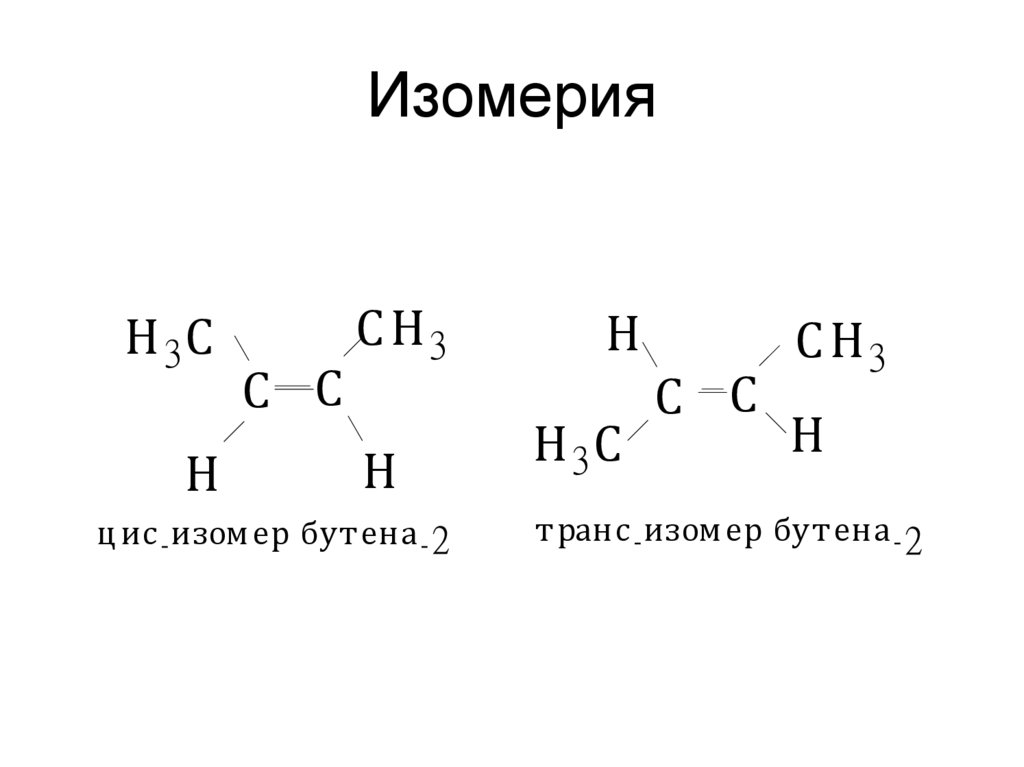
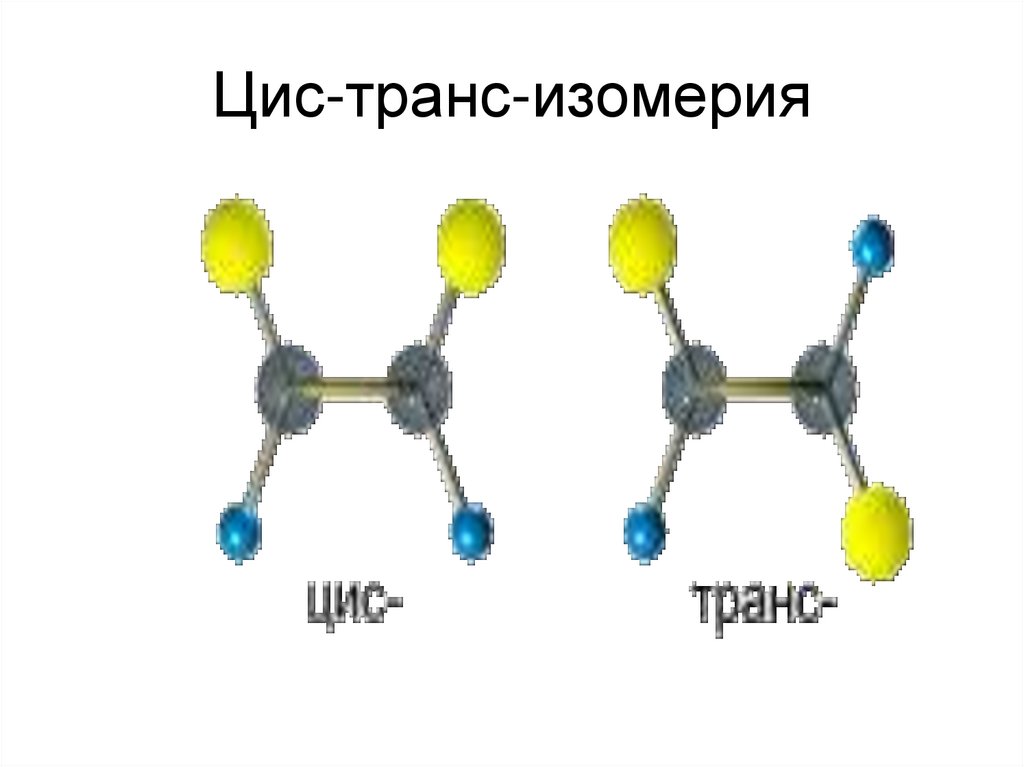
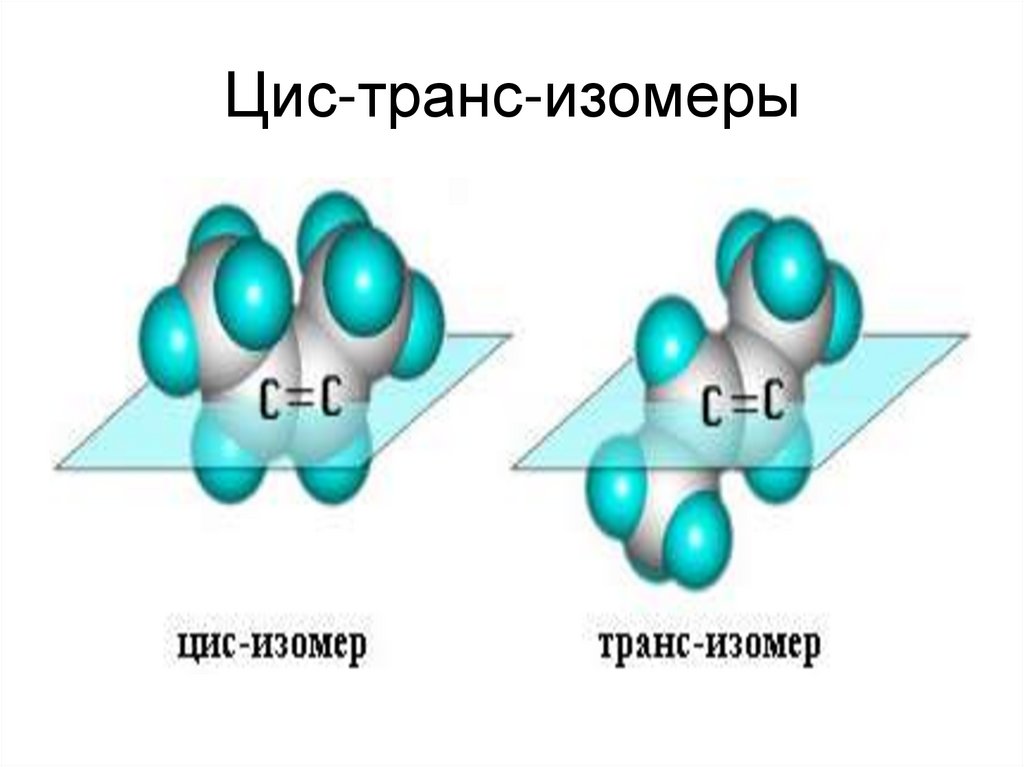
10. Изомерия
Для алкенов характерносуществование цис- транс- изомеров.
Такие изомеры образуются в том
случае, если каждый из двух атомов
углерода, связанных двойной связью,
имеет четыре разных заместителя, но
при этом два из этих четырех
заместителей одинаковы.
11. Изомерия
Н3СН
С С
С Н3
Н
ц ис-изом ер бут ена-2
Н
Н3С
С С
С Н3
Н
т ранс-изом ер бут ена-2
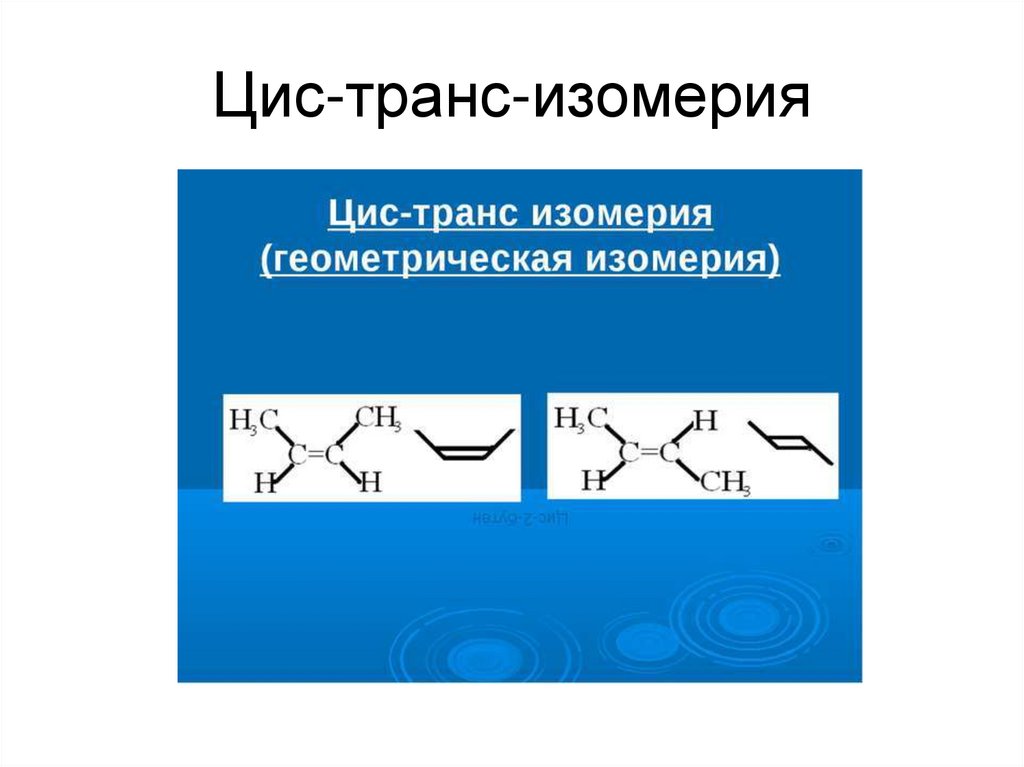
12. Цис-транс-изомерия
13. Цис-транс-изомерия
14. Цис-транс-изомеры
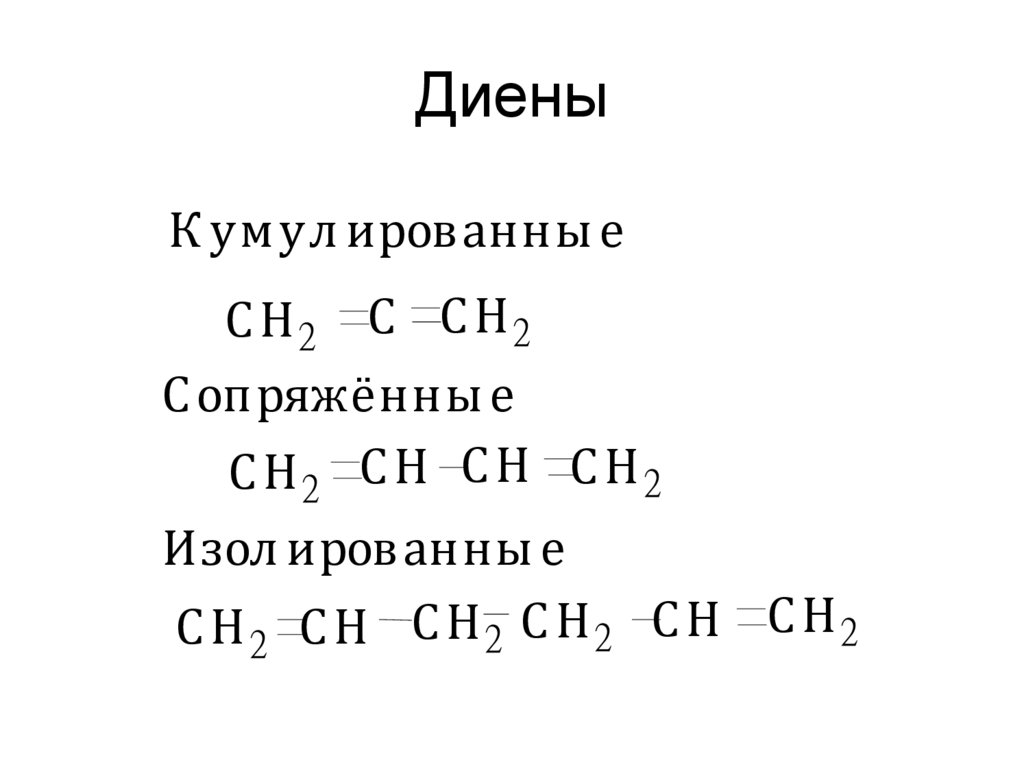
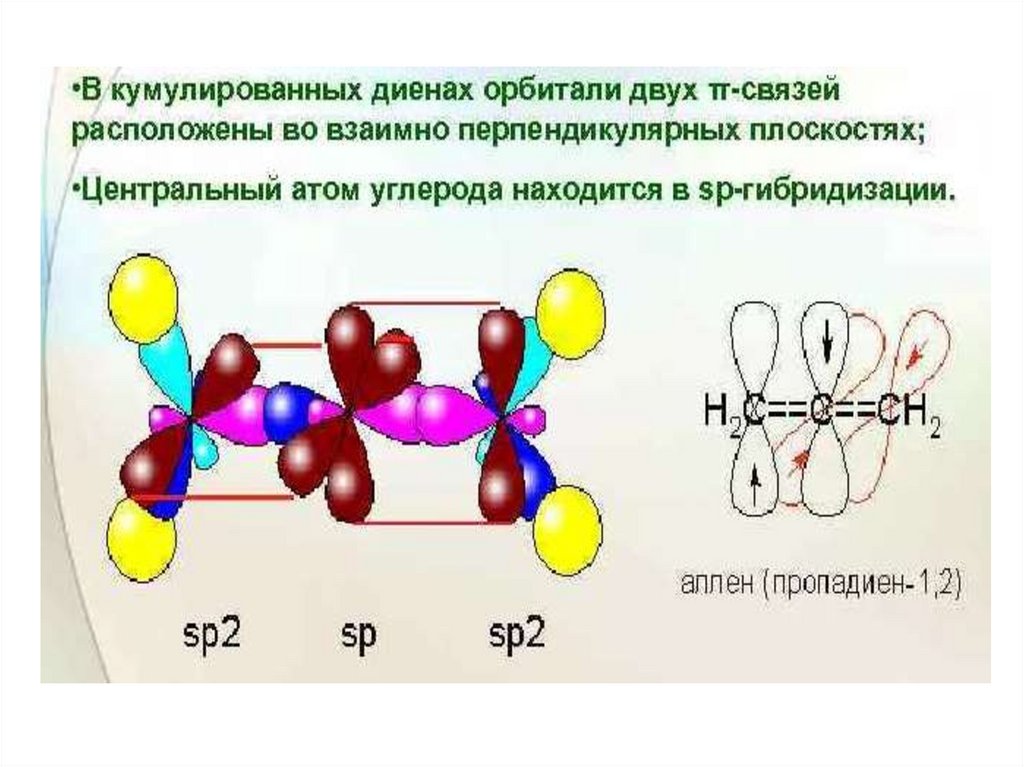
15. Диены
К умул ированны еС Н2 С С Н2
С оп ряжённы е
С Н2 С Н С Н С Н2
Изол ированны е
С Н2 С Н С Н2 С Н2 С Н С Н2
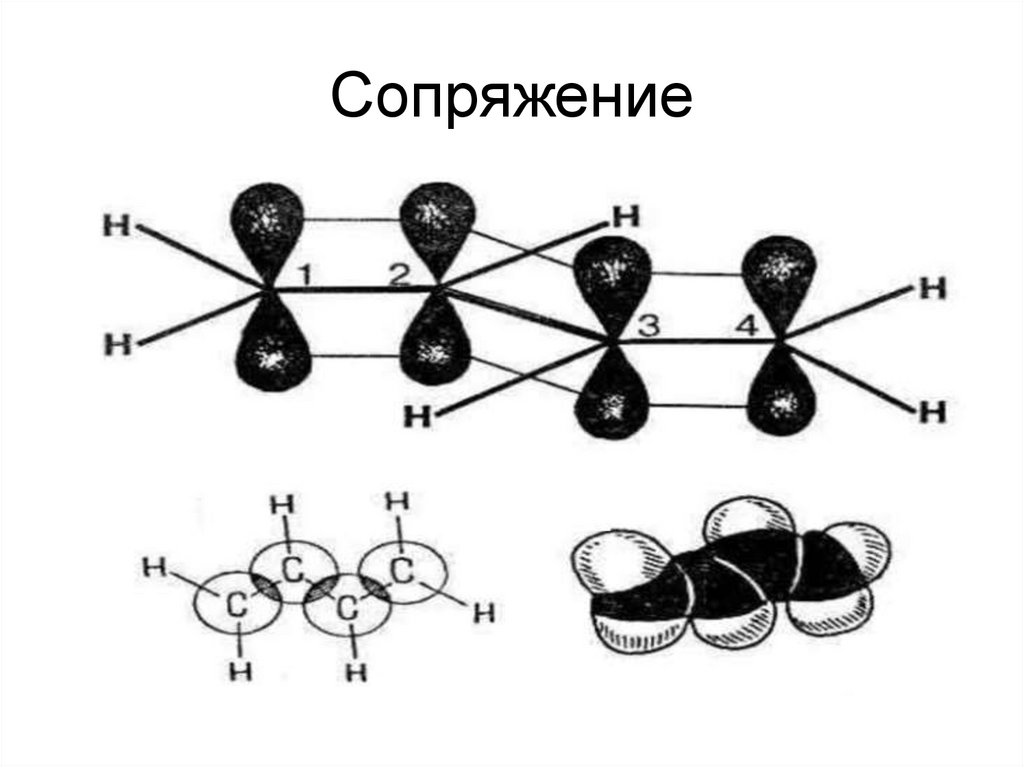
16. Сопряжение
17.
18. Физические свойства
По физическим свойствам этиленовыеуглеводороды близки к алканам. При
нормальных условиях углеводороды
C2–C4 – газы,
C5–C17 – жидкости,
высшие представители – твердые вещества.
Температура их плавления и кипения, а также
плотность увеличиваются с ростом
молекулярной массы. Все олефины легче
воды, плохо растворимы в ней, однако
растворимы в органических растворителях.
19. Химические свойства
Участие в реакциях :присоединения
окисления
полимеризации
Алкены значительно более активны,
чем алканы, из-за наличия в молекулах
не очень прочных π-связей.
20. Реакция присоединения
21. Галогенирование
Алкены реагируют с бромом и хлором собразованием продуктов присоединения
по двойной связи одной молекулы
галогена с выходом близким к
количественному.
Фтор слишком активен и вызывает
деструкцию алкенов.
Присоединение йода к алкенам в
большинстве случаев представляет собой
обратимую реакцию, равновесие которой
смещено в сторону исходных реагентов.
22. Качественная реакция на непредельные углеводороды
Быстрое обесцвечиваниераствора брома в СCl4 служит
одним из простейших тестов
на ненасыщенность,
поскольку и алкены, и
алкины, и диены быстро
реагируют с бромом.
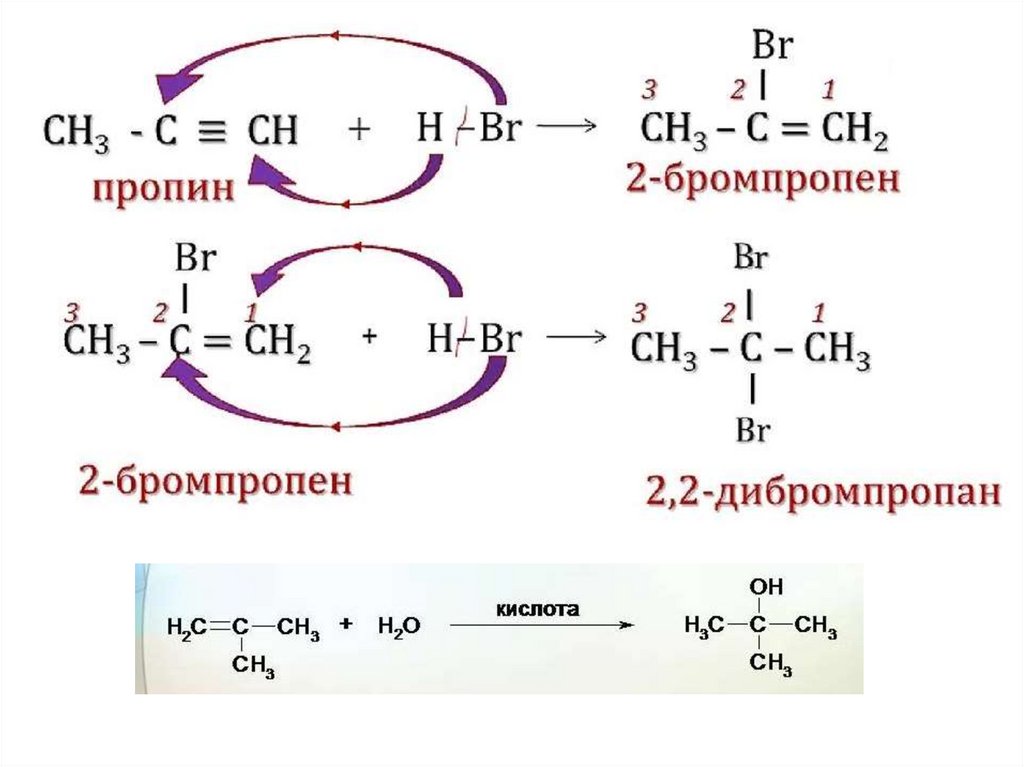
23. Правило Марковникова В.В.
Присоединение к несимметричным алкенаммолекул галогеноводородов и воды протекает
в соответствии с
правилом Марковникова В.В.:
при присоединении галогеноводородов или
воды к несимметричным алкенам или
алкинам атом водорода присоединяется к
наиболее гидрогенизированному
(гидрированному) углеродному атому (т.е. к
атому С, связанному с большим числом
атомов Н), а атом галогена (или группа –ОН)
– к наименее гидрогенизированному.
24.
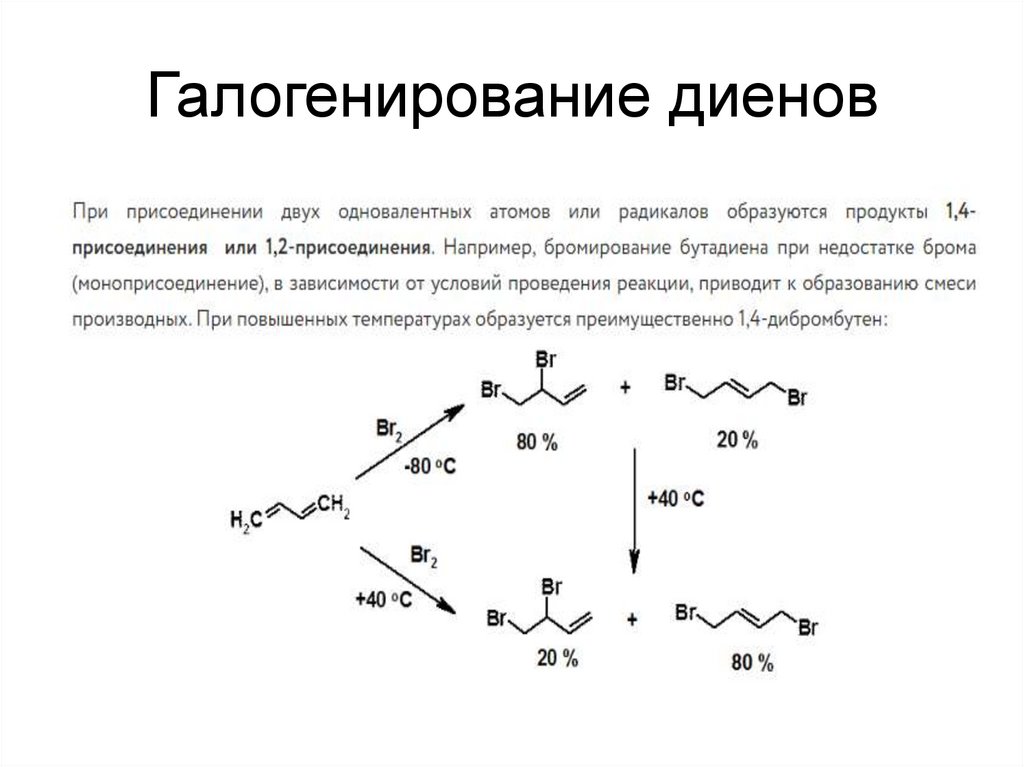
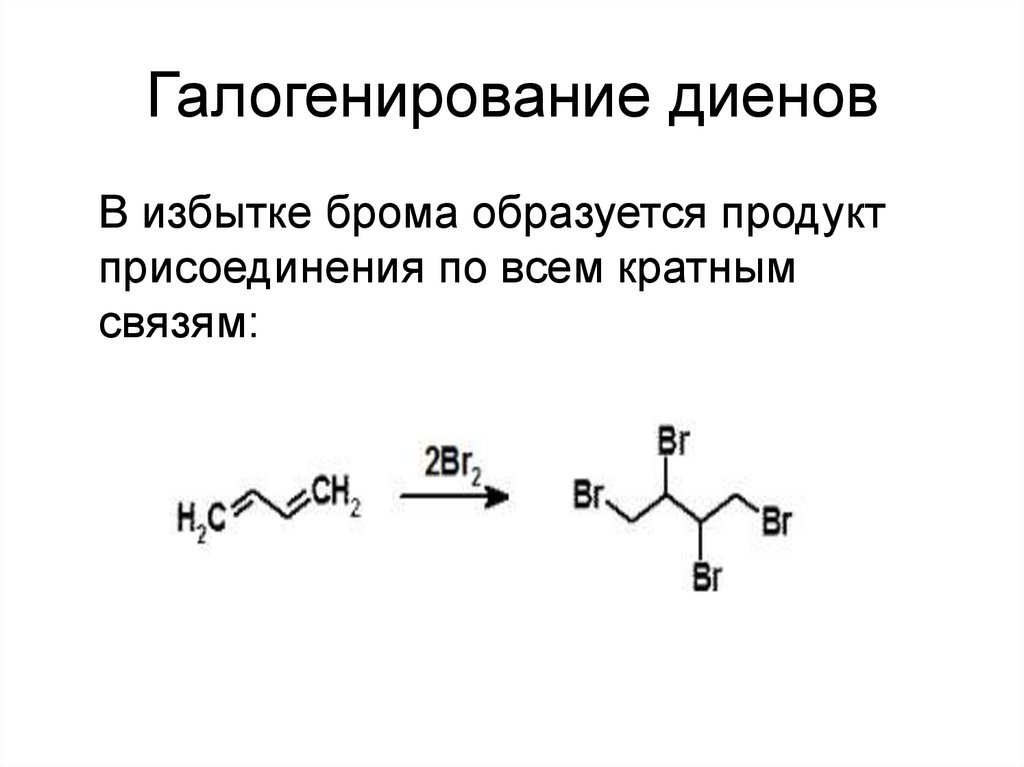
25. Галогенирование диенов
26. Галогенирование диенов
В избытке брома образуется продуктприсоединения по всем кратным
связям:
27. Окисление
Различают окисление в- жестких условиях – с разрушением
молекулы исходного углеводорода по
месту кратной связи;
- мягких условиях – с сохранением
исходного углеродного скелета (реакция
Вагнера).
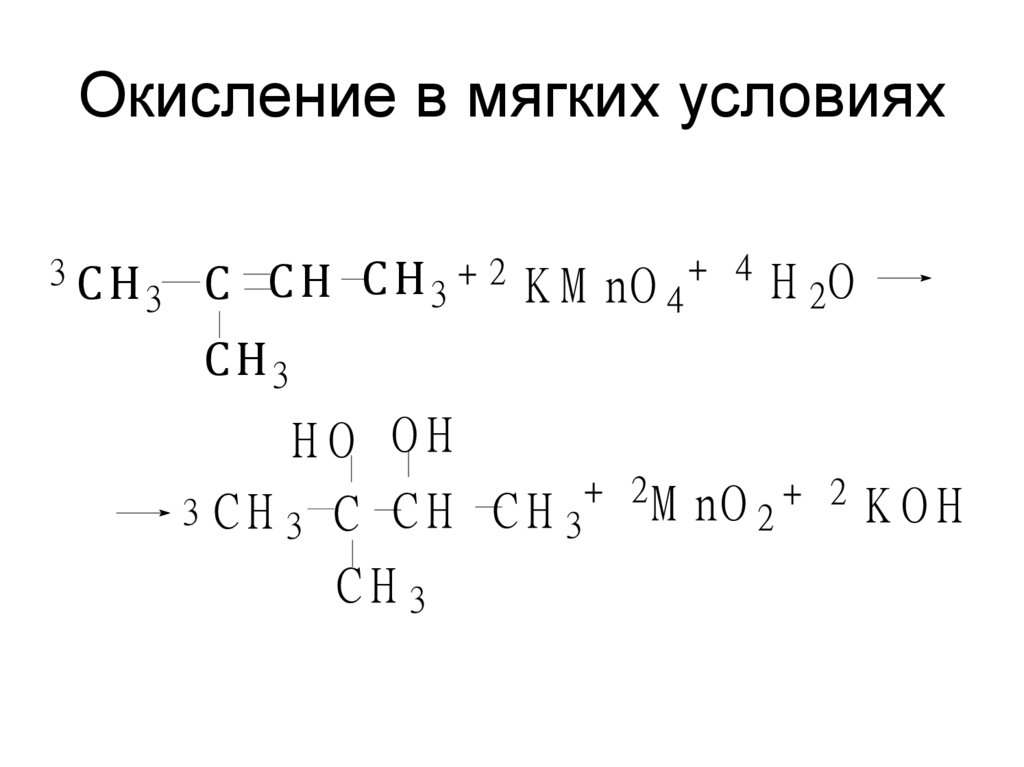
28. Окисление в мягких условиях
3 СНС С Н С Н 3 + 2 K M nO 4 +
3
4
H 2O
С Н3
3
HO OH
+
CH3 C CH CH 3
CH3
2M
nO 2 +
2
KOH
29. Окисление в жёстких условиях
5+ 9 H SO
+
6
С
Н
С Н3 С С Н
K M nO 4
2
4
3
С Н3
+ 3 K SO
C
H
C
O
O
H
5C H 3 C C H 3 + 5
3
2
4
O
+ 6 M nS O 4 + 9 H 2 O
+
30. Окисление в мягких условиях
31. Окисление в жёстких условиях
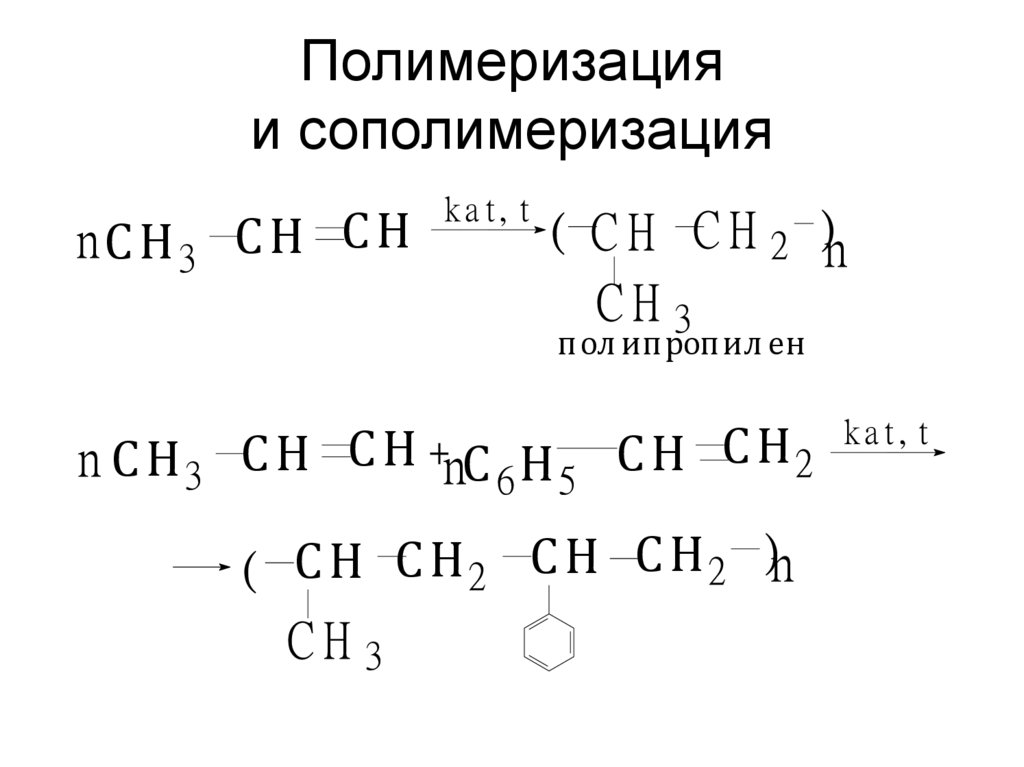
32. Полимеризация и сополимеризация
nС Н3 С Н С Нkat, t
( C H C H 2 )n
CH 3
пол ипропил ен
n С Н 3 С Н С Н +nС 6 Н 5 С Н С Н 2
( С Н С Н 2 С Н С Н 2 )n
CH3
kat, t
33. Горение
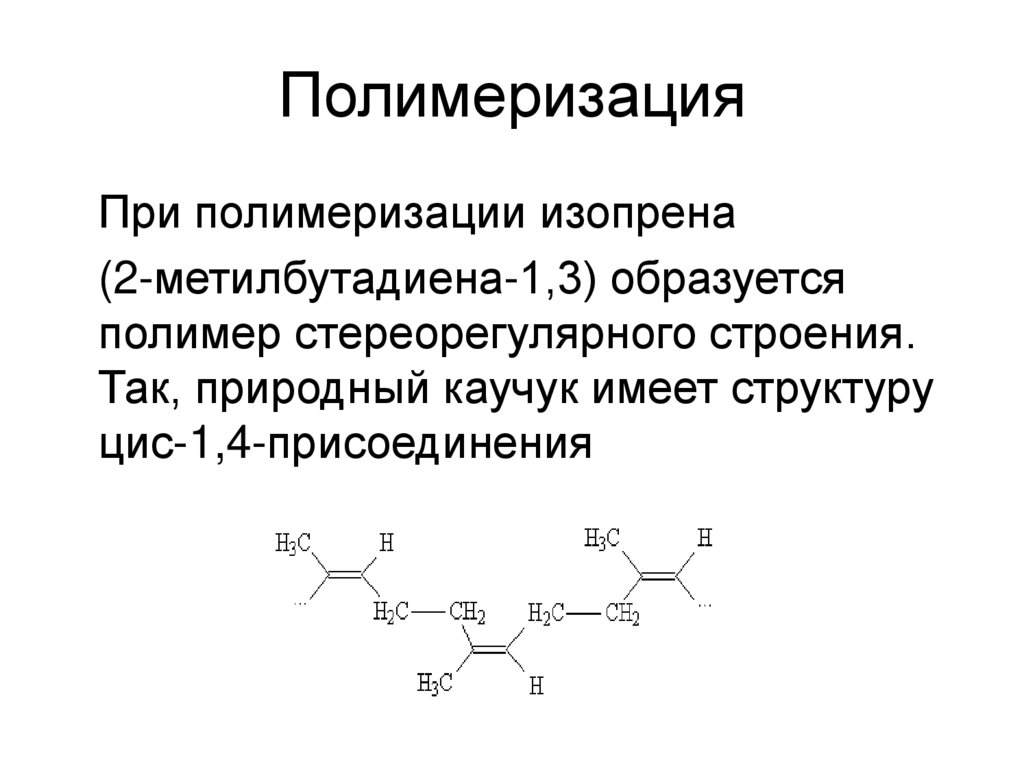
34. Полимеризация
При полимеризации изопрена(2-метилбутадиена-1,3) образуется
полимер стереорегулярного строения.
Так, природный каучук имеет структуру
цис-1,4-присоединения
35. Применение
На основе бутенов производят бутадиен,метилэтилкетон и продукты полимеризации и
сополимеризации. Из изобутилена получают
бутилкаучук, изопрен, алкилфенольные
присадки и т.д. Высшие алкены (выше С5)
являются высокооктановыми компонентами
бензина. Алкадиены – важнейшие мономеры
для производства различных полимерных
материалов, особенно синтетического
каучука.




















 Химия
Химия








