Похожие презентации:
Неметаллы
1.
Обобщение знаний по теме:« Неметаллы»
2. Химическая разминка
Семен Исаакович Вольфкович(1896 – 1980 г.г.) в одной из лабораторий
Московского университета на Моховой
получал это вещество в электрической
печи при электротермической возгонке
фосфоритов.
Когда
он
поздно
возвращался
домой
по
почти
не
освещенным в то время улицам Москвы,
его
одежда
излучала
голубоватое
свечение, а из–под ботинок высекались
искры. Вскоре среди жителей Моховой
улицы стали передаваться рассказы о
“светящемся монахе”. Назовите вещество,
которое получал Вольфкович.
(фосфор)
3. Химическая разминка
У Куртуа был любимый кот, который во времяобеда сидел обычно на плече своего хозяина.
Куртуа часто обедал в лаборатории. В один из
дней во время обеда кот, чего-то испугавшись,
прыгнул на пол, но попал на бутылки, стоявшие
около стола. В одной из бутылок находилась
суспензия золы водорослей, а в другой –
концентрированная серная кислота. Бутылки
разбились и с пола стали подниматься клубы
сине-фиолетового пара, которые оседали на
окружающих
предметах
в
виде
чернофиолетовых кристаллов с металлическим
блеском. Так был открыт новый элемент…
(йод)
)
4. Положение неметаллов в ПС Д.И.Менделеева. Строение атомов НеМе
Неметаллы расположены в правом верхнем углуПС (вдоль и над диагональю B-At).
• Элементы-неметаллы располагаются только в
главных подгруппах ПС.
• Для атомов неметаллов характерны:
- меньший атомный радиус;
- 4 и более электронов на внешнем энергетическом
уровне.
Важнейшее свойство неметаллов – тенденция к
присоединению недостающих до 8 электронов,
т.е. окислительные свойства.
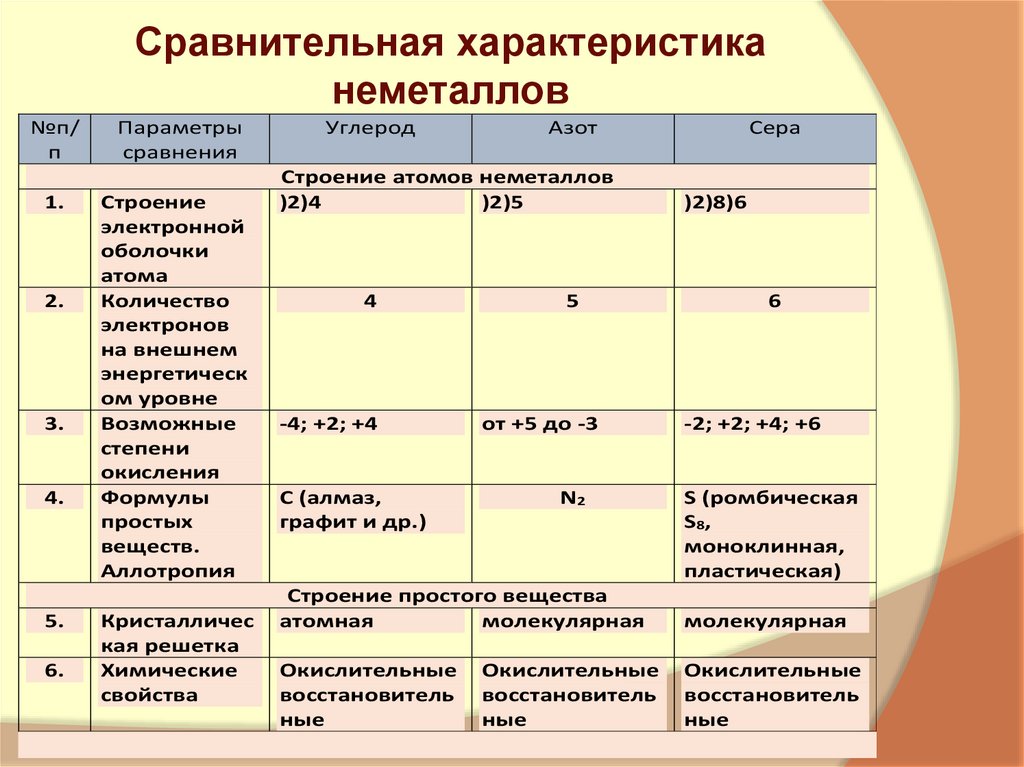
5. Сравнительная характеристика неметаллов
№п/п
1.
2.
3.
4.
5.
6.
Параметры
сравнения
Строение
электронной
оболочки
атома
Количество
электронов
на внешнем
энергетическ
ом уровне
Возможные
степени
окисления
Формулы
простых
веществ.
Аллотропия
Кристалличес
кая решетка
Химические
свойства
Углерод
Азот
Строение атомов неметаллов
)2)4
)2)5
4
-4; +2; +4
С (алмаз,
графит и др.)
5
от +5 до -3
N2
Сера
)2)8)6
6
-2; +2; +4; +6
S (ромбическая
S8,
моноклинная,
пластическая)
Строение простого вещества
атомная
молекулярная
молекулярная
Окислительные
восстановитель
ные
Окислительные
восстановитель
ные
Окислительные
восстановитель
ные
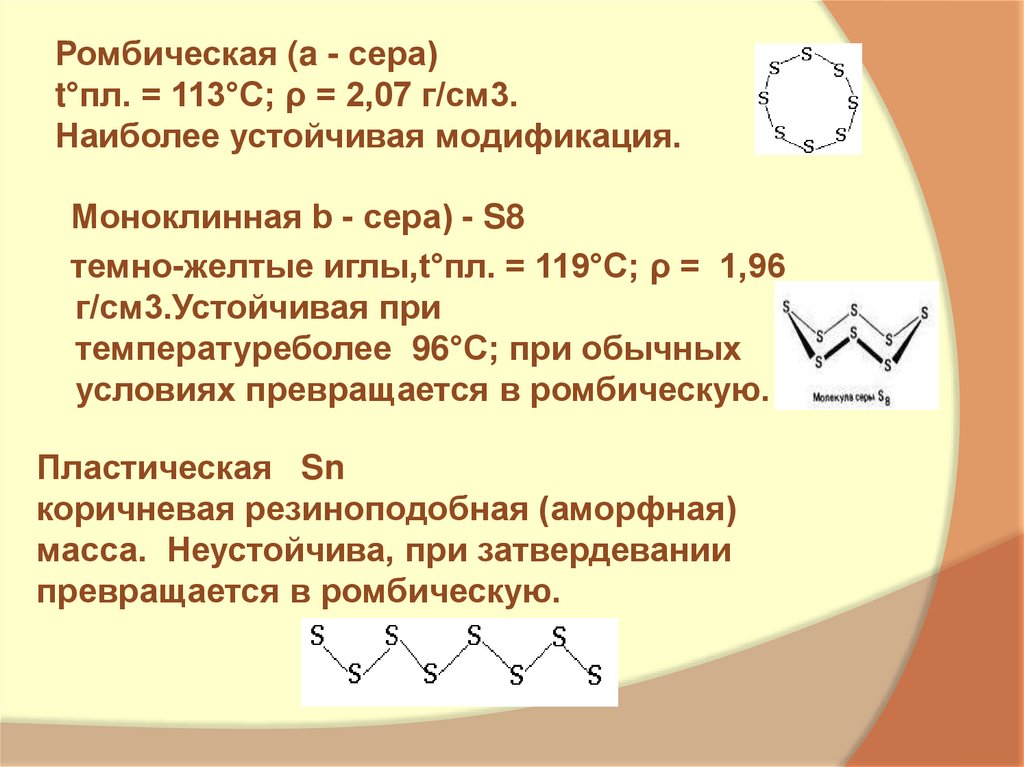
6. Ромбическая (a - сера) t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
Ромбическая (a - сера)t°пл. = 113°C; ρ = 2,07 г/см3.
Наиболее устойчивая модификация.
Моноклинная b - сера) - S8
темно-желтые иглы,t°пл. = 119°C; ρ = 1,96
г/см3.Устойчивая при
температуреболее 96°С; при обычных
условиях превращается в ромбическую.
Пластическая Sn
коричневая резиноподобная (аморфная)
масса. Неустойчива, при затвердевании
превращается в ромбическую.
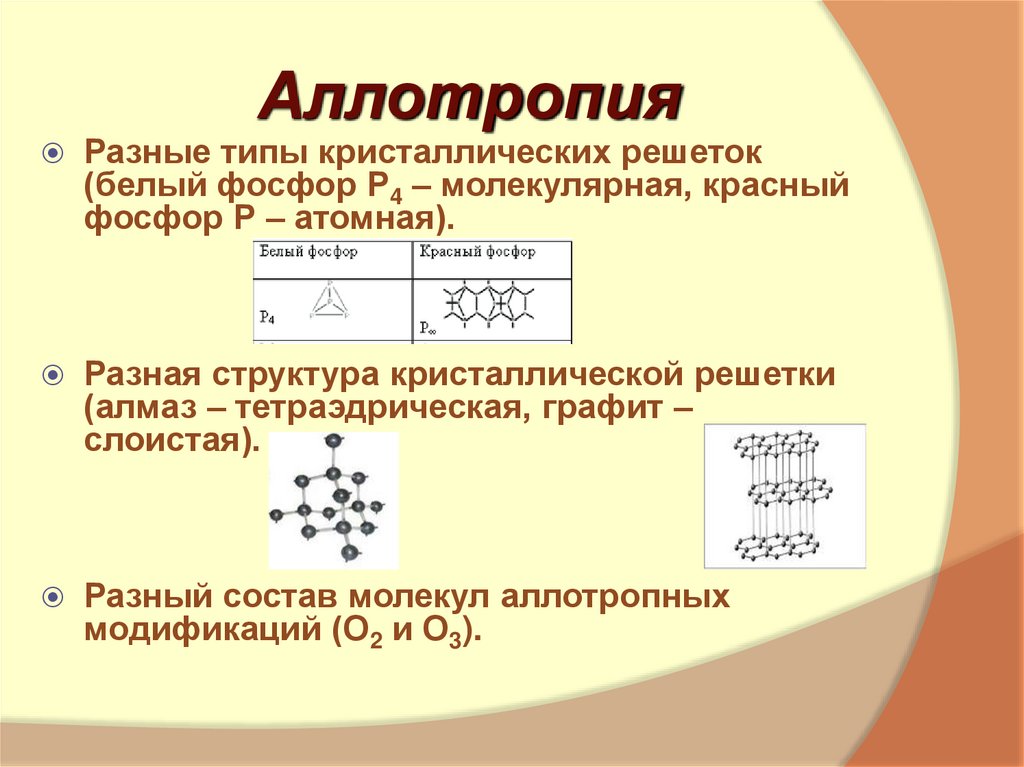
7. Аллотропия
Разные типы кристаллических решеток(белый фосфор Р4 – молекулярная, красный
фосфор Р – атомная).
Разная структура кристаллической решетки
(алмаз – тетраэдрическая, графит –
слоистая).
Разный состав молекул аллотропных
модификаций (О2 и О3).
8. «А я люблю задачи»
Рассчитайте, какой объемхлора потребуется для
получения 1 кг поваренной
соли.
9. «Генетичекий ряд неметалла»
Пусть эти превращенияДадут вам уравнения.
Красный фосфор я сжигаю,
К дымку воду приливаю.
Проверяю лакмусом,
Станет сразу красным он!
Добавим натрия гидроксид —
Цвет фиолетовый в колбе возник.
Потом получаю фосфат серебра,
Цветом - лимонная кожура.
Растворяю осадок желтый
Добавлением кислоты азотной.
И на доске превращения эти
Вы запишите, умные дети!
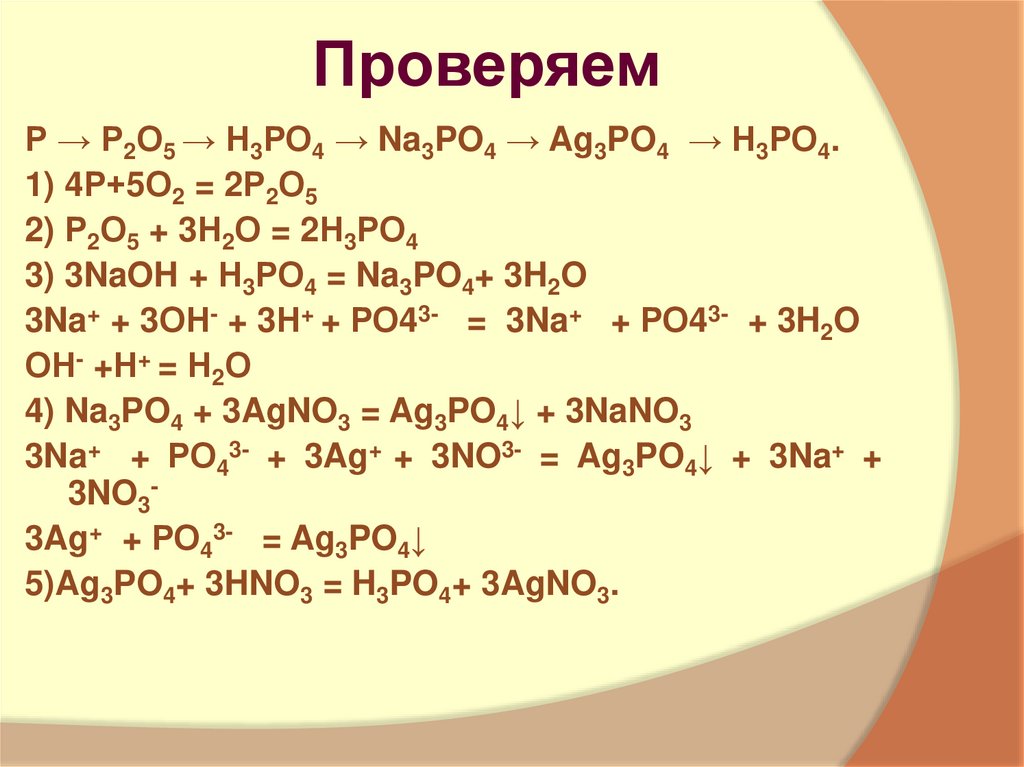
10. Проверяем
Р → Р2О5 → Н3РО4 → Na3PO4 → Ag3PO4 → Н3РО4.1) 4Р+5О2 = 2Р2О5
2) Р2О5 + 3Н2О = 2Н3РО4
3) 3NaOH + Н3РО4 = Na3PO4+ 3H2O
3Na+ + 3ОН- + 3Н+ + РО43- = 3Na+ + РО43- + 3H2O
ОН- +Н+ = Н2О
4) Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
3Na+ + РО43- + 3Ag+ + 3NO3- = Ag3PO4↓ + 3Na+ +
3NO33Ag+ + РО43- = Ag3PO4↓
5)Ag3PO4+ 3HNO3 = H3PO4+ 3AgNO3.
11. 4. «Ситуационное задание»
Задание №1Опоздав на занятия химического кружка, на котором
получали окрашенные осадки, ученик успел записать
только правые части уравнений. Помогите ему
восстановить уравнения реакций полностью:
… + … = AgCl↓ + NaNO3;
… + … = Fe(OH)3↓+ Na2SO4
12. Проверяем тест по теме «Неметаллы»
1). SO2,, P2O5, SO3, Cl2O7, увеличиваются2). NaH, KH, HCl, HF
3). Азот
+5
хлор
+7
сера
+6
кремний
+4
4). H2 + S = H2S
S окислитель
2SO2 + O2 → 2SO3
S восстановитель
5). г) 7
6). в) 2,8,7








 Химия
Химия








