Похожие презентации:
Электролитическая диссоциация
1.
Жил один кристалл ионный,Был красивый он и ровный,
Но случилась с ним беда.
Капля на него упала,
И кристалла вмиг не стало:
Вдруг на что-то распластала
Его ловкая вода.
Все семейство удивилось:
«Что с кристаллом приключилось?»
2. Электролитическая диссоциация
3.
• Положительно заряженный электрод• электрический ток
• Отрицательно заряженный электрод
• Направленное движение заряженных
частиц
• Положительно заряженные частицы
• Анионы
• Электролит
• Анод
• Отрицательно заряженные
частицы
• Раствор спирта является
• Раствор медного
купороса
• Неэлектролит
• Катод
• катионы
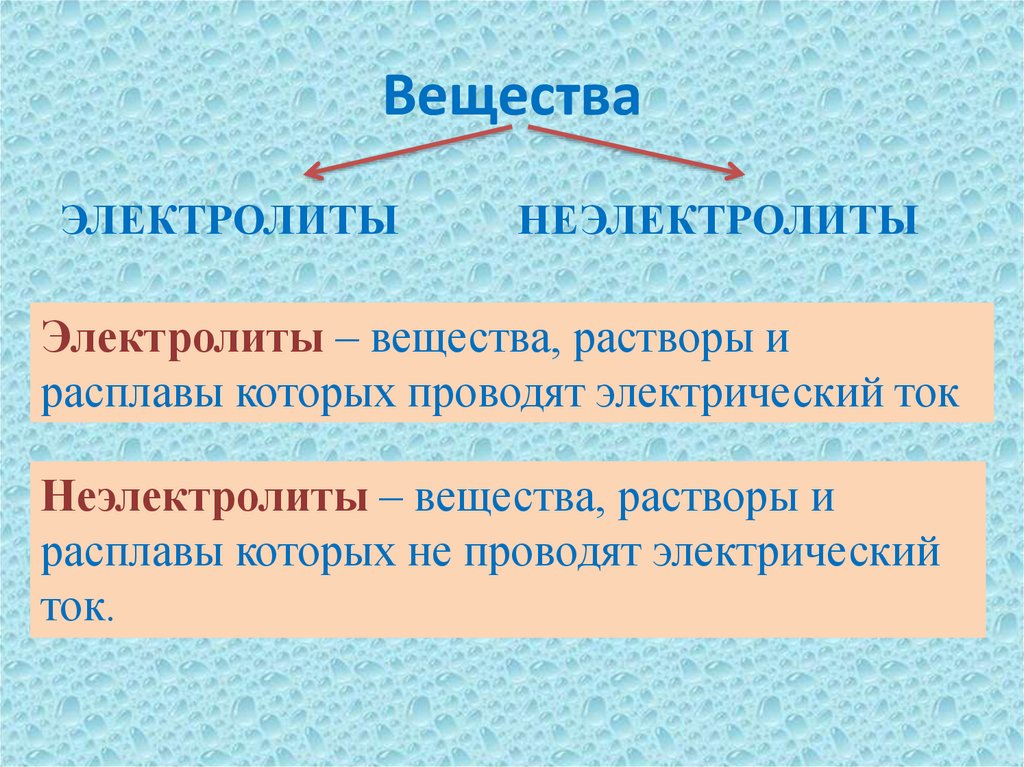
4. Вещества
ЭЛЕКТРОЛИТЫНЕЭЛЕКТРОЛИТЫ
Электролиты – вещества, растворы и
расплавы которых проводят электрический ток
Неэлектролиты – вещества, растворы и
расплавы которых не проводят электрический
ток.
5.
Английский физик и химик,один из основателей электрохимии
В конце 18 века он приобрел репутацию хорошего химика.
В первые годы XIX века Дэви увлекся изучением действия
электрического тока на различные вещества, в том числе на
расплавленные соли и щелочи
6.
Первые его работы вобласти электрохимии
были посвящены
изучению действия
электрического тока
на химические
соединения.
Он показал, что
электрический ток
вызывает разложение
(электролиз) кислот и
солей.
Дэви получил
электролизом два
новых металла из
расплавов их
соединений - калий и
натрий
Тридцатилетний
ученый сумел в
течение двух лет
получить также в
свободном виде
еще ранее
неизвестные
металлы: барий,
кальций, магний и
стронций.
Это стало
одним из самых
выдающихся
событий в
истории
открытия новых
металлов
7. Почему растворы электролитов проводят электрический ток?
Сванте Аррениус(1859-1927)
Создал теорию
электролитической
диссоциации. За
исследования в
области
электролитов был
удостоен
Нобелевской
премии в 1903 г.
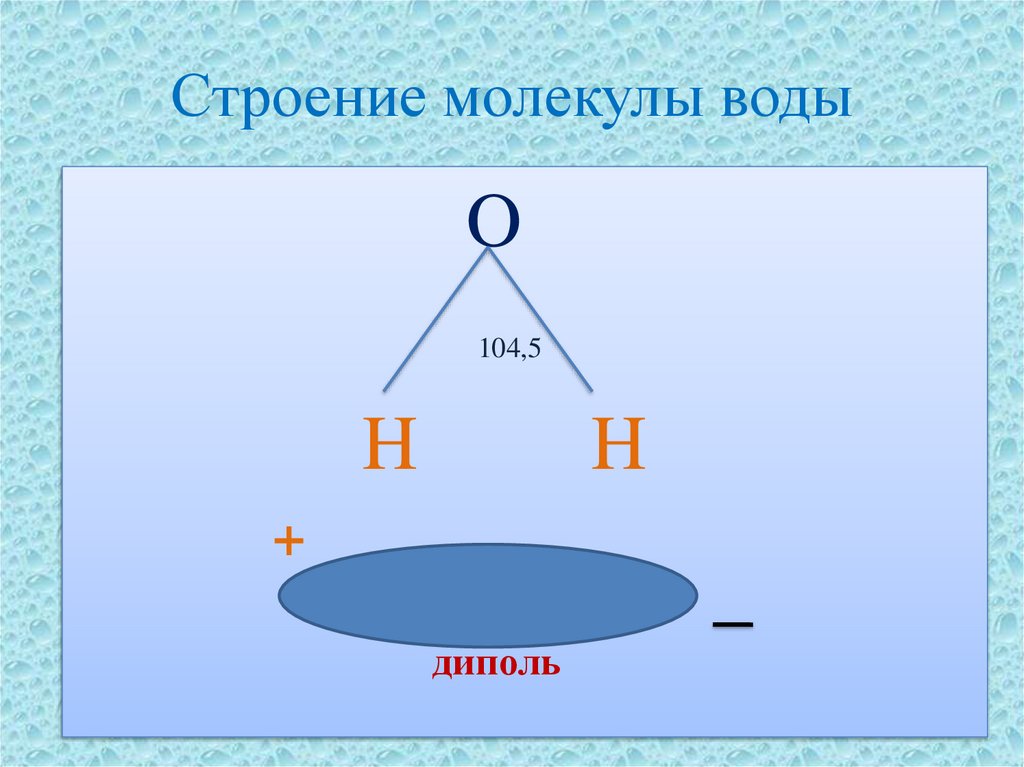
8. Строение молекулы воды
O104,5
H
H
+
диполь
9. Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении.
10.
Легче всего диссоциируют вещества сионной и ковалентной полярной связью:
Кислоты : HCl, H2SO4, HF, HNO3
Основания: NaOH, Ba(OH)2, KOH
Соли : NaCl, CuSO4, KNO3
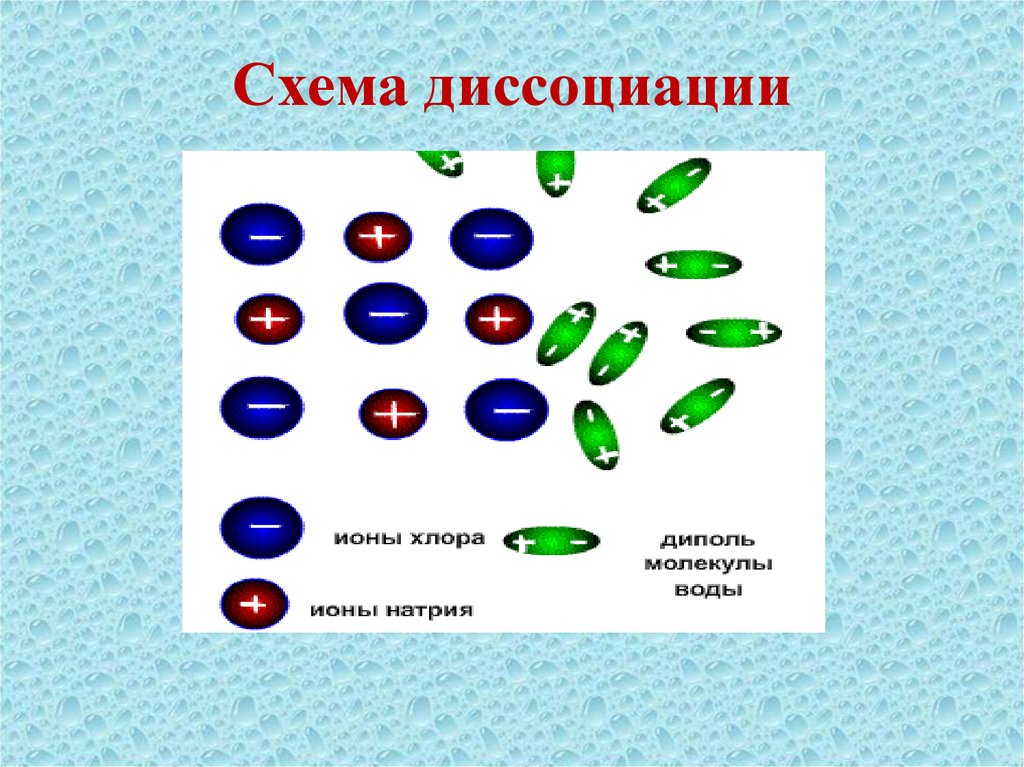
11. Последовательность процессов, происходящих при электролитической диссоциации:
Ориентация молекул – диполей воды околоионов;
Гидратация (взаимодействие) молекул
воды с противоположно заряженными
ионами поверхностного слоя кристалла;
Диссоциация (распад) кристалла
электролита на гидратированные ионы
12. Схема диссоциации
13. Уравнение реакции:
+NaCl = Na
+
Cl
NaCl – молекула хлорида натрия
Na+ - ион натрия
Cl- - ион хлора
14. Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных частиц (Nр)
Nдά =
Nр
ά – степень диссоциации
Nд - число частиц, распавшихся на ионы
Nр - общее число растворенных частиц
15. Степень диссоциации выражают в долях или процентах.
При ά = 0 диссоциация отсутствуетПри ά = 1 или 100% электролит
полностью распадается на ионы
По степени электролитической
диссоциации электролиты делят
сильные
слабые
16. Электролиты
Сильныевсе растворимые
соли;
сильные кислоты
H2SO4, HCl, HNO3
все щелочи
NaOH, KOH
Слабые
слабые кислоты
H2S, H2CO3, HNO2
водный раствор
аммиакаNH3*H2O
органические
вещества
17. Основные положения теории электролитической диссоциации
18.
19.
В предложенных горизонтальных рядах исключите лишнеевещество, то есть, такое, которое не образует с остальными
однородную группу.
1. NaOH K2CO3 BaCl₂ HCl
Fe
2. H3PO4 K₂O H₂SO₃ Al₂(SО₄)₃ Са(OH)₂
3. H₂SO₄
Fe(NO₃)₃ O₂ HgCl₂
Zn(NO₃)₂
4. Са (NO₃)₂
H₂S N₂O₅ Ва(OH)₂
CuCl₂
5. K2SO₄
NaOH AlCl₃ CO₂
HNO₃
6. KCI
AgNO₃
HBr LiOH
Cl₂
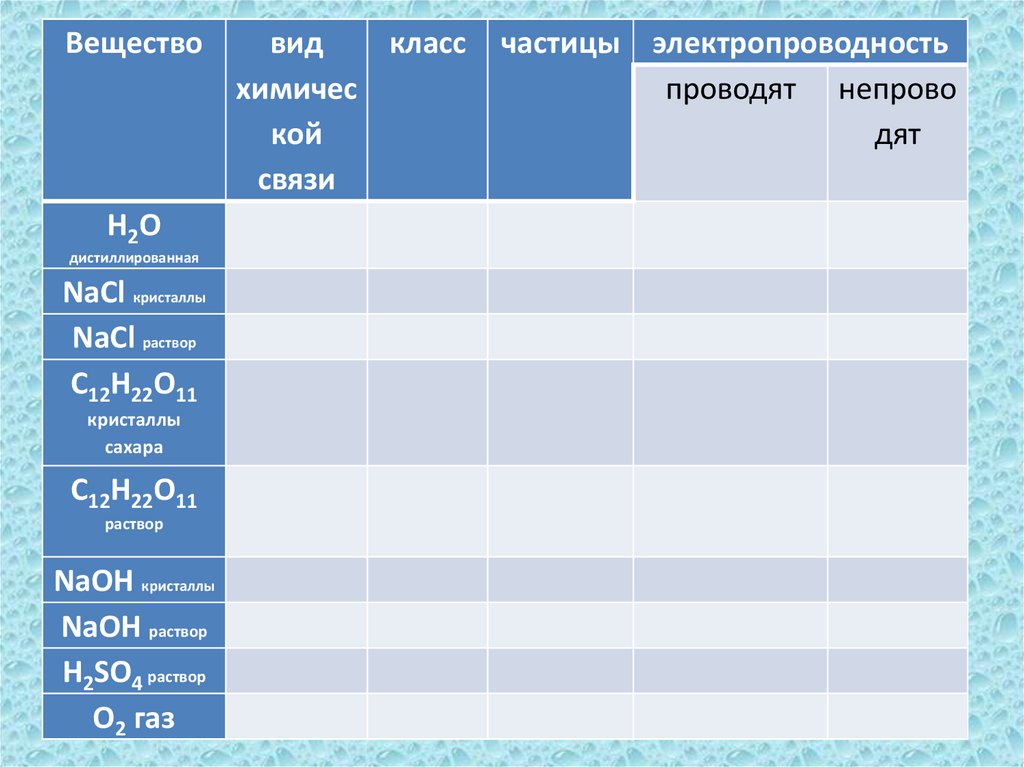
20.
ВеществоН2О
дистиллированная
NaCl кристаллы
NaCl раствор
C12H22O11
кристаллы
сахара
C12H22O11
раствор
NaOH кристаллы
NaOH раствор
H2SO4 раствор
O2 газ
вид
класс
химичес
кой
связи
частицы электропроводность
проводят непрово
дят
















 Химия
Химия








