Похожие презентации:
Электролитическая диссоциация
1. Электролитическая диссоциация
2. Вещества
ЭЛЕКТРОЛИТЫНЕЭЛЕКТРОЛИТЫ
Электролиты – вещества, растворы и
расплавы которых проводят электрический ток
Неэлектролиты – вещества, растворы и
расплавы которых не проводят электрический
ток.
3. Почему растворы электролитов проводят электрический ток?
Сванте Аррениус(1859-1927)
Создал теорию
электролитической
диссоциации. За
исследования в
области
электролитов был
удостоен
Нобелевской
премии в 1903 г.
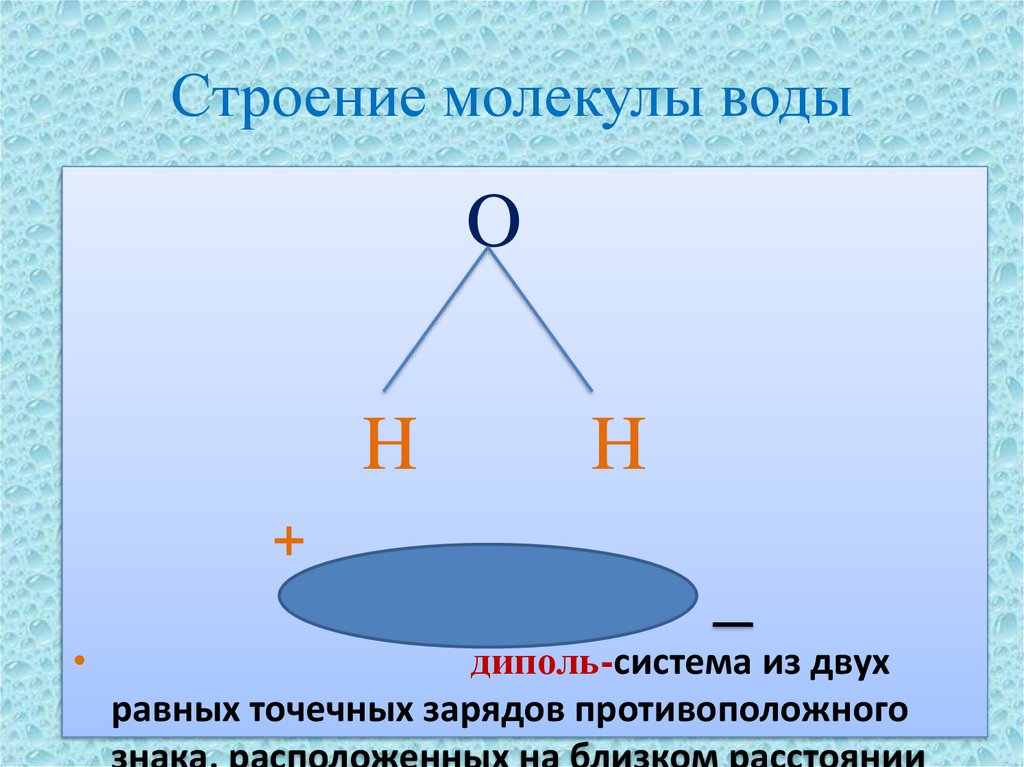
4. Строение молекулы воды
OH
H
+
диполь-система из двух
равных точечных зарядов противоположного
5. Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении.
6.
Легче всего диссоциируют вещества сионной и ковалентной полярной связью:
Кислоты : HCl, H2SO4, HF, HNO3
Основания: NaOH, Ba(OH)2, KOH
Соли : NaCl, CuSO4, KNO3
7. Последовательность процессов, происходящих при электролитической диссоциации:
Ориентация молекул – диполей воды околоионов;
Гидратация (взаимодействие) молекул
воды с противоположно заряженными
ионами поверхностного слоя кристалла;
Диссоциация (распад) кристалла
электролита на гидратированные ионы
8. Схема диссоциации
9. Уравнение реакции:
+NaCl = Na
+
Cl
NaCl – молекула хлорида натрия
Na+ - ион натрия
Cl- - ион хлора
10. Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных частиц (Nр)
Nдά =
Nр
ά – степень диссоциации
Nд - число частиц, распавшихся на ионы
Nр - общее число растворенных частиц
11. Степень диссоциации выражают в долях или процентах.
При ά = 0 диссоциация отсутствуетПри ά = 1 или 100% электролит
полностью распадается на ионы
По степени электролитической
диссоциации электролиты делят
сильные
слабые
12. Электролиты
Сильныевсе растворимые
соли;
сильные кислоты
H2SO4, HCl, HNO3
все щелочи
NaOH, KOH
Слабые
слабые кислоты
H2S, H2CO3, HNO2
водный раствор
аммиакаNH3*H2O
органические
вещества











 Химия
Химия








