Похожие презентации:
Адсорбция на границе газ – твердое тело. Лекция 4
1.
Лекция 4Адсорбция на границе газ – твердое тело
ДОЦЕНТ КАФЕДРЫ НАНОРАЗМЕРНЫХ СИСТЕМ И ПОВЕРХНОСТНЫХ
ЯВЛЕНИЙ ИМЕНИ С.С.ВОЮЦКОГО, К. Х. Н. О.А. ДУЛИНА
2.
Адсорбция газов и паров на твердой поверхностиЭто простейший случай адсорбции, т.к. в адсорбционном процессе участвуют только
два компонента.
Степень адсорбции в состоянии равновесия зависит от температуры, давления газа и
удельной поверхности адсорбента.
A = f [T, Р, Sуд]
Лучшими адсорбентами являются высокопористые вещества, такие как
активированный уголь и силикагель. Их Sуд достигает 1000 м2/г.
3.
Адсорбция как обратимый экзотермический процессВ адсорбционном слое молекулы газа способны к перемещению лишь в двух
измерениях, поэтому адсорбция газа сопровождается уменьшением энтропии, т.е.
ΔS < 0 .
Условием протекания адсорбции как самопроизвольного процесса является
уменьшение энергии Гиббса, т. е. ΔG < 0.
Из термодинамической зависимости ΔG = ΔH −T ΔS следует, что теплота
адсорбции должна быть отрицательной, т. е. адсорбция газов или паров на
твердом теле всегда является экзотермическим процессом. Поэтому степень
адсорбции газа в равновесных условиях увеличивается с понижением температуры.
4.
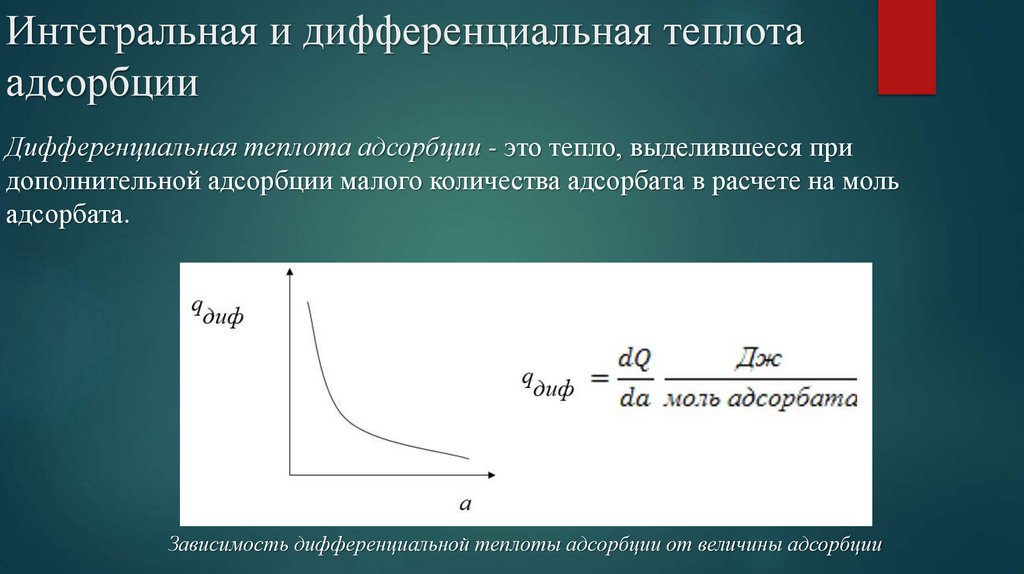
Интегральная и дифференциальная теплотаадсорбции
Различают интегральную и дифференциальную теплоту адсорбции.
Интегральная теплота адсорбции - это общее количество тепла, выделившееся
при адсорбции данного количества адсорбата на 1 кг адсорбента.
Зависимость интегральной теплоты адсорбции от величины адсорбции
5.
Интегральная и дифференциальная теплотаадсорбции
Дифференциальная теплота адсорбции - это тепло, выделившееся при
дополнительной адсорбции малого количества адсорбата в расчете на моль
адсорбата.
Зависимость дифференциальной теплоты адсорбции от величины адсорбции
6.
Адсорбция как обратимый экзотермическийпроцесс
При физической адсорбции значения теплоты
адсорбции невелики (~10 ккал/моль). Поэтому
адсорбция является обратимым процессом,
находящимся в равновесии с обратным
процессом десорбции: адсорбция ↔ десорбция.
Адсорбция осуществляется за счет
межмолекулярных сил, причина десорбции –
тепловое движение молекул.
Адсорбция возрастает с увеличением теплоты
адсорбции.
Влияние температуры на адсорбцию
7.
Физическая адсорбция и хемосорбцияВ зависимости от природы адсорбционных сил различают физическую адсорбцию и
химическую адсорбцию (хемосорбцию).
Физическая адсорбция
Хемосорбция
1. Адсорбционные силы –
межмолекулярные (Ван-дерВаальсовы).
2. Неспецифична, т.е. данное
вещество примерно одинаково
адсорбируется на разных
адсорбентах.
3. Обратима.
4. Теплота мала Qa ~ 10 – 40
кДж/моль.
5. Не локализована.
1. Адсорбционные силы имеют
химическую природу
(ковалентные и ионные связи,
координационные, донорноакцепторные).
2. Специфична, т.е. данное
вещество адсорбируется только
на определенных адсорбентах.
3. Необратима.
4. Qa ~ 40 – 400 кДж/моль.
5. Всегда локализована.
8.
6. Адсорбционное равновесиедостигается быстро,
физическая адсорбция
многослойна.
6. Монослойна. Хемосорбция
отличается от химической
реакции тем, что адсорбция
протекает только в
мономолекулярном
поверхностном слое и
диффузия адсорбата вглубь
адсорбента не идет.
Хемосорбция О2 на угле. Образуется
адсорбционный компонент который
препятствует проникновению
кислорода вглубь
9.
Кривые потенциальной энергии для физическойадсорбции и хемосорбции
1 – физическая адсорбция; 2- хемосорбция ϴ = 0; 3 – хемосорбция ϴ = 0,8
10.
Изобара адсорбцииКак для физической, так и для химической адсорбции характерно
монотонное убывание величины адсорбции с ростом температуры.
Однако изобары этих процессов лежат на разных уровнях.
При низкой температуре, вследствие высокой энергии активации
хемосорбции, скорость её ничтожно мала и процесс идет как
физическая адсорбция (участок а).
С ростом температуры процесс переходит на изобару хемосорбции
(участок с). В области перехода обнаруживается рост адсорбции с
ростом температуры, что свидетельствует об активированной
хемосорбции.
Участок а соответствует равновесной физической адсорбции,
которая уменьшается с ростом температуры, вследствие смещения
равновесия в сторону десорбции. Участок b на кривой
соответствует равновесной хемосорбции, которая уменьшается с
ростом температуры, в результате разложения вещества. Участок с
– это неравновесный переход от физической адсорбции к
хемосорбции.
Изобара физической
адсорбции а, и
хемосорбции b
11.
Природа сил межмолекулярного взаимодействияФизическая адсорбция происходит под действием
Ван-дер-Ваальсовых сил
ориентационные
индукционные
дисперсионные
Ниже показана природа взаимодействия в зависимости от характера адсорбента и
адсорбата.
Адсорбент
полярный
Адсорбат
полярный
Силы взаимодействия
ориентационные
полярный
неполярный
неполярный
неполярный
полярный
неполярный
индукционные
индукционные
дисперсионные
12.
Природа сил межмолекулярного взаимодействияДисперсионные силы имеют квантовую природу, проявляются
между мгновенными диполями, возникающими при
сближении молекул за счет флуктуаций электронной
плотности.
Энергия межмолекулярного взаимодействия:
Uмежмол. взаим. = Uинд. + Uор. + Uдисп.
Для сильно поляризованных молекул NH3 и H2O
ориентационный эффект = дисперсионному.
Дисперсионные силы аддитивны и действуют на больших
расстояниях по сравнению с межмолекулярными силами
rдис ~10-7 м; rмежмол ~10-9 м.
Джон Эдвард
Леннард-Джонс
1894 - 1954
13.
Энергия межмолекулярного (дисперсионного) притяжения:где С – константа дисперсионного притяжения; r – расстояние между центрами
атомов или молекул.
Энергия борновского отталкивания:
где b - константа борновского отталкивания, возникающего при перекрывании
электронных оболочек.
Полная энергия адсорбционного взаимодействия определяется уравнением
Леннард-Джонса:
При адсорбции дисперсионные силы действуют одновременно между молекулами
адсорбата и многими атомами адсорбента.
Полная потенциальная энергия взаимодействия:
14.
Изотерма адсорбции. Уравнение ФрейндлихаИзотерма адсорбции – одна из самых распространенных
зависимостей, характеризующих адсорбцию.
На кривой имеется 3 участка. При малых давлениях
наблюдается линейная зависимость (участок 1), т.к.
поверхность адсорбента свободна и идет активное её
заполнение. На участке 3 достигается предельная адсорбция,
вследствие насыщения поверхностного слоя адсорбента.
Герберт Макс ФинлейУчасток 2 является криволинейным, т.к. на этом участке
достигается промежуточная степень заполнения поверхности
адсорбента. Т.о. изотерма адсорбции имеет вид параболлы и
описывается эмпирическим уравнением Френйдлиха:
1ൗ



































 Физика
Физика Химия
Химия








