Похожие презентации:
Алюминий и его соединения
1.
АЛЮМИНИЙ ИЕГО СОЕДИНЕНИЯ
2.
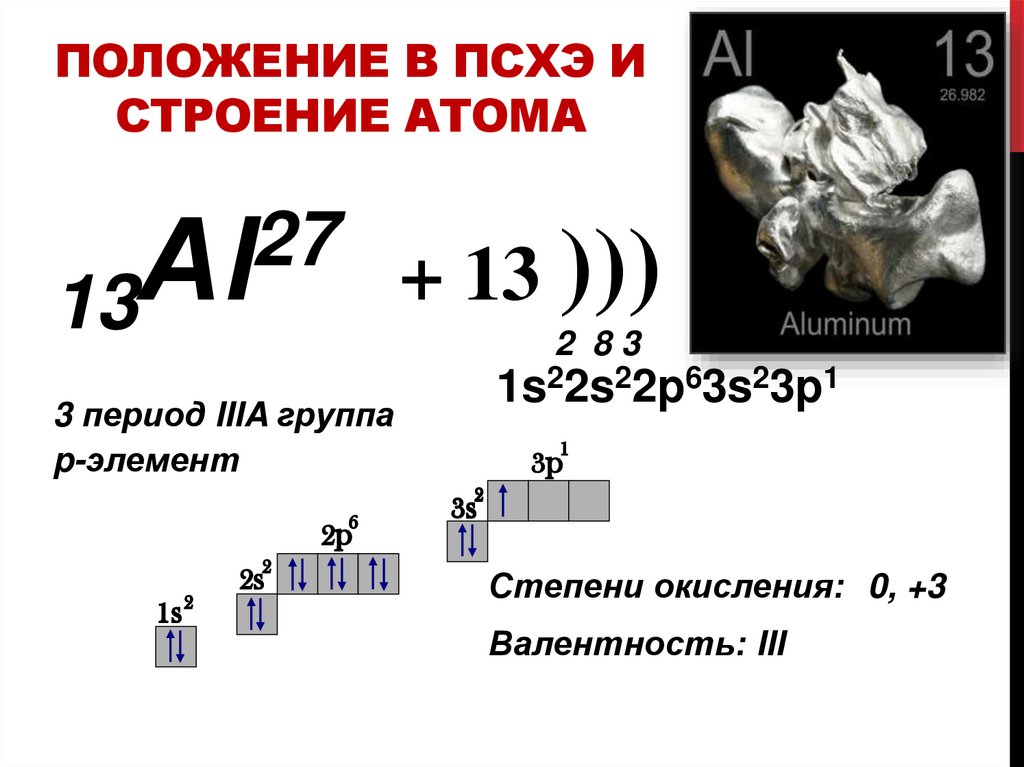
ПОЛОЖЕНИЕ В ПСХЭ ИСТРОЕНИЕ АТОМА
27
Аl
+
13
)))
13
2 83
1s22s22p63s23p1
3 период IIIA группа
p-элемент
1
3p
2
6
2p
2
1s
2
2s
3s
Степени окисления: 0, +3
Валентность: III
3.
НАХОЖДЕНИЕ В ПРИРОДЕПо распространенности в природе –
3 место (после О и Si).
Среди металлов – 1 место.
В чистом виде в природе не встречается.
4.
НАХОЖДЕНИЕ В ПРИРОДЕ5.
ПОЛУЧЕНИЕ АЛЮМИНИЯПутем электролиза из глинозема и боксита
в расплавленном криолите (Na3AIF6)
электролиз
Al2O3
→
2Al + 1,5 O2
6.
ФИЗИЧЕСКИЕ СВОЙСТВААЛЮМИНИЯ
белый металл с серебристым блеском
легкий (плотность = 2,7 г/см3)
хороший проводник тепла и тока
пластичный
характерна относительно высокая упругость (не
становится хрупким при низких температурах)
• устойчив к коррозии на воздухе,
а также в химических средах
• t пл. = 6600С
7.
ХИМИЧЕСКИЕ СВОЙСТВААЛЮМИНИЯ
С простыми веществами
4Аl +3O2 = 2Al2O3 оксид алюминия
2Аl + 3S = Al2S3
cульфид алюминия
2Al +3Cl2 = 2AlCl3 хлорид алюминия
4Al + 3C = Al4C3
карбид алюминия
2Al + N2 = 2AlN
нитрид алюминия
8.
ХИМИЧЕСКИЕ СВОЙСТВААЛЮМИНИЯ
Со сложными веществами
Очищенный от оксидной пленки алюминий реагирует с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
Алюминий – амфотерный металл: взаимодействует с
разбавленными кислотами и щелочами.
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 3H2SO4(разб.)= Al2(SO4)3 + 3H2↑
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2Al + 2NaOH + 6H2O = 2Na[Al(OН)4] + 3H2↑
тетрагидроксоалюминат натрия
9.
ХИМИЧЕСКИЕ СВОЙСТВААЛЮМИНИЯ
Со сложными веществами
Не реагирует с конц.НNO3 и конц.H2SO4. ! ! !
С разбавленной азотной кислотой:
Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O
С солями: 2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
С оксидами менее активных металлов (алюминотермия):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
Алюмотермией получают Сr, Ni, Co, V, Ti, Mn.
10.
ОКСИД АЛЮМИНИЯАl2O3 - белое тугоплавкое вещество.
В воде не растворяется.
В природе встречается в виде глинозема, корунда, бокситов.
Амфотерный оксид
а) с кислотами Al2O3 + 6HCl = 2AlCl3 + 3H2O
б) со щелочами Al2O3 + 2NaOH = 2NaAlO2 + H2O
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OН)4]
Образуется:
а) при окислении или горении алюминия на воздухе
4Al + 3O2 = 2Al2O3
б) в реакции алюминотермии
2Al + Fe2O3 = Al2O3 + 2Fe
в) при термическом разложении гидроксида алюминия
2Al(OH)3 = Al2O3 + 3H2O
11.
ГИДРОКСИД АЛЮМИНИЯБелый нерастворимый в воде порошок.
Амфотерный гидроксид
а) с кислотами Al(OH)3 + 3HCl = AlCl3 + 3H2O
б) со щелочами Al(OH)3 + NaOHсух.= NaAlO2 + 2H2O
t◦
Al(OH)3 + NaOH = Na[Al(OН)4] = NaAlO2 + 2H2O
Разлагается при нагревании 2Al(OH)3 = Al2O3 + 3H2O
Образуется:
а) при взаимодействии растворов солей алюминия с
растворами щелочей (без избытка)
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
б) при взаимодействии алюминатов с кислотами (без
избытка)
NaAlO2 + HCl + H2O = Al(OH)3↓ + NaCl
12.
КАЧЕСТВЕННАЯ РЕАКЦИЯКачественная реакция на катион Al3+
АlCl3 + 3NaOH = Al(OH)3 + 3NaCl
Аl3+ + 3OH- = Al(OH)3
белый студенистый осадок
13.
В электротехнике.Для изготовления
туристического
снаряжения,
корпусов автобусов,
цистерн для
перевозки к.НNО3
ПРИМЕНЕНИЕ
Сплавы:
дюралюминий,
силумин,
магналий
Al – «крылатый металл».
В производстве
самолетов, автомобилей.
Краска «серебрянка».
В производстве
конденсаторов.
14.
ТЕСТОВЫЕ ЗАДАНИЯПО ТЕМЕ
«АЛЮМИНИЙ И ЕГО
СОЕДИНЕНИЯ»
15.
Элемент подгруппы алюминия:А) La
B) In
C) Si
D) Mn
E) Sc
Ответ: ...
16.
Элемент подгруппы алюминия:А) La
B) In
C) Si
D) Mn
E) Sc
Ответ: B.
Алюминий расположен в ПСХЭ в IIIA группе.
В – Аl – Ga – In – Tl
17.
По распространенности в земной кореалюминий
А) третий
B) четвертый
C) шестой
D) первый
E) второй
Ответ ?
18.
Природное соединение алюминия:А) гематит
B) пирит
C) магнетит
D) боксит
E) лимонит
Ответ?
19.
Степень окисления алюминия в соединениях:А) +1
B) +2
C) +6
D) +4
E) +3
Ответ ?
20.
Магний и алюминий в промышленностиполучают путём
А) гидролиза
B) сольватолиза
C) пиролиза
D) озонолиза
E) электролиза
Ответ: …
21.
Магний и алюминий в промышленностиполучают путём
А) гидролиза
B) сольватолиза
C) пиролиза
D) озонолиза
E) электролиза
Ответ: Е
Путем электролиза из глинозема и боксита в
расплавленном криолите (Na3AIF6)
электролиз
Al2O3
→
2Al + 1,5O2
22.
Алюминий не подвергается коррозии так как:А) химически малоактивен
B) не реагирует с кислородом
C) в электрохимическом ряду напряжений
расположен после щелочных металлов
D) покрыт защитной оксидной пленкой
E) пассивируется в концентрированных азотной и
серных кислотах
Ответ ?
23.
Доказательством амфотерности оксида алюминияявляется реакция с:
А) кислотой
B) щелочью
C) щелочью при нагревании
D) водой
E) кислотой и щелочью при нагревании
Ответ ?
24.
Алюминотермией получают металл:А) барий
B) магний
C) калий
D) кальций
E) хром
Ответ ?
25.
Алюминотермическим способом можнополучить группу металлов
А) Сu, Na, Cr
B) Ni, Cr, Zn
C) K, Na, Cr,
D) Cs, Cu, Fe
E) Na, Mn, Al
Ответ ?
26.
Алюминотермия применима для получения изсоответствующего оксида
А) Na
B) K
C) Mg
D) Ca
E) Fe
Ответ: Е.
2Al + Fe2O3 = Al2O3 + 2Fe
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
27.
Сплав, широко используемый в авиационнойтехнике
А) сталь
B) феррохром
C) латунь
D) дюралюмин
E) чугун
Ответ ?
28.
В результате взаимодействия 2 моль гидроксидаалюминия и 3 моль серной кислоты получится
соль
А) дигидрооксосульфат алюминия
B) сульфат алюминия
C) сульфит алюминия
D) гидросульфат алюминия
E) гидрооксосульфат алюминия
Ответ: …
29.
В результате взаимодействия 2 моль гидроксидаалюминия и 3 моль серной кислоты получится
соль
А) дигидрооксосульфат алюминия
B) сульфат алюминия
C) сульфит алюминия
D) гидросульфат алюминия
E) гидрооксосульфат алюминия
Ответ: В.
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
сульфат
алюминия
30.
В результате полного взаимодействия 1 мольгидроксида алюминия и 1 моль серной кислоты
получиться соль
А) дигидроксосульфат алюминия
B) гидроксосульфат алюминия
C) сульфат алюминия
D) гидросульфат алюминия
E) сульфит алюминия
Ответ: …
31.
В результате полного взаимодействия 1 мольгидроксида алюминия и 1 моль серной кислоты
получиться соль
А) дигидроксосульфат алюминия
B) гидроксосульфат алюминия
C) сульфат алюминия
D) гидросульфат алюминия
E) сульфит алюминия
Ответ: В.
Al(OH)3 + H2SO4 = Al(ОН) SO4 + 2H2O
гидроксосульфат
алюминия
32.
Сумма коэффициентов в уравнении реакцииобразования нерастворимого основания при
взаимодействии AlCl3 и КOН:
А) 4
B) 8
C) 7
D) 9
E) 5
Ответ: …
33.
Сумма коэффициентов в уравнении реакцииобразования нерастворимого основания при
взаимодействии AlCl3 и КOН:
А) 4
B) 8
C) 7
D) 9
E) 5
Ответ: В
АlCl3 + 3КOH = Al(OH)3 + 3КCl
1 + 3
+ 1
+ 3 =8
34.
Тип и молярная масса соли (г/моль),образующейся на первой ступени гидролиза
хлорида алюминия:
А) основная; 115
B) кислая; 64,5
C) основная; 96,5
D) кислая; 115
E) средняя; 133,5
Ответ: ...
35.
Тип и молярная масса соли (г/моль),образующейся на первой ступени гидролиза
хлорида алюминия:
А) основная; 115
B) кислая; 64,5
C) основная; 96,5
D) кислая; 115
E) средняя; 133,5
Ответ: A.
AlCl3 + HOH ↔ Al(OH)Cl2 + HCl
Al(OH)Cl2 - основная соль
Mr = 27+ 16 + 1 + 35,5*2 = 115
36.
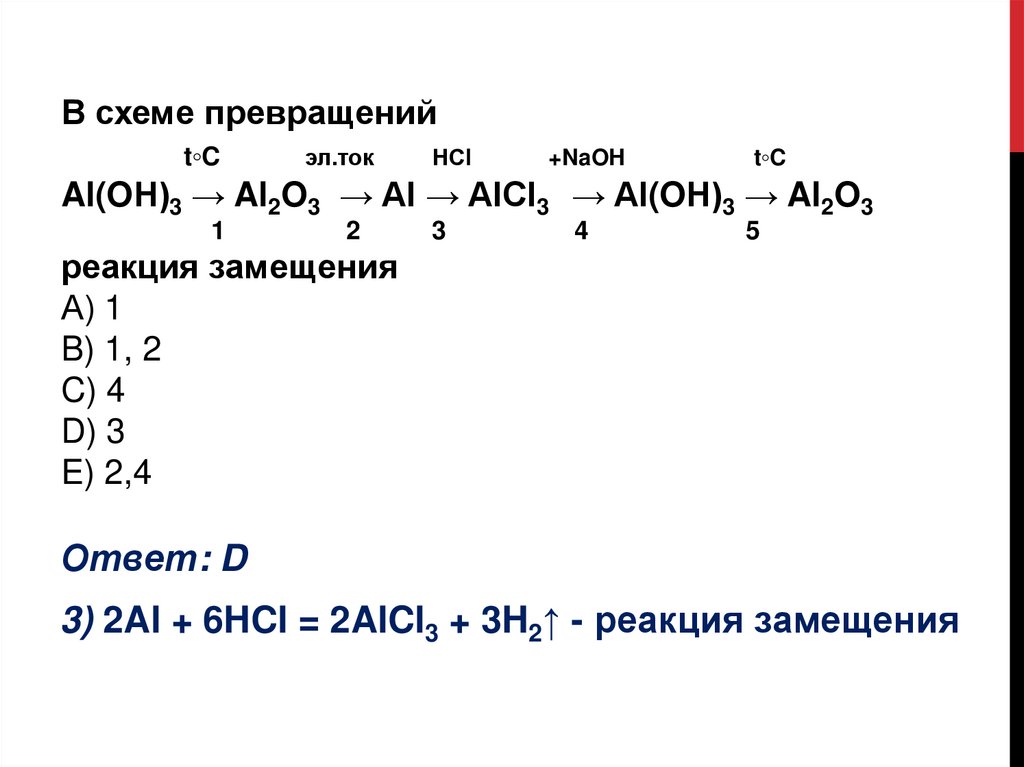
В схеме превращенийt◦C
эл.ток
НСl
+NaOH
t◦C
Al(OН)3 → Al2O3 → Al → AlCl3 → Al(OН)3 → Al2O3
1
2
3
4
5
реакция замещения
А) 1
B) 1, 2
C) 4
D) 3
E) 2,4
Ответ: D
3) 2Al + 6HCl = 2AlCl3 + 3H2↑ - реакция замещения
37.
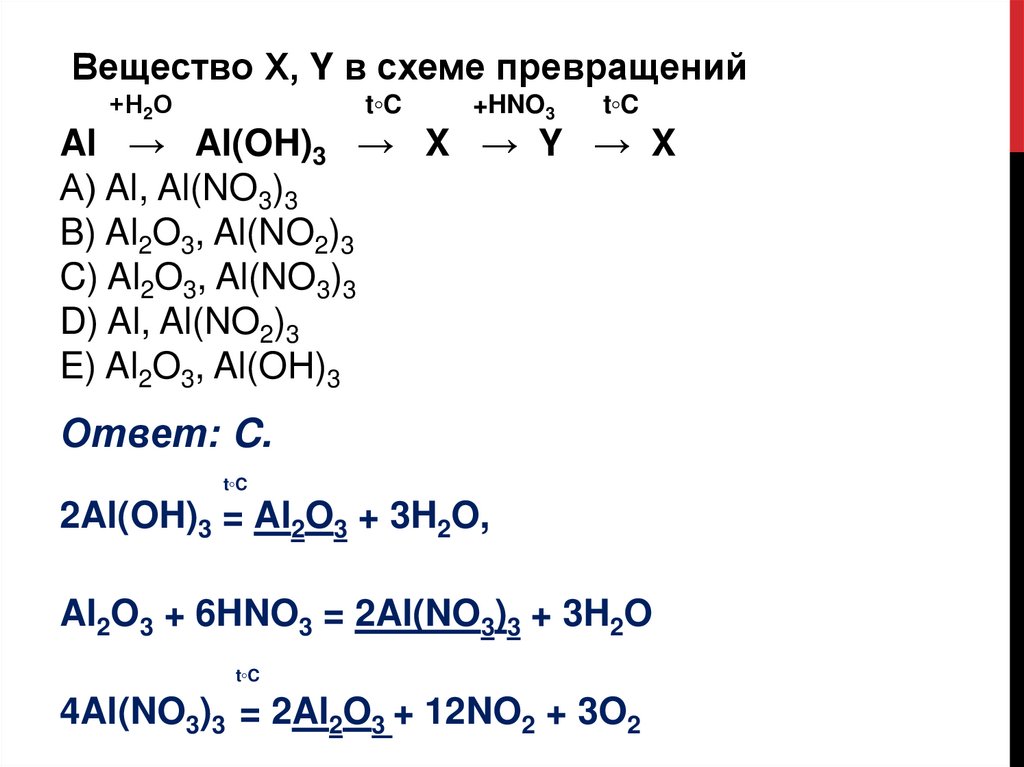
Вещество Х, Y в схеме превращений+Н2О
t◦C
+HNO3
t◦C
Al → Al(OH)3 → X → Y → X
А) Al, Al(NO3)3
B) Al2O3, Al(NO2)3
C) Al2O3, Al(NO3)3
D) Al, Al(NO2)3
E) Al2O3, Al(OН)3
Ответ: ...
38.
Вещество Х, Y в схеме превращений+Н2О
t◦C
+HNO3
t◦C
Al → Al(OH)3 → X → Y → X
А) Al, Al(NO3)3
B) Al2O3, Al(NO2)3
C) Al2O3, Al(NO3)3
D) Al, Al(NO2)3
E) Al2O3, Al(OН)3
Ответ: C.
t◦C
2Al(OH)3 = Al2O3 + 3H2O,
Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O
t◦C
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
39.
В схеме превращенийHСl
КОН
t◦C
Al → AlCl3 → Al(OН)3 → Al2O3 стадия,
1
2
3
на которой сумма всех коэффициентов
наибольшая
А) 1
B) 2,3
C) 2
D) 1, 2
E) 3
Ответ: ...
40.
В схеме превращенийHСl
КОН
t◦C
Al → AlCl3 → Al(OН)3 → Al2O3 стадия,
1
2
3
на которой сумма всех коэффициентов
наибольшая
А) 1
B) 2,3
C) 2
D) 1, 2
E) 3
Ответ: A.
1) 2Al + 6HCl = 2AlCl3 + 3H2
(2+6+2+3=13)
2) AlCl3 + 3KOH = Al(OH)3 + 3KCl (1+3+1+3=8)
3) 2Al(OH)3 = Al2O3 + 3H2O
(2+1+3=6)
41.
Объем водорода (н.у.) выделившейся привзаимодействии с соляной кислотой 2,7 г
алюминия
А) 5,26 л
B) 3,36 л
C) 2,36 л
D) 1,36 л
E) 4,36 л
Ответ: В.
2,7 г
хл
2Al + 6HCl = 2AlCl3 + 3H2↑
2*27 г
3*22,4 л










































 Химия
Химия








