Похожие презентации:
Химические свойства металлов
1. «Химические свойства металлов»
2. Металлы
3. Ряд активности металлов
Увеличениевосстановительных свойств
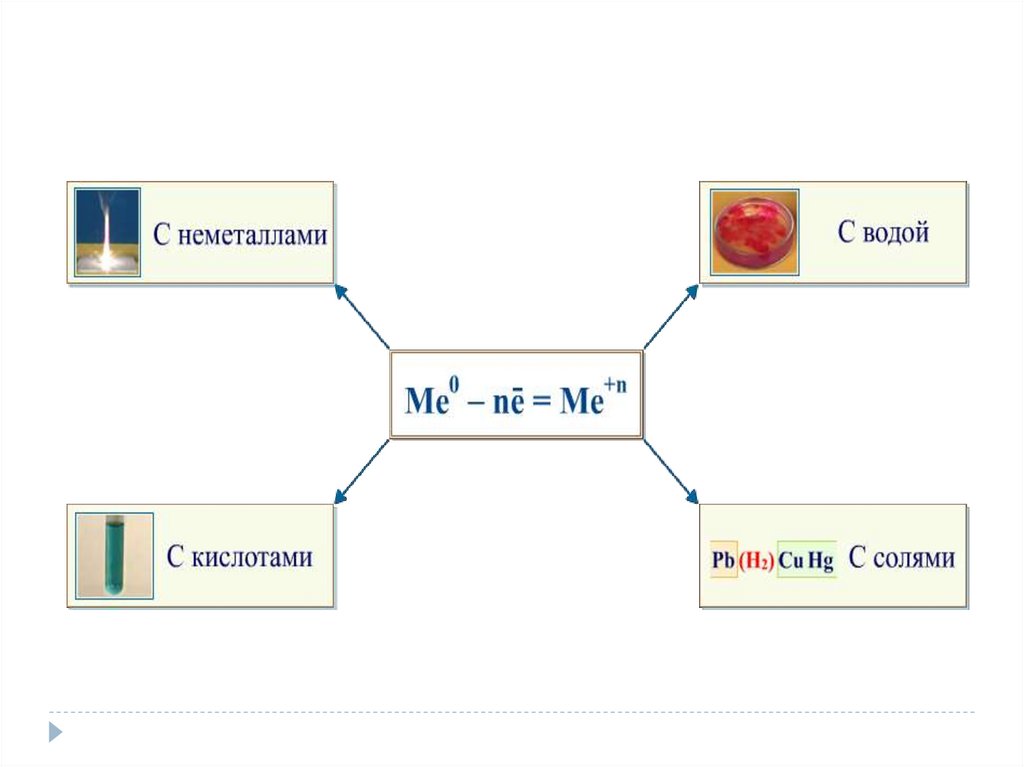
4. Химические свойства металлов
Взаимодействие с неметаллами:с кислородом
Li K Ca Na
Mg Al Zn Cr Fe Ni Pb Cu Hg Ag
При обычных
условиях
Медленно или при
нагревании
M + О2 →
оксид
M + O2 → оксид
Pt Au
M + O2
≠
5. Взаимодействие со сложными веществами:
с водойLi K Ca Na
Mg Al Zn Cr Fe Ni Pb
При обычных
условиях
При нагревании
M + H2O → H2
+ основание
(H2)
Cu Hg Ag Pt
Au
M + H2O ≠
M+H2O→H2+оксид
6. Взаимодействие растворами кислот
Li K Ca Na Mg Al |Zn Cr Fe Ni Pb (H2) Cu Hg Ag Pt AuВытесняют H2↑ из растворов
кислот
Не вытесняют
H2↑ из
растворов
кислот
7. Взаимодействие с растворами солей
Каждый металл вытесняет из растворов солей другиеметаллы, находящиеся правее него в ряду
напряжений, и сам может быть вытеснен металлами,
расположенными левее.
8.
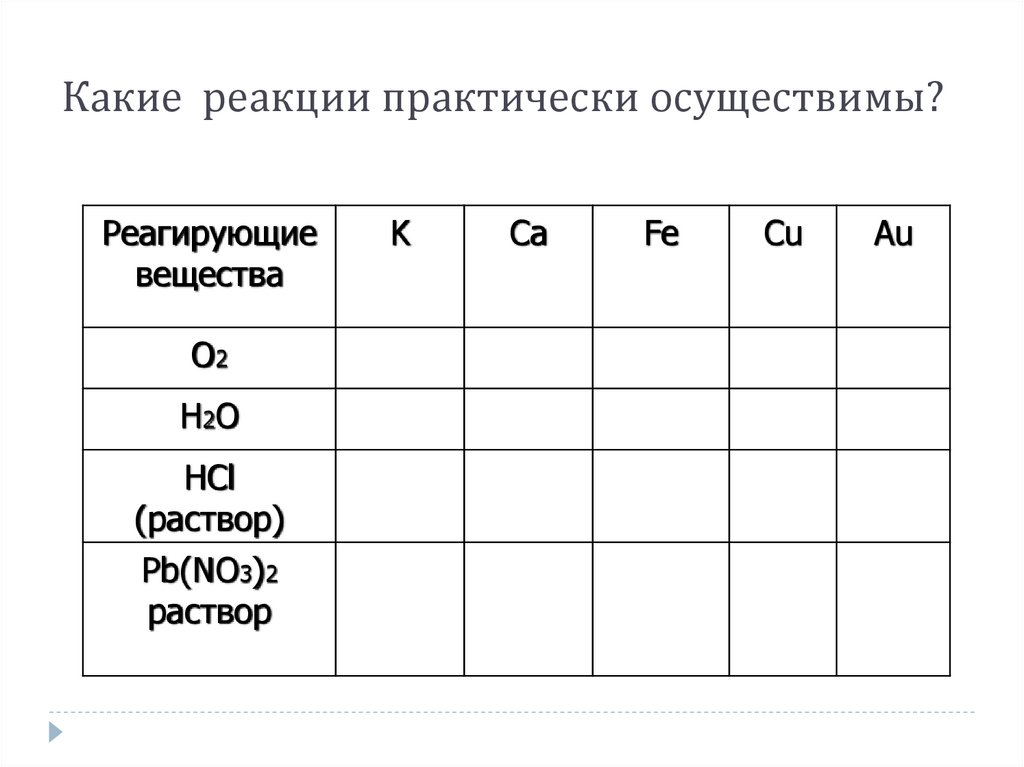
9. Какие реакции практически осуществимы?
Реагирующиевещества
О2
Н2 О
HCl
(раствор)
Pb(NO3)2
раствор
K
Ca
Fe
Cu
Au
10. Какие реакции практически осуществимы?
Реагирующиевещества
Na
Ca
Fe
Cu
Au
О2
HCl
(раствор)
+
+
+
+
+
+
+
+
+
+
-
-
Pb(NO3)2
раствор
+
+
+
-
-
Н2О
11.
1.Zn+2HCl→2.Сu+HCl→
3.Fe+CuSO4→
4.Cu+FeCl2→
5.Cu+O2→
12.
все ли реакции протекали?если не все, то почему?
свойства окислителя или
восстановителя проявляют металлы в
химических реакциях?
13.
1.Zn+2HCl→ZnCL2+H2↑1│Zn0-2e→Zn+2- восстановитель, окисление
1│2H++2e→H2- окислитель, восстановление
2.Сu+HCl≠
3.Fe+CuSO4→FeSO4+Cu
1│Fe0-2e→Fe+2- восстановитель, окисление
1│Cu+2+2e→Cu0- окислитель, восстановление
4.Cu+FeCl2≠
5.2Cu+O2→2CuO
2│Cu0-2e→Cu+2- восстановитель, окисление
1│O20+4e→2O-2- окислитель, восстановление











 Химия
Химия








