Похожие презентации:
Периодический закон Д.И. Менделеева
1.
ПЕРИОДИЧЕСКИЙЗАКОН
Д.И.МЕНДЕЛЕЕВА
2.
Главная характеристика для расположения атомовхимических элементов – атомная масса.
До Д.И.Менделеева это пытались сделать
А.Шанкуртуа во Франции, Д.Ньюлендс в Англии,
Л.Мейер в Германии.
Но Д.И.Менделеев в отличие от всех не только
смотрел на атомную массу, но и на физические и
химические свойства простых веществ.
3.
Он искал закономерность, которая объединяла бы всеэлементы в единую систему.
Но закономерность установить было сложно, потому что было
известно лишь 63 химических элемента. Так же минусом было
то, что атомные массы были неточными.
Д.Менделеев расположил элементы в порядке возрастания
атомных масс и въяснил, что через определенный промежуток
(через определенное количество элементов) у некоторых
элементов похожие физические или химические свойства.
Благодаря этому и образовались группы или естественные
семейства.
4.
5.
6.
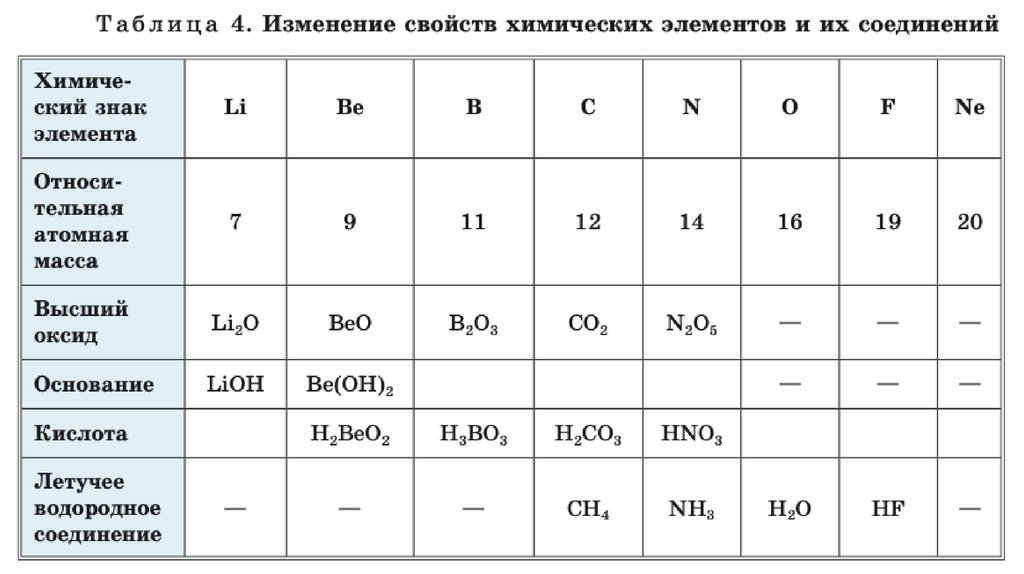
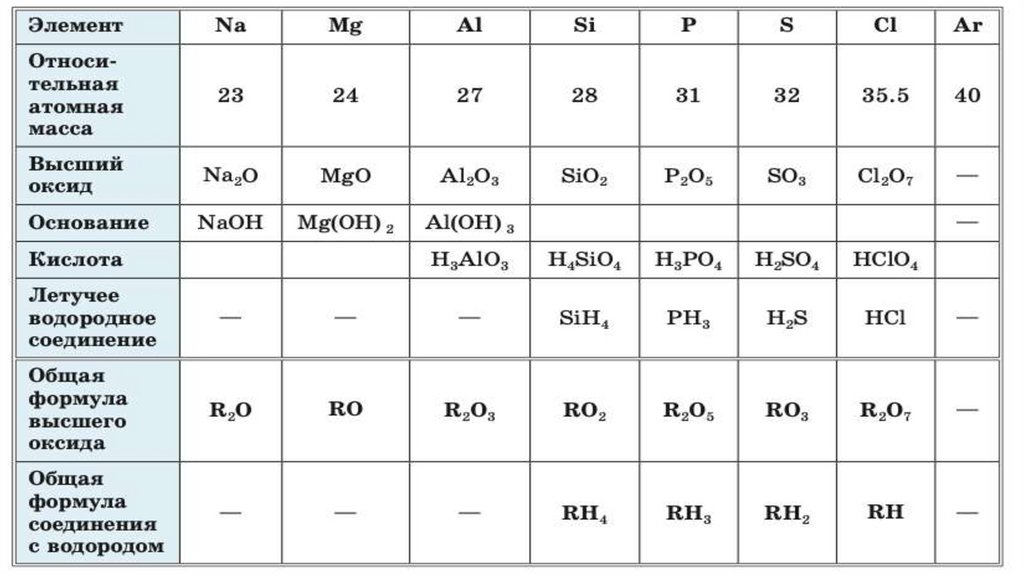
В ряду (в периоде) увеличивается атомная масса, ноуменьшаются металлические свойства и увеличиваются
неметаллические.
Возрастает высшая валентность элементов.
Валентность
неметаллов
в
соединениях убывает от IV до I.
летучих
водородных
Свойства высших оксидов и гидроксидом (оснований или
кислот) изменяются от основных к кислотным.
7.
В последовательном ряду химических элементов их свойстварегулярно повторяются по мере непрерывного увеличения
относительной атомной массы, т.е. изменяются периодически.
Эту закономерность сформулировал Д.И.Менделеев в 1869 г. и
назвал периодическим законом.
Формулировка закона: СВОЙСТВА ПРОСТЫХ ТЕЛ
(ПРОСТЫХ ВЕЩЕСТВ), А ТАКЖЕ СОСТАВ И СВОЙТВА
СОЕДИНЕНИЙ
ЭЛЕМЕНТОВ
НАХОДЯТСЯ
В
ПЕРИОДИЧЕСКОЙ ЗАВИСИМОСТИ ОТ ВЕЛИЧИНЫ
ИХ АТОМНЫХ МАСС.
8.
Сборник задач:№391, №392, №394,
№395.
9.
Домашнее задание:параграф 27, №5, готовимся
к олимпиаде №1 страница
126.







 Химия
Химия








