Похожие презентации:
Органические и неорганические кислоты
1.
Органические инеорганические
кислоты
2.
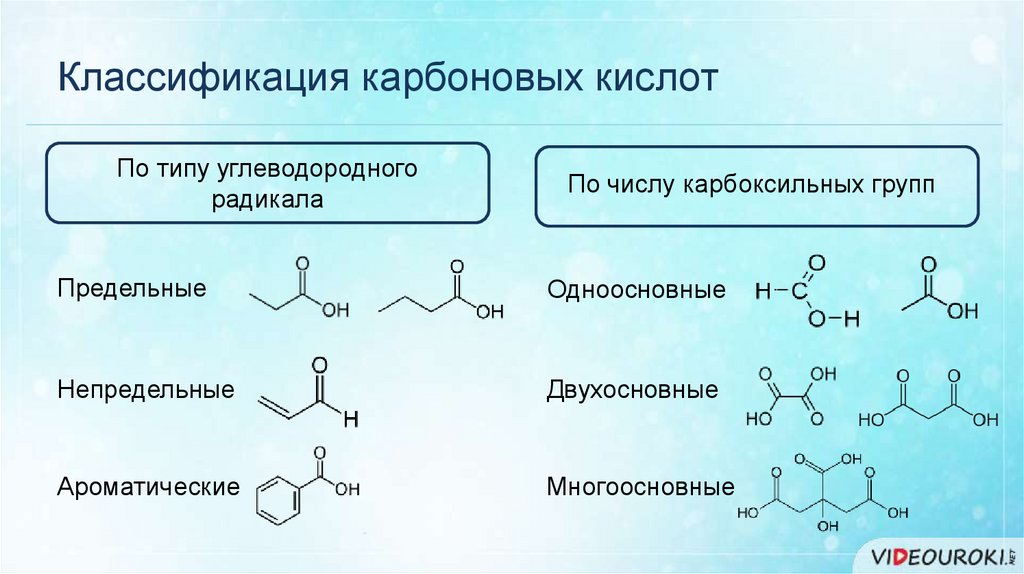
Классификация карбоновых кислотПо типу углеводородного
радикала
По числу карбоксильных групп
Предельные
Одноосновные
Непредельные
Двухосновные
Ароматические
Многоосновные
3.
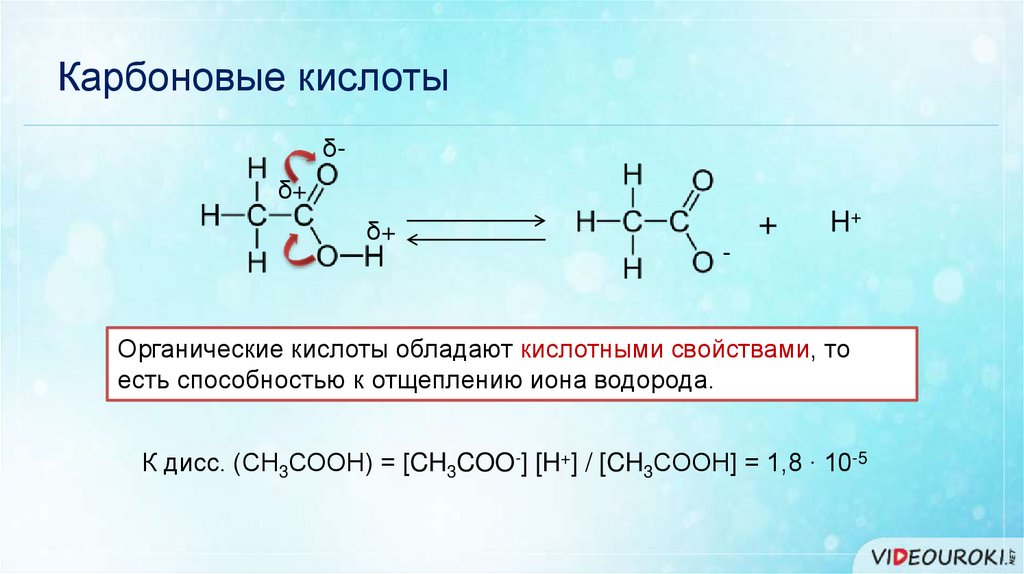
Карбоновые кислотыδδ+
δ+
+
H+
-
Органические кислоты обладают кислотными свойствами, то
есть способностью к отщеплению иона водорода.
К дисс. (СН3СООН) = [CH3COO-] [H+] / [CH3COOH] = 1,8 ∙ 10-5
4.
Карбоновые кислотыСила карбоновых кислот зависит от строения.
HCOOH > CH3COOH > (CH3)2CH – COOH > (CH3)3C – COOH
К дисс. 1,8 · 10-4
1,8 · 10-5
1,4 · 10-5
Введение электроноакцепторных заместителей увеличивает
положительный заряд на атоме водорода и силу кислоты.
СН3СООН < CH2Cl – COOH < CHCl2 – COOH < CCl3 – COOH
К дисс. = 1,8 · 10-5
1,4 · 10-3
5,0 · 10-2
2,0 · 10-1
5.
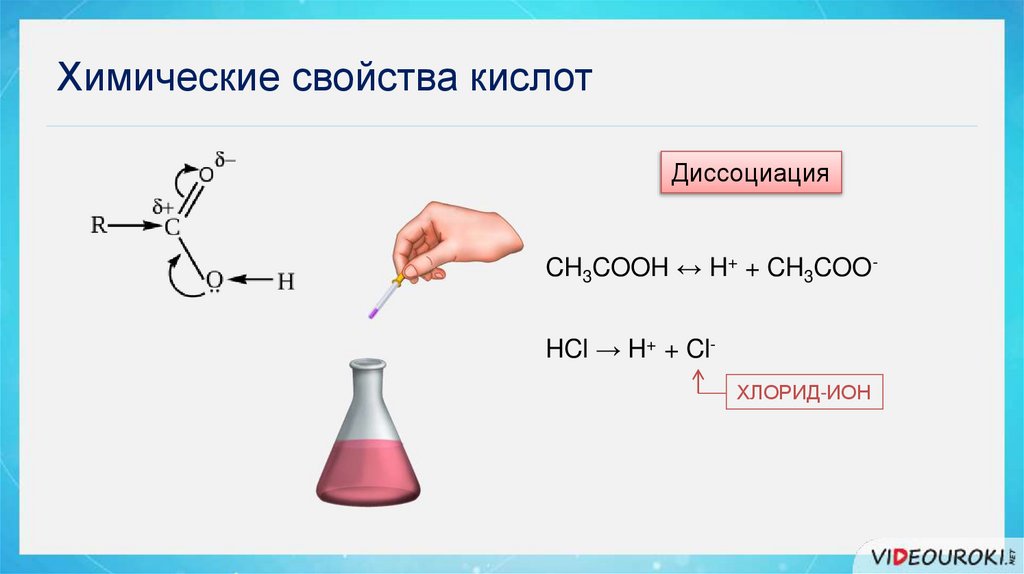
Химические свойства кислотДиссоциация
CH3COOH ↔ H+ + CH3COOАЦЕТАТ-ИОН
6.
Химические свойства кислотДиссоциация
CH3COOH ↔ H+ + CH3COOHCl → H+ + ClХЛОРИД-ИОН
7.
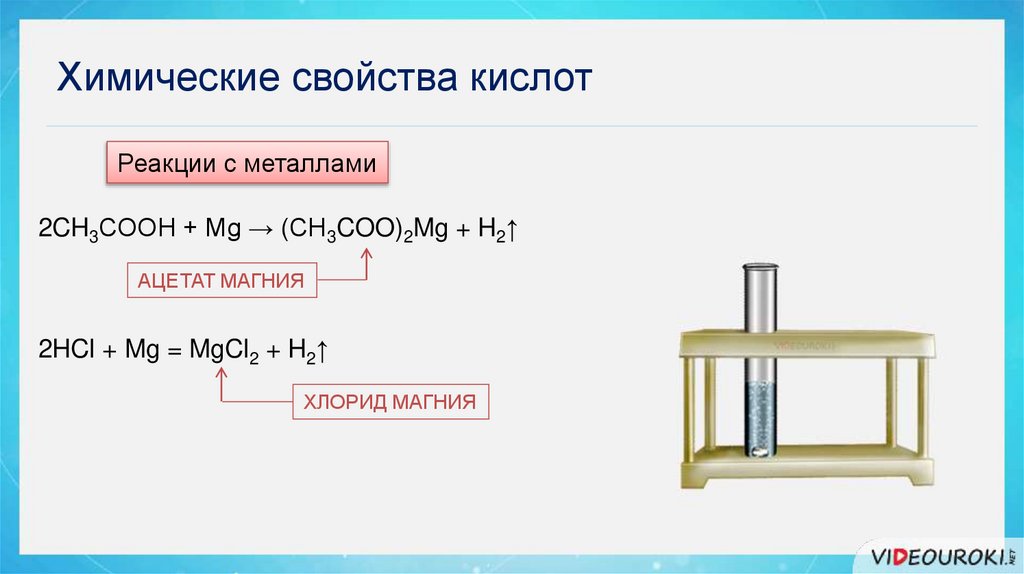
Химические свойства кислотРеакции с металлами
2CH3COOH + Mg → (CH3COO)2Mg + H2↑
АЦЕТАТ МАГНИЯ
2HCl + Mg = MgCl2 + H2↑
ХЛОРИД МАГНИЯ
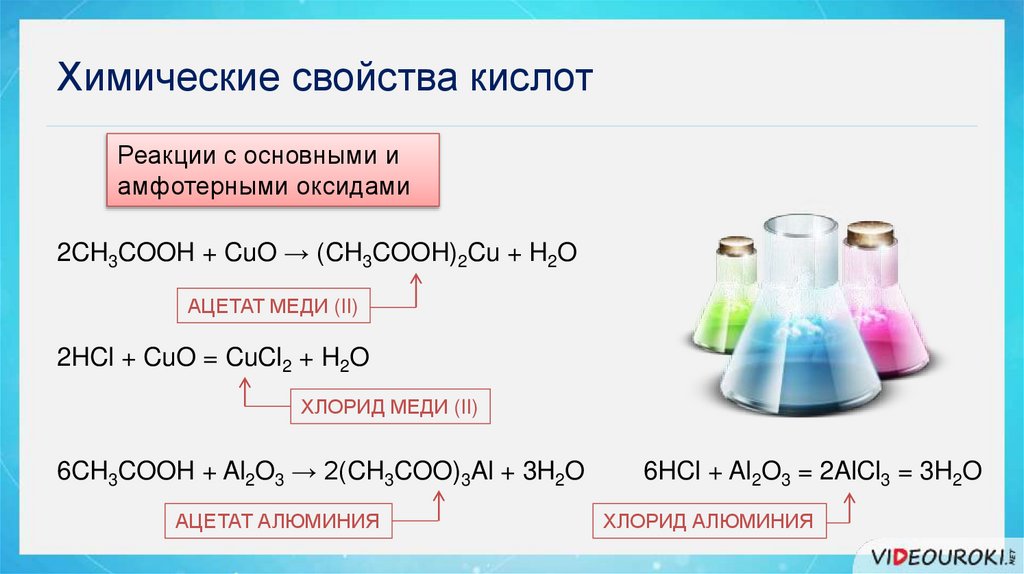
8.
Химические свойства кислотРеакции с основными и
амфотерными оксидами
2CH3COOH + CuO → (CH3COOH)2Cu + H2O
АЦЕТАТ МЕДИ (II)
2HCl + CuO = CuCl2 + H2O
ХЛОРИД МЕДИ (II)
6CH3COOH + Al2O3 → 2(CH3COO)3Al + 3H2O
АЦЕТАТ АЛЮМИНИЯ
6HCl + Al2O3 = 2AlCl3 = 3H2O
ХЛОРИД АЛЮМИНИЯ
9.
Химические свойства кислотРеакции с основаниями
CH3COOH + KOH → CH3COOK + H2O
АЦЕТАТ КАЛИЯ
HCl + KOH = KCl + H2O
ХЛОРИД КАЛИЯ
10.
Химические свойства кислотРеакции с аммиаком
CH3COOH + NH3 → CH3COONH4
АЦЕТАТ АММОНИЯ
Реакции с солями
2CH3COOH + Na2CO3 →
→ 2CH3COONa + CO2↑ + H2O
АЦЕТАТ НАТРИЯ
2HCl + Na2CO3 = 2NaCl + CO2↑ + H2O
HCl + NH3 = NH4Cl
ХЛОРИД АММОНИЯ
ХЛОРИД НАТРИЯ
11.
Химические свойстваорганических кислот
обусловлены в основном
наличием в молекуле
карбоксильной группы.
Общие свойства органических и
неорганических кислот
проявляются в реакциях с
основаниями, некоторыми
активными металлами,
основными, амфотерными
оксидами и солями более
слабых кислот.






 Химия
Химия








