Похожие презентации:
Свойства карбоновых кислот
1.
Свойства карбоновых кислот2.
Среди карбоновых кислот нет газов.Это объясняется тем, что между молекулами карбоновых
кислот (также как и спиртов) образуются водородные
связи и образуют цепочки из молекул (ассоциаты)
Температура кипения карбоновых кислот выше , чем у
спиртов с одинаковым числом атомов углерода. Это
объясняется тем, что между молекулами карбоновых
кислот образуется две водородные связи.
3.
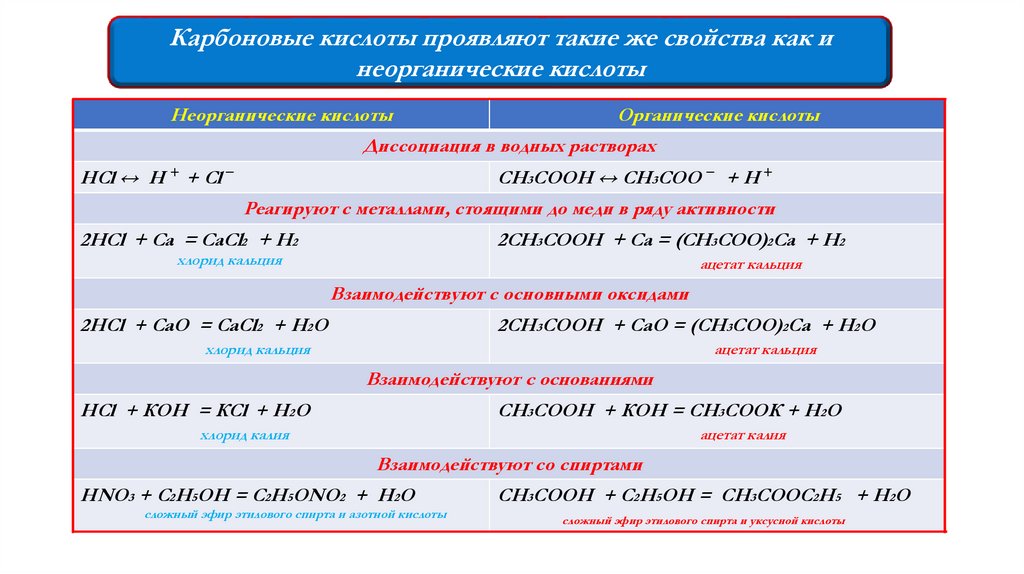
Карбоновые кислоты проявляют такие же свойства как инеорганические кислоты
Неорганические кислоты
Органические кислоты
Диссоциация в водных растворах
НСl ↔ Н + + Сl −
CH3COOH ↔ CH3COO − + Н +
Реагируют с металлами, стоящими до меди в ряду активности
2НСl + Са = СаСl2 + Н2
2CH3COOH + Са = (CH3COO)2Са + H2
хлорид кальция
ацетат кальция
Взаимодействуют с основными оксидами
2НСl + СаО = СаСl2 + Н2О
2CH3COOH + СаО = (CH3COO)2Са + H2О
хлорид кальция
ацетат кальция
Взаимодействуют с основаниями
НСl + КОН = КСl + Н2О
CH3COOH + КОН = CH3COOК + H2О
хлорид калия
ацетат калия
Взаимодействуют со спиртами
HNO3 + C2H5OH = C2H5ONO2 + H2O
сложный эфир этилового спирта и азотной кислоты
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
сложный эфир этилового спирта и уксусной кислоты
4.
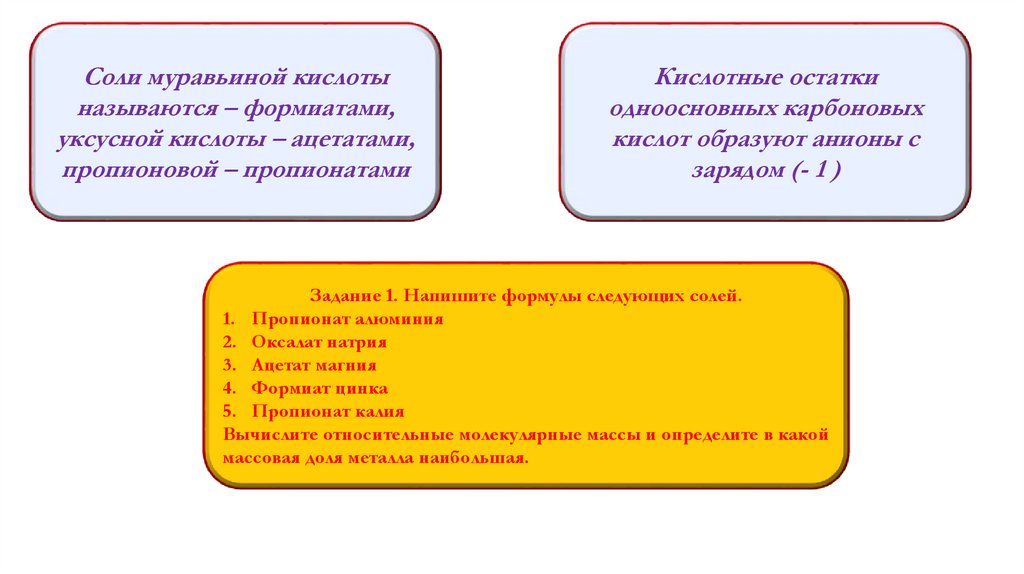
Соли муравьиной кислотыназываются – формиатами,
уксусной кислоты – ацетатами,
пропионовой – пропионатами
Кислотные остатки
одноосновных карбоновых
кислот образуют анионы с
зарядом (- 1 )
Задание 1. Напишите формулы следующих солей.
1. Пропионат алюминия
2. Оксалат натрия
3. Ацетат магния
4. Формиат цинка
5. Пропионат калия
Вычислите относительные молекулярные массы и определите в какой
массовая доля металла наибольшая.
5.
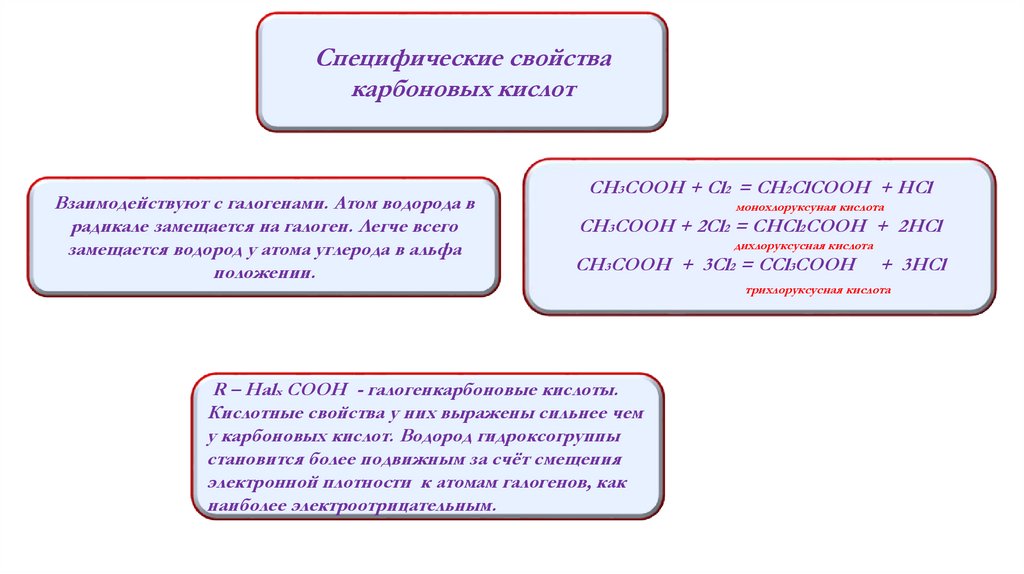
Специфические свойствакарбоновых кислот
Взаимодействуют с галогенами. Атом водорода в
радикале замещается на галоген. Легче всего
замещается водород у атома углерода в альфа
положении.
СН3СООН + Cl2 = CH2ClCOOH + HCl
монохлоруксуная кислота
СН3СООН + 2Cl2 = CHCl2COOH + 2HCl
дихлоруксусная кислота
CH3COOH + 3Cl2 = CCl3COOH
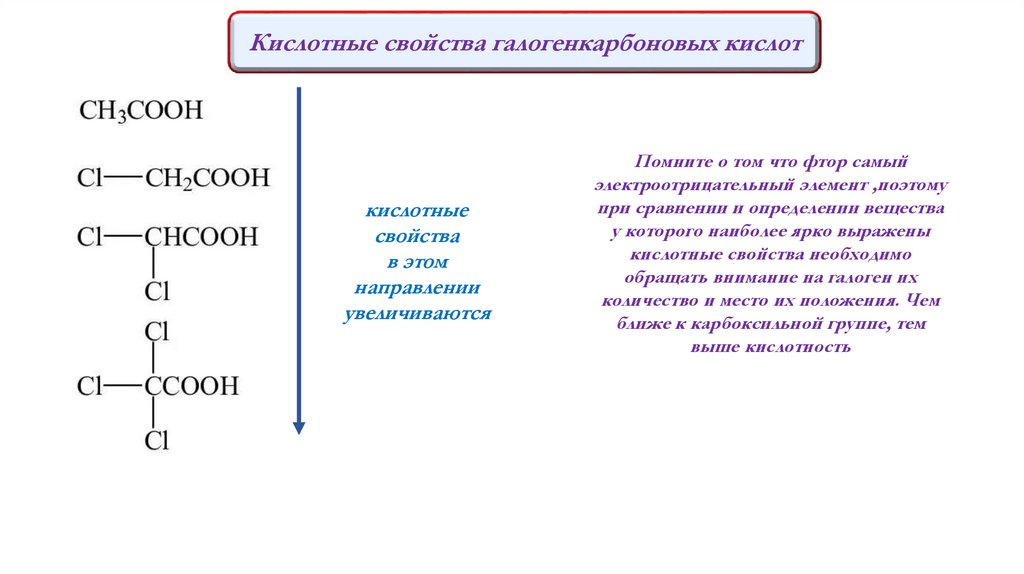
R – Halx COOH - галогенкарбоновые кислоты.
Кислотные свойства у них выражены сильнее чем
у карбоновых кислот. Водород гидроксогруппы
становится более подвижным за счёт смещения
электронной плотности к атомам галогенов, как
наиболее электроотрицательным.
+ 3HCl
трихлоруксусная кислота
6.
Кислотные свойства галогенкарбоновых кислоткислотные
свойства
в этом
направлении
увеличиваются
Помните о том что фтор самый
электроотрицательный элемент ,поэтому
при сравнении и определении вещества
у которого наиболее ярко выражены
кислотные свойства необходимо
обращать внимание на галоген их
количество и место их положения. Чем
ближе к карбоксильной группе, тем
выше кислотность


 Химия
Химия