Похожие презентации:
Электрический ток в металлах и электролитах. Законы Фарадея
1.
2. Тема: «Электрический ток в металлах и электролитах. Законы Фарадея»
3. План
1. Электрический ток в металлах2. Электролитическая
диссоциация. Электролиз
3. Законы Фарадея
4. Применение электролиза в
технике
4.
ВеществаРазные вещества имеют различные электрические свойства, однако по
электрической проводимости их можно разделить на 3 основные
группы:
Электрические
свойства веществ
Проводники
Хорошо проводят
электрический ток
К ним относятся металлы,
электролиты, плазма …
Наиболее используемые
проводники – Au, Ag, Cu,
Al, Fe …
Полупроводники
Занимают по проводимости
промежуточное
положение между
проводниками и
диэлектриками
Si, Ge, Se, In, As
Диэлектрики
Практически не проводят
электрический ток
К ним относятся
пластмассы, резина,
стекло, фарфор, сухое
дерево, бумага …
5.
6. Природа электрического тока в металлах
Электрический ток в металлахПрирода электрического тока
в металлах
Электрический ток в металлических проводниках никаких
изменений в этих проводниках, кроме их нагревания не
вызывает.
Концентрация электронов проводимости в металле очень
велика: по порядку величины она равна числу атомов в
единице объёма металла. Электроны в металлах находятся в
непрерывном движении. Их беспорядочное движение
напоминает движение молекул идеального газа. Это дало
основание считать, что электроны в металлах образуют
своеобразный электронный газ. Но скорость
беспорядочного движения электронов металле значительно
больше скорости молекул в газе (она составляет примерно
105 м/с).
7.
Электрический ток в металлах• Наиболее убедительное доказательство электронной
природы тока в металлах было получено в опытах с
инерцией электронов. Идея таких опытов и первые
качественные результаты принадлежат русским физикам
Л. И. Мандельштаму и Н. Д. Папалекси (1913 г.).
• В 1916 году американский физик Р. Толмен и шотландский
физик Б. Стюарт усовершенствовали методику этих
опытов и выполнили количественные измерения,
неопровержимо доказавшие, что ток в металлических
проводниках обусловлен движением электронов.
8. Опыт Папалекси-Мандельштама
Электрический ток в металлахОпыт Папалекси-Мандельштама
• Описание опыта :
• Цель: выяснить какова
проводимость металлов.
• Установка: катушка на
стержне со скользящими
контактами, присоединены к
гальванометру.
• Ход эксперимента: катушка
раскручивалась с большой
скоростью, затем резко
останавливалась, при этом
наблюдался отброс стрелки
гальванометра.
• Вывод: проводимость
металлов - электронная.
9.
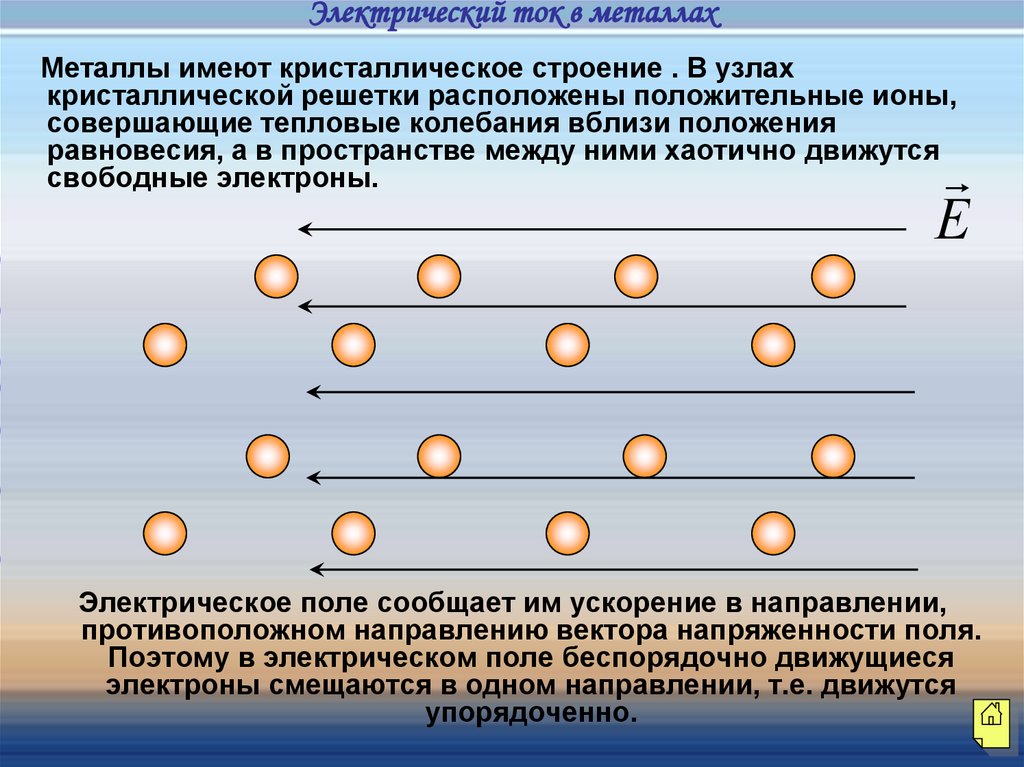
Электрический ток в металлахМеталлы имеют кристаллическое строение . В узлах
кристаллической решетки расположены положительные ионы,
совершающие тепловые колебания вблизи положения
равновесия, а в пространстве между ними хаотично движутся
свободные электроны.
Е
Электрическое поле сообщает им ускорение в направлении,
противоположном направлению вектора напряженности поля.
Поэтому в электрическом поле беспорядочно движущиеся
электроны смещаются в одном направлении, т.е. движутся
упорядоченно.
10. 1). Носителями тока в металлах являются электроны, движение которых подчиняется законом классической механики. 2). Поведение
Основные положения классической теорииэлектронной проводимости
1). Носителями тока в металлах являются электроны,
движение которых подчиняется законом классической
механики.
2). Поведение электронов подобно поведению молекул
идеального газа (электронный газ).
3). При движении электронов в кристаллической
решетке можно не учитывать столкновения электронов
друг с другом.
4). При упругом столкновении электронов с ионами
электроны полностью передают им накопленную в
электрическом поле энергию.
11.
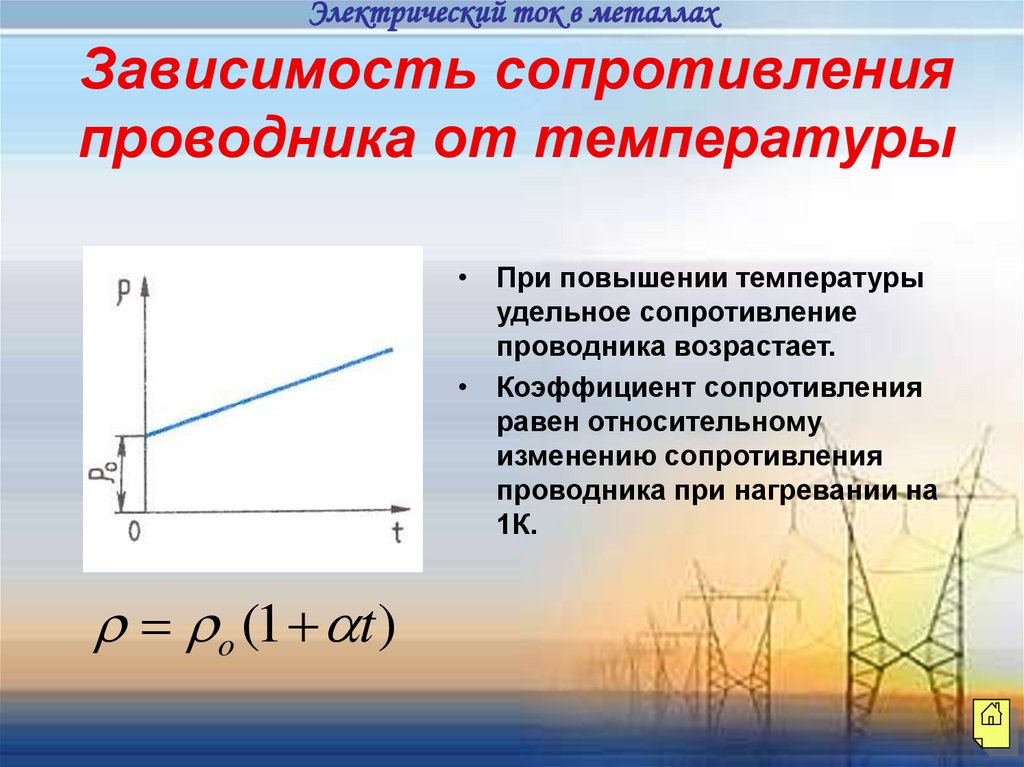
Электрический ток в металлахЗависимость сопротивления
проводника от температуры
• При повышении температуры
удельное сопротивление
проводника возрастает.
• Коэффициент сопротивления
равен относительному
изменению сопротивления
проводника при нагревании на
1К.
o (1 t )
12.
Электрический ток в металлахСверхпроводимость
Сверхпроводимость — физическое явление, заключающееся
в скачкообразном падении до нуля сопротивления вещества.
В то время, как в обычных проводниках под влиянием
магнитного поля ток в металле смещается, в
сверхпроводниках это явление отсутствует. Ток в
сверхпроводнике как бы закреплен на своем месте.
Сверхпроводимость исчезает под действием
следующих факторов:
• повышение температуры;
• действие достаточно сильного магнитного поля;
• достаточно большая плотность тока в образце;
Переход от сверхпроводящего состояния в нормальное
можно осуществить путем повышения магнитного поля при
температуре ниже критической Tс.
13.
Электрический ток в металлахСверхпроводимость
В 1911 г. голландский физик Камерлинг-Оннес
обнаружил, что при охлаждении ртути в жидком
гелии её сопротивление сначала меняется
постепенно, а затем при температуре 4,2 К очень
резко падает до нуля. Это явление было названо
сверхпроводимостью.
Температура Тк, при которой происходит переход в
сверхпроводящее состояние , называется
критической температурой перехода. Для таллия,
олова и свинца она равна соответственно 2,35 К,
3,73 К и 7,19 К. Впоследствии было открыто много
других сверхпроводников.
КАМЕРЛИНГ-ОННЕС
21.09.1853 – 21.02.1926
Нобелевская премия по
физике,
1913 г.
14.
Электрический ток в металлахМультиэлектрон
Мультиэлектрон (me) – это новая, ранее неизвестная, квантовая
частица,которая образуется из двух и более электронов в силовом поле
атома.
Сила притяжения между электронами аналогична силе,
связывающей протоны и нейтроны в ядре атома (сила Юкавы).
Эта сила уравновешивает отталкивание между отрицательно
заряженными электронами и приводит к взаимному вращению
электронов вокруг общей оси.
15.
Электрический ток в металлахДвижение электронов в обычном
проводнике
Электроны сталкиваются с кристаллической решеткой
и теряют свою кинетическую энергию, которая идет
на нагрев решетки. Поэтому возникает электрическое
сопротивление.
16.
Электрический ток в металлахДвижение мультиэлектрона в
сверхпроводнике
Кинетическая энергия электронов, составляющих мультиэлектрон
переходит во вращательную энергию частицы. Поэтому мультиэлектрон
не сталкивается с кристаллической решеткой и не испытывает
сопротивления. Так возникает сверхпроводимость.
17.
Электрический ток в металлахПрименение
Примечания
крупномасштабное
а) экранирование
Сверхпроводник не пропускает
магнитный поток, следовательно, он
экранирует электромагнитное излучение.
Используется в микроволновых
устройствах, защита от излучения при
ядерном взрыве.
сильноточные
устройства
а) магниты - научноисследовательское
оборудование
- магнитная левитация
Магниты используются в ускорителях
частиц и установках термоядерного
синтеза.
Интенсивно проводятся работы по
созданию поездов на магнитной подушке.
другие применения
а) передача энергии
б) аккумулирование
в) вращающиеся
электрические машины
Возможность аккумулировать
электроэнергию в виде циркулирующего
тока. Комбинация полупроводниковых и
сверхпроводящих приборов открывает
новые возможности в
18.
19.
Электролитическаядиссоциация.
Электролиз
20. Электролитическая диссоциация. Электролиз.
Электролиты – это вещества, растворыили расплавы которых проводят
электрический ток:
- расплавленные металлы и соли;
- растворы кислот, солей, щелочей.
21. Электролитическая диссоциация. Электролиз.
22. Электролитическая диссоциация. Электролиз.
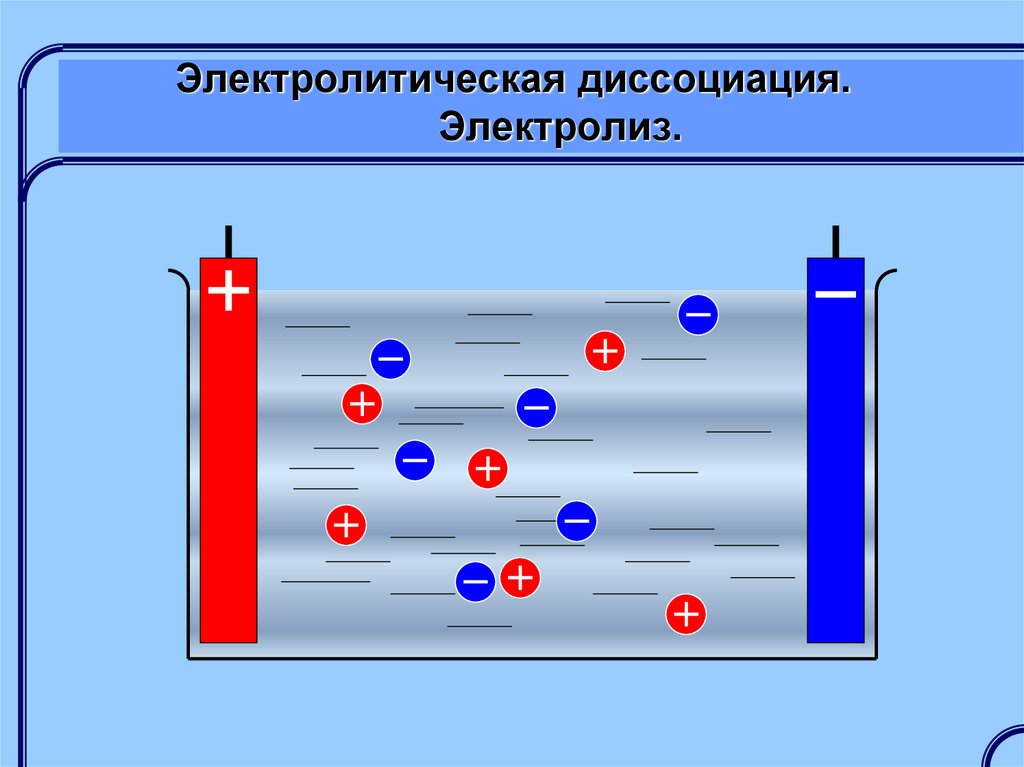
Электролитическая диссоциация – этораспад молекул растворенного
вещества (электролита) на заряженные
ионы.
23. Электролитическая диссоциация. Электролиз.
H2ONa
Cl
24. Электролитическая диссоциация. Электролиз.
25. Электролитическая диссоциация. Электролиз.
Электролиз – это изменение химическогосостава раствора или расплава при
прохождении через него электрического
тока.
26. Электролитическая диссоциация. Электролиз.
Майкл Фарадей (1791-1867) –английский физик, автор
законов электролиза
27.
Законы Фарадея28. Законы Фарадея
Первый закон ФарадеяМасса вещества, выделившегося
на электроде, пропорциональна
электрическому заряду,
прошедшему через электролит.
29. Законы Фарадея
m=k∙qq = I ∙ Dt
m = k ∙ I ∙ Dt
k – электрохимический эквивалент
30. Законы Фарадея
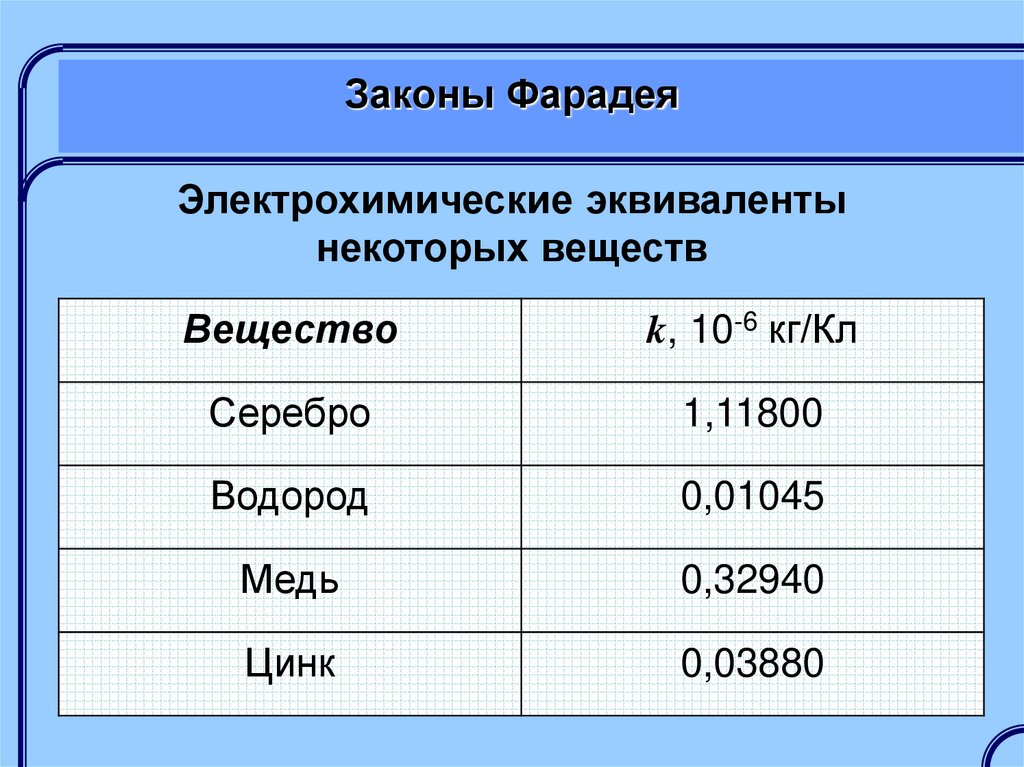
Электрохимические эквивалентынекоторых веществ
Вещество
k, 10-6 кг/Кл
Серебро
1,11800
Водород
0,01045
Медь
0,32940
Цинк
0,03880
31. Законы Фарадея
Второй закон Фарадея (законэлектролиза)
Электрохимический эквивалент
вещества прямо пропорционален
отношению молекулярной массы
к его валентности.
32. Законы Фарадея
1 Mk
F n
F - постоянная Фарадея
F = 96,5∙103 Кл/моль
33. Законы Фарадея
m = m0i ∙ NiM
m0i
NA
M
m
I Dt
n e NA
m = k ∙ I ∙ Dt
Dq I Dt
Ni
q0 i
n e
кг
M
[k ]
k
n e NA
Кл
34. Законы Фарадея
Mm
I Dt
n e NA
M
e
I Dt
n m NA
Заряд электрона
e = 1,6∙10-19 Кл
35.
Пример и разбор решения задач:1.Источник тока присоединили к двум пластинам, опущенным в раствор
поваренной соли. Сила тока в цепи равна 0,3 А. Какой заряд проходит между
пластинами в ванне за 7 минут?
Решение: Сила тока равна отношению заряда ко времени, в течение которого
этот электрический заряд прошёл по цепи:
Подставив числовые значения, переведя время в СИ, получим q = 126 Кл.
Правильный ответ: q = 126 Кл.
2.В процессе электролиза из водного раствора хлорида железа-2 выделилось
840 мг железа. Какой заряд прошёл через электролитическую ванну?
Решение:
q = 840 · 10-6· 1,6 · 10-19 · 2 · 6,02 · 1023 / 0,056 = 2880 Кл.
Ответ: q = 2880 Кл.
36.
Применениеэлектролиза в
технике
37. Применение электролиза в технике
1.Гальваностегия2.Гальванопластика
3.Получение и очистка металлов
38. Применение электролиза в технике
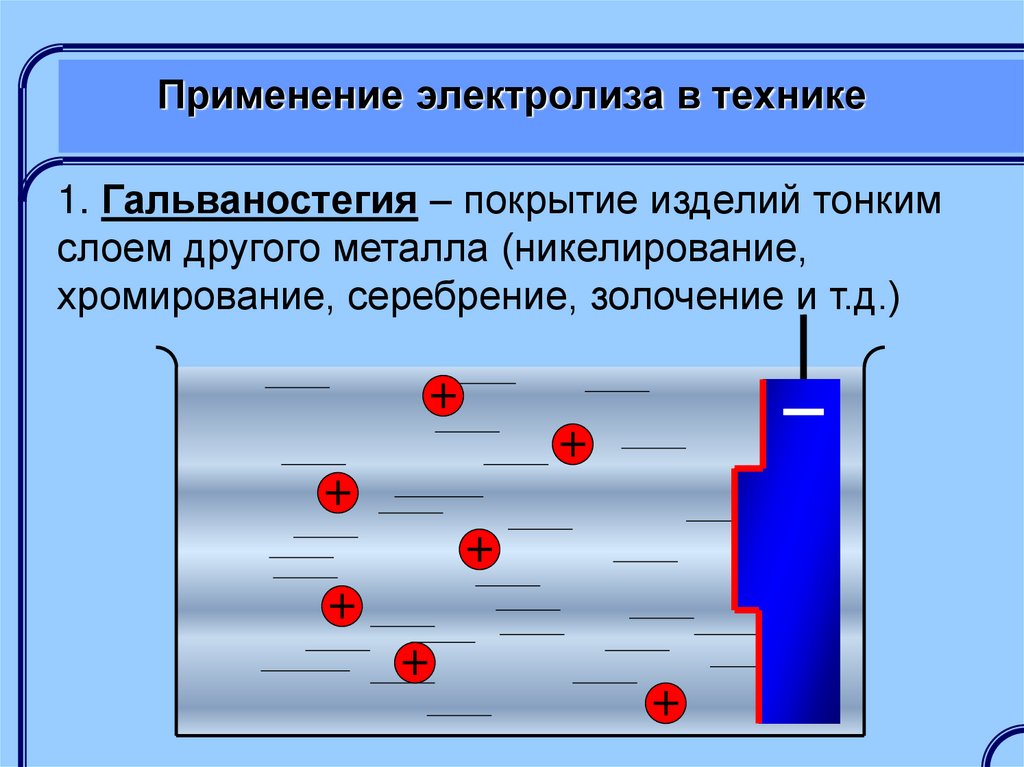
1. Гальваностегия – покрытие изделий тонкимслоем другого металла (никелирование,
хромирование, серебрение, золочение и т.д.)
39. Применение электролиза в технике
1. Гальваностегия – покрытие изделий тонкимслоем другого металла (никелирование,
хромирование, серебрение, золочение и т.д.)
40. Применение электролиза в технике
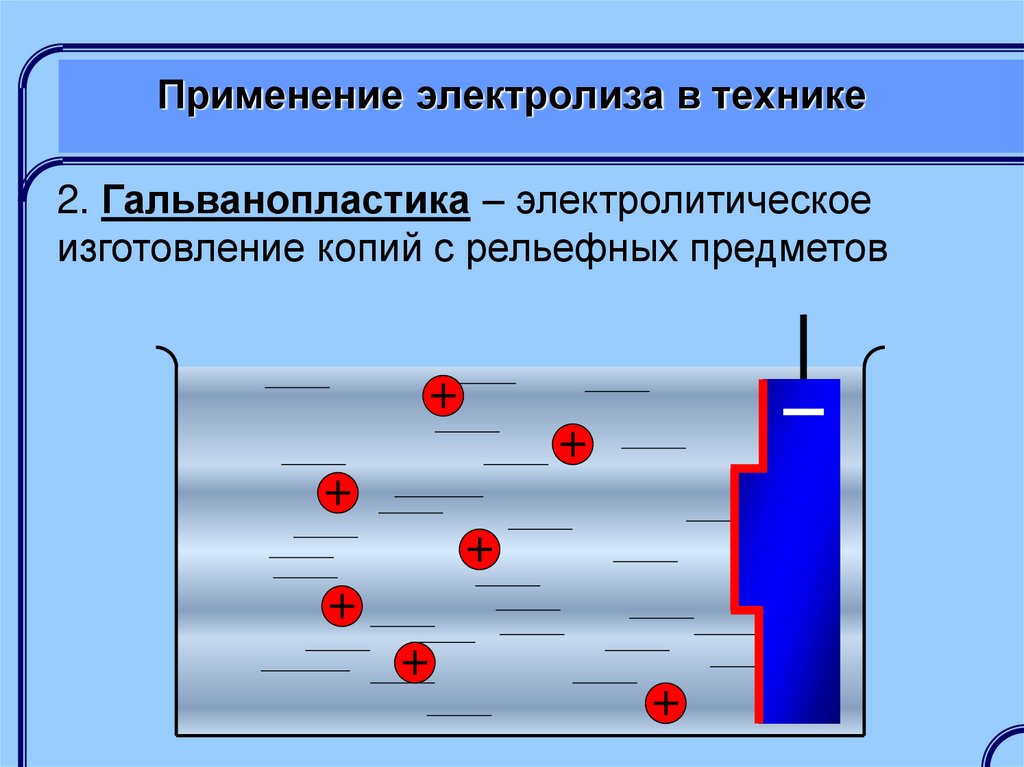
2. Гальванопластика – электролитическоеизготовление копий с рельефных предметов
41. Применение электролиза в технике
2. Гальванопластика – электролитическоеизготовление копий с рельефных предметов
Якоби Борис Семенович (1801-1874) –
изобретатель процесса гальванопластики
42. Применение электролиза в технике
2. Гальванопластика – электролитическоеизготовление копий с рельефных предметов
Исаакиевский собор,
Санкт-Петербург
43. Применение электролиза в технике
2. Гальванопластика – электролитическоеизготовление копий с рельефных предметов
44. Применение электролиза в технике
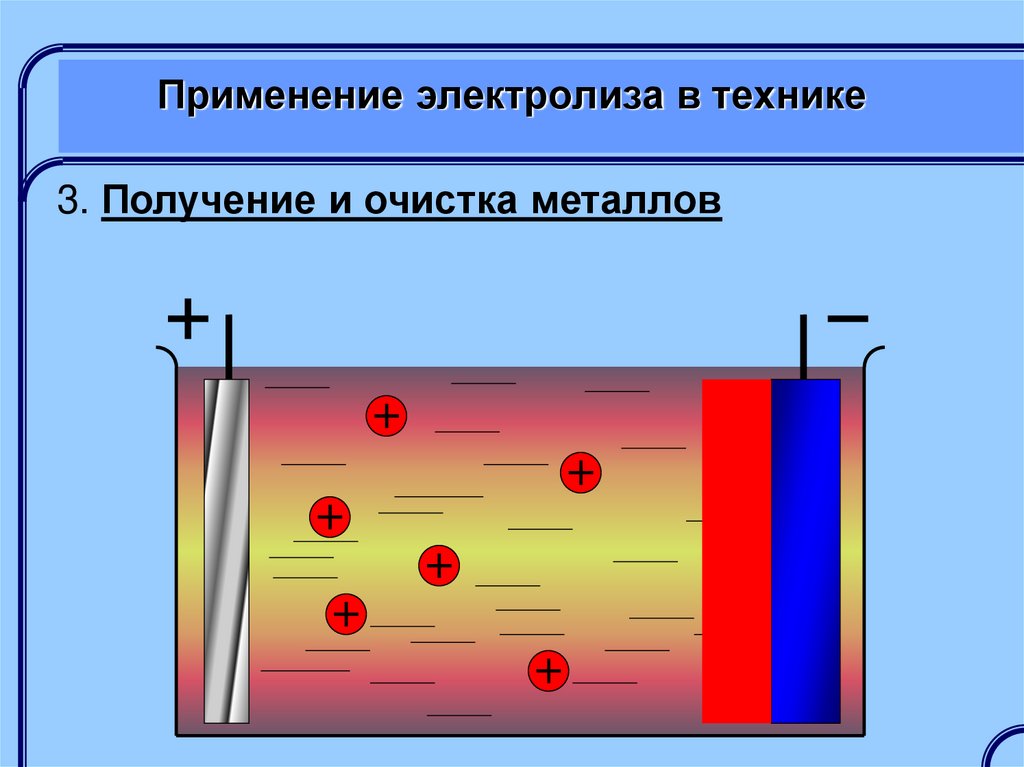
3. Получение и очистка металловПолучение металлов обычно осуществляется
электролизом расплавов с выделением получаемого
металла на катоде
Очистка металлов осуществляется
электролитическим растворением анода из
загрязненного металла, на катоде выделяется
чистый металл, а примеси выпадают в осадок
45. Применение электролиза в технике
3. Получение и очистка металлов46. Применение электролиза в технике
3. Получение и очистка металлов47. Применение электролиза в технике
3. Получение и очистка металловРафинирование меди
Получение алюминия







































 Физика
Физика








