Похожие презентации:
Комплеконометрическое титрование
1.
Комплеконометрическоетитрование
2.
Понятие о комплексонах, их применениев АХ
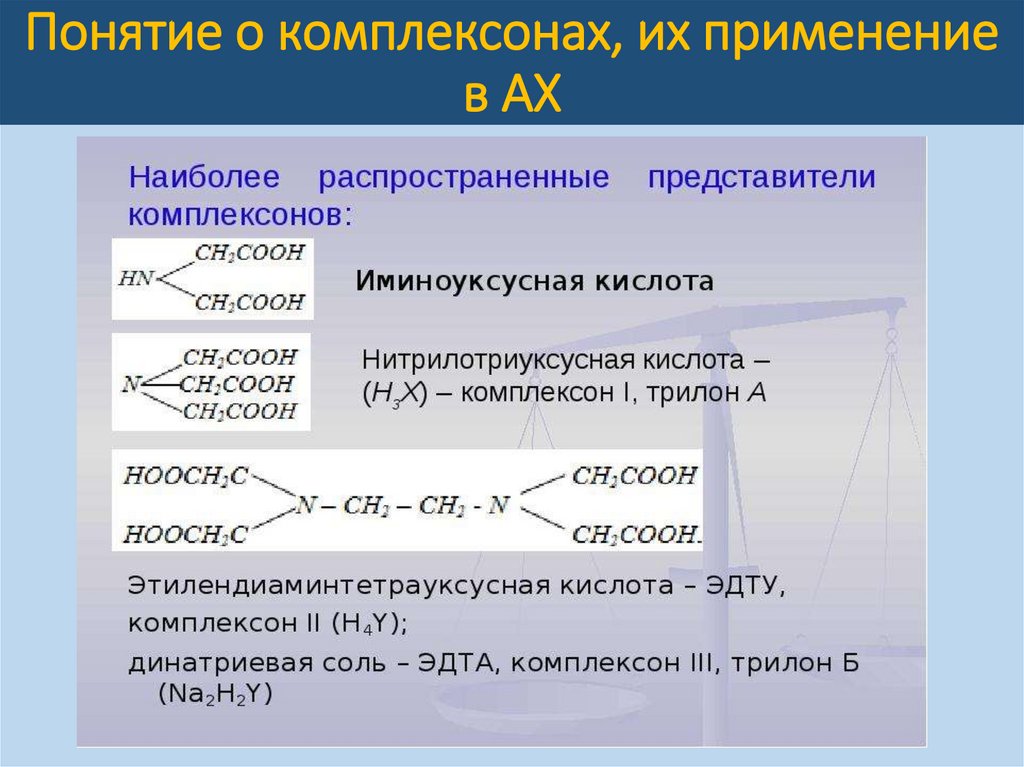
Комплексонами называют органические
соединения,
представляющие
собой
производные
аминополикарбоновых
кислот.
Простейший
комплексон
нитрилотриуксусная
кислота
(НТА,
комплексон I, H3Y) – (CH2COOH)3N.
Наибольшее
значение
имеет
четырехосновная
этилендиаминтетрауксусная кислота (ЭДТУ,
комплексон II, H4Y).
3.
Понятие о комплексонах, их применениев АХ
4.
Понятие о комплексонах, их применениев АХ
Комплексоны наряду с карбоксильными
группами (-СООН) имеют аминный азот (=-N),
благодаря такому строению эти соединения
отличаются
полидентатностью,
т.е.
способностью образовывать сразу несколько
координационных связей с ионами металловкомплексообразователей (Ме-КО).
На практике обычно применяют двунатриевую
соль этой кислоты (ЭДТА, Na-ЭДТА, комплексон
III или трилон Б, Na2H2Y).
5.
Понятие о комплексонах, их применениев АХ
ЭДТА образует со многими катионами
устойчивые
малодиссоциированные
растворимые в воде внутрикомплексные соли –
хелаты. Они настолько устойчивы, что наличие
катиона в растворе невозможно определить
качественными реакциями. Реакции между
комплексонами и ионами Ме-КО протекают
стехиометрически, т.е. в строго эквивалентных
отношениях. Это свойство применяется для
определения многих катионов: Ca2+, Zn2+, Mg2+,
Cu2+, Al3+, In3+.
6.
Понятие о комплексонах, их применениев АХ
Комплексоны имеют ряд характерных
особенностей:
• 1) хорошо растворимы в воде и других
растворителях;
• 2) легко реагируют со многими металлами с
образованием устойчивых внутрикомплексных
комплексных соединений (ВКС);
• 3)
некоторые
обладают
избирательным
действием по отношению к тем или иным
катионам.
7.
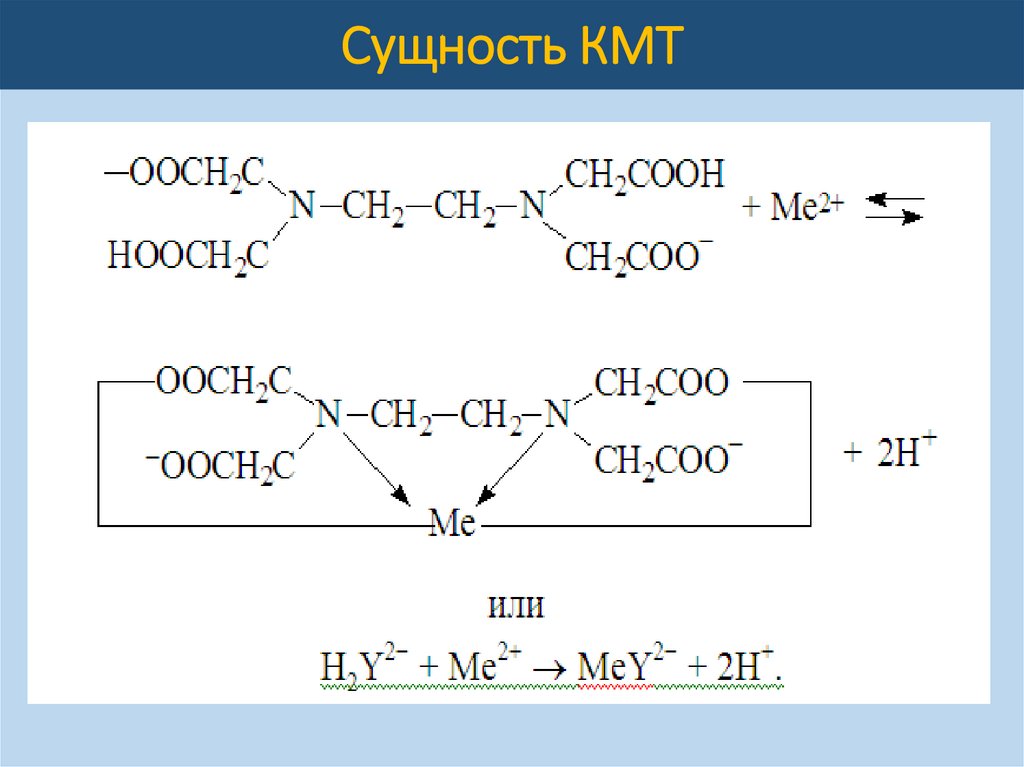
Сущность КМТКМТ – метод анализа, основанный на
использовании реакций ионов Ме-КО с
комплексонами,
сопровождающихся
образованием
устойчивых
малодиссоциированных растворимых в воде
ВКС. Они образуются в результате замещения
атомов водорода функциональных групп
органического реагента (-СООН) на катион
металла. Одновременно катион металла
взаимодействует с атомами азота аминогруппы
посредством координационной связи:
8.
Сущность КМТ9.
Сущность КМТСо всеми ионами металлов (кроме одновалентных)
ЭДТА реагирует в отношениях 1:1. В умеренно кислых
растворах эти реакции могут быть записаны в
следующем
виде
(в
заключительной
стадии
определения):
H2Y2- + Ме2+ = MeY2- + 2Н+,
H2Y2- + Ме3+ = MeY- + 2Н+,
H2Y2- + Ме4+ = MeY + 2Н+.
Таким образом, молярная масса эквивалента любого
металла будет равна 1/2 его атомной массы, а
образующиеся соединения очень прочные, их
Кнест < 10-26.
10.
Сущность КМТПоскольку
степень
комплексообразования
зависит от рН, титрование раствором ЭДТА
проводят при постоянном значении рН, которое
достигается добавлением буферного раствора.
В качестве индикаторов применяют интенсивно
окрашенные красители (металлоиндикаторы),
образующие с титруемыми ионами металлов
комплексы различной окраски. Чаще всего в
практике используют эриохром черный Т,
мурексид и др.
При этом используют метод
прямого и обратного титрования.
11.
Сущность КМТВ методе прямого титрования определение
катионов Ме ведут при заданном значении рН
стандартным
раствором
ЭДТА.
Т.Э.
устанавливают
с
помощью
металлоиндикаторов (Ме-Ind).
При титровании ЭДТА такого окрашенного КС
оно
постепенно
разлагается
вследствие
образования нового более прочного ВКС
катиона Ме с комплексоном. В Т.Э.
первоначальный
цвет
КС,
образуемого
индикатором с катионом Ме исчезает, и
появляется окраска, свойственная свободному
индикатору.
12.
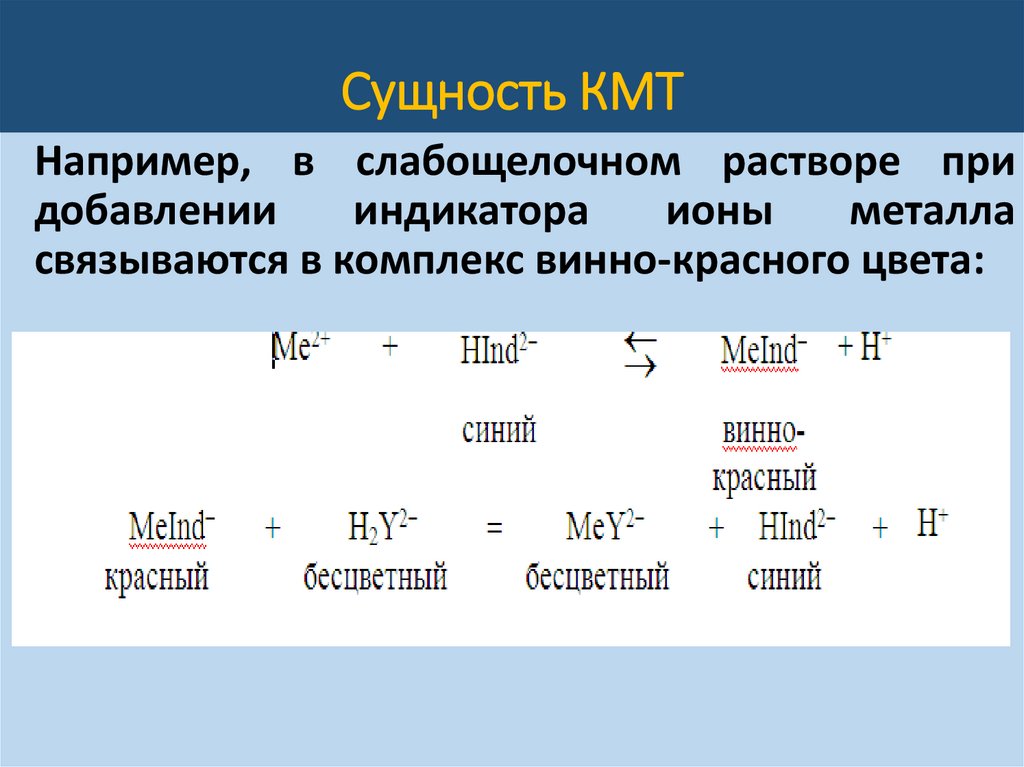
Сущность КМТНапример, в слабощелочном растворе при
добавлении
индикатора
ионы
металла
связываются в комплекс винно-красного цвета:
13.
Сущность КМТВ точке эквивалентности комплекс металла с
индикатором разрушается, так как образуется
более прочный комплекс иона металла с ЭДТА,
анионы индикатора освобождаются и переходят
в раствор, сообщая ему синюю окраску.
При
обратном
методе
титрования
к
анализируемому
раствору
прибавляют
отмеренный объем стандартного раствора ЭДТА,
избыток которого оттитровывают стандартным
раствором соли цинка в присутствии Ме-Ind,
реагирующего на ионы цинка или др.Ме.
14.
Условия проведения КМТ• 1) реакция образования ВКС должна протекать таким
образом, чтобы в Т.Э. определяемые катионы были
практически полностью связаны в комплекс. При этом
они должны образовывать с Ме-Ind комплексы,
отличающиеся меньшей прочностью, чем их
комплексы с ЭДТА.
• 2) КМТ должно проводиться при строго определенном
значении
рН
титруемого
раствора.
Комплексообразованию ВКС способствует повышение
значения рН титруемого раствора, однако, при рН > 10
наблюдается
образование
комплексных
оксосоединений
или
осадков
гидроксидов
определяемых катионов.
15.
Условия проведения КМТТакже следует иметь ввиду, что при образовании ВКС
освобождаются ионы Н+ и рН раствора понижается,
поэтому, если титруемые растворы не защищены
действием буферной смеси, то рН раствора снизится на
несколько единиц и ВКС не образуется. Для этого в
раствор добавляется буфер с определенным
значением рН и проводят титрование. Н-р,
для
титрования катионов, образующих малоустойчивые
комплексы (Са, Mg), требуется щелочная среда.
Титрование катионов, образующих более устойчивые
комплексы (Zn, Ni), требуется умеренно кислая среда.
Титрование Fe, Zr, Th, образующих очень прочные
комплексы, проводится в кислой среде.
16.
Условия проведения КМТТаким образом, чем меньше Кн образующего КС,
тем меньшее значение рН требуется для
титруемого раствора.
Для титрования применяют различные Сэ рабочего
раствора ЭДТА: 0,1; 0,05; 0,01 моль/л. При этом
Мэ(ЭДТА) = 372/2 = 186 г/моль. Точную Сэ и Т
раствора ЭДТА устанавливают с помощью
стандартного раствора соли цинка или магния,
обычно
используют
фиксанал
для
его
приготовления (или по точной навеске).
17.
Индикаторы в КМТ18.
Индикаторы в КМТ19.
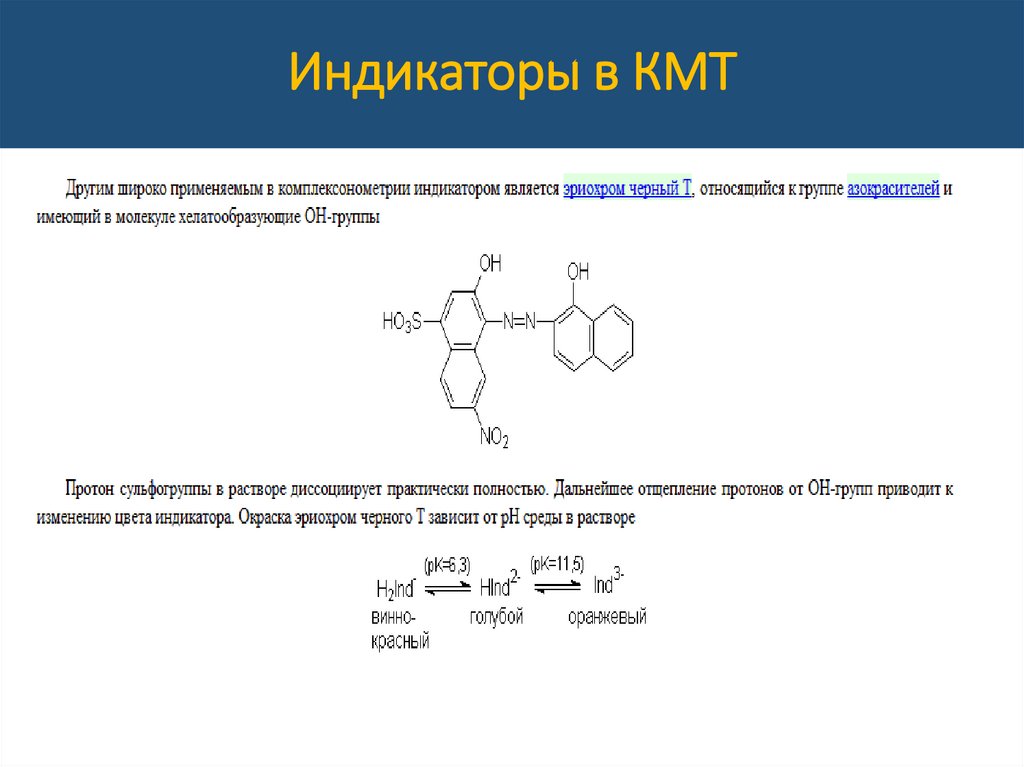
Индикаторы в КМТВ его молекулу входят фенольные группы и
хромофорная
азогруппа,
поэтому
ЭХЧ-Т
способен реагировать с ионами Ме-КО с
образованием ВКС.
• При рН 7 – 11, когда он имеет синий цвет, то образует с
ионами Ме (Mg, Ca, Zn, Cd, Al, Co, Ni) соединения винокрасного цвета, который при титровании ЭДТА в Т.Э.
изменится на синий.
• ЭХЧ-Т применяют в растворе, либо (за счет его
нестойкости) в твердом виде. Для этого его смешивают
в отношении 1:200 с каким-либо индифферентным
наполнителем, н-р, NaCl или KCl. Смесь тщательно
растирают в ступке и перед титрованием вносят в
раствор около 20-30 мг этой смеси.
20.
Индикаторы в КМТКсиленоловый оранжевый является органическим
красителем трифенилметанового ряда. Сам индикатор
окрашен в желтый цвет. В кислой среде при рН даже
значительно < 7 он дает с ионами Ме (Zn, Th, Zr) КС
красного цвета, переход окраски очень резкий. При
помощи этого индикатора определяют: Fe (pH = 1,5), Zr
(pH = 1-2), Bi ( pH = 2-3,5), Al (pH = 2-4), In (pH = 3-4,5), Tl
(pH = 4-5), Zn, Cd, Cu (pH = 5-6).
Кислотный хром темно-синий является органическим
азокрасителем, который окрашен в синий цвет. С Ме в
щелочной среде он образует КС вишнево-красного
цвета. Его применяют при титровании растворами
комплексонов катионов Zn, Cd, (pH = 9-10), Mn (pH =
10), Mg (pH = 10-11), Ca (pH > 12).
















 Химия
Химия








