Похожие презентации:
Методы окислительно-восстановительного и комплексонометри-ческого титрования
1. ЛЕКЦИЯ 8 Методы окислительно-восстановительного и комплексонометри-ческого титрования
ЛЕКЦИЯ 8Методы окислительновосстановительного
и комплексонометрического титрования
2. План
8.1 Методы оксидиметриии их классификация
8.1.1 Теоретические
основы
перманганатометрии
8.1.2 Метод иодометрии
3.
8.2 Комплексонометрическоетитрование, его виды
8.2.1 Комплексоны и их
особенности
8.2.2 Индикаторы
комплексонометрии
8.3 Применение методов
оксидиметрии и
комплексонометрии в
медицине
4. 8.1
Окислительновосстановительное титрованиеосновано на использовании
окислительновосстановительных реакций:
Ох1 + Rеd2 ↔ Rеd1 + Ох2
При его проведении титруемое
вещество вступает в ОВР с
титрантом.
5.
Например, в кислой среде‾
MnO4 присоединяет 5 ē и
восстанавливается до Mn2+;
в щелочной среде – 1 ē и
восстанавливается до
2‾
MnO4 ;
в нейтральной – 3 ē и
восстанавливается до MnO2
6.
Поэтому, в кислой средеМэкв(KMnO4) = 158 / 5 =
31,6 г/моль;
в щелочной Мэкв(KMnO4) =
158 г/моль;
в нейтральной –
Мэкв(KMnO4) = 158 / 3 =
52,67 г/моль.
7.
Используетсянесколько видов ОВ
титрования:
прямое,
обратное,
заместительное.
8. Прямое титрование проводят при ЭДС ≥ 0,4 В, что обеспечивает необходимую полноту и скорость протекания реакции. Прямым
титрованием определяютйод, Fe(II).
9.
Обратное титрованиеиспользуется при медленно
протекающих ОВ реакциях. При
этом к титруемой смеси
добавляют избыток титранта I
и выдерживают определенное
время. Затем избыток титранта
I оттитровывают другим
титрантом II.
10.
Na2S + I2 + 2 HClI2 + Na2S2O3
S + 2 NaCl + 2 HI
2 NaI + Na2S4O6
11.
Заместительное титрованиепроводят, определяя
заместитель – выделяющийся
в эквивалентном количестве
продукт реакции
определяемого вещества с
реагентом. Так анализируются
вещества, не вступающие в
ОВР.
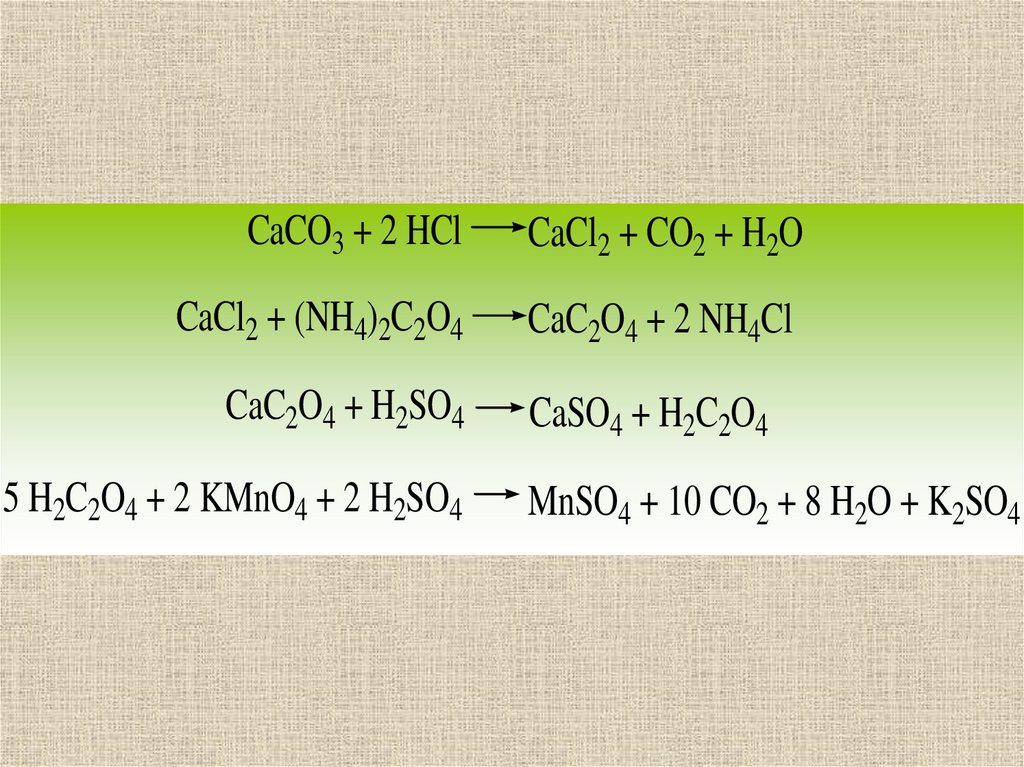
12.
CaCO3 + 2 HClCaCl2 + CO2 + H2O
CaCl2 + (NH4)2C2O4
CaC2O4 + 2 NH4Cl
CaC2O4 + H2SO4
5 H2C2O4 + 2 KMnO4 + 2 H2SO4
CaSO4 + H2C2O4
MnSO4 + 10 CO2 + 8 H2O + K2SO4
13. 8.1.1
Метод перманганатометрииоснован на реакциях
окисления различных веществ
калия перманганатом. Процесс
осуществляют в сильно
‾
кислой среде, т.к. MnO4
проявляет в этом случае
наиболее сильные
окислительные свойства.
14.
02
MnO4 / Mn
+
MnO4 + 8 H
1,51B
2+
Mn + 4 H2O
15.
-4 MnO4 + 2 Н2О
4 MnO2 + 3 O2 + 4 OH
-
16.
2 KMnO4 + 5 Н2С2O4 + 3 H2SO4 2 MnSO4 + 10 CO2 + 8 H2O + K2SO4-
+
-
H2C2O4 - 2 e
-
MnO4 + 8 H + 5 e
2+
Mn + 4 H2O
+
2 CO2 + 2 H
2
5
17.
Реакция KMnO4 с Н2С2O4 –автокаталитическая, т.е.
вначале протекает
медленно, поэтому раствор
Н2С2O4 нагревают до 70о
80 С, а после появления в
смеси катализатора Mn2+
реакция ускоряется.
18.
Для определениявосстановителей
используют прямое
титрование:
2 KMnO4 + 10 FeSO4 + 8 H2SO4 2 MnSO4 + 5 Fe2(SO4)3 + 8 H2O + K2SO4
+ MnO4 + 8 H + 5 e
2+ -
2+
Mn + 4 H2O
3+
2 Fe - 2 e 2 Fe
2
5
19.
2KMnO4 + 5H2O2 + 3H2SO4 2MnSO4 + 5O2 + 8H2O + K2SO4+
MnO4 + 8 H + 5 e
H2O2 - 2 e
+
Mn2 + 4 H2O
+
O2 + 2 H
2
5
20.
Для определения окислителейиспользуют обратное титрование
K2Cr2O7 + 6 FeSO4 + 7 H2SO4 Cr2(SO4)2 + 3 Fe2(SO4)3 + 7 H2O + K2SO4
2+
Cr2O7 + 14 H + 6e
2+
-
2 Fe - 2 e
3+
2 Cr + 7 H2O
3+
2 Fe
1
3
10 FeSO4 + 2 KMnO4 + 8 H2SO4 5 Fe2(SO4)3 + 2 MnSO4 + K2SO4 + 8 H2O
21.
При использовании косвенноготитрования анализируемый
раствор, содержащий Са2+,
обрабатывают растворимым
оксалатом, чтобы полностью
осадить Са2+ в виде твердого
CaC2O4. Осадок
отфильтровывают и
растворяют в серной кислоте
22.
CaC2O4 + H2SO4Н2С2O4 + CaSO4
2 KMnO4 + 5 Н2С2O4 + 3 H2SO4 2 MnSO4 + 10 CO2 + 8 H2O + K2SO4
23. 8.1.2 Метод иодометрии основан на ОВ реакциях, связанных с превращением I2 в I‾ и обратно: I2 + 2ē ↔ 2 I‾ Ох Red
24.
0I2 / 2 I
I2 + 2 Na2S2O3
I2 + 2 e
-
22 S2O3 - 2 e
0,54 B
2 NaI + Na2S4O6 (натрия тетратионат)
2I
-
22 S4O6
1
1
25.
Йодометрию необходимопроводить:
1) на холоде (т.к. I2 – летучее
соединение, и при нагревании
чувствительность крахмала к
йоду уменьшается);
2) рН не должен превышать 9, т.к.
в щелочной среде возможна
реакция:
I2 + 2ОН
-
-
-
I + IO + H2O
26. Прямое титрование рабочим раствором I2 – определение соединений As(III), Sb(III), Sn(II), сульфидов, сульфитов, аскорбиновой
кислоты:2SO3 + I2 + H2O
2SO4 + 2 I + 2Н +
27. Например,
H2S + I2I2 + 2 Na2S2O3
остаток
-
+
2I +S +2H
2 NaI + Na2S4O6
28. Этим методом определяют Cl2, Br2, KMnO4, KClO3, CaOCl2, нитриты, Н2О2, Fe(III), Cu(II), As(V).
K2Cr2O7 + 6 KI изб. + 7 H2SO42+
Cr2O7 + 14 H + 6 e
-
-
2I -2e
Cr2(SO4)3 + 3 I2 + 7 H2O + 4 K2SO4
3+
2 Cr + 7 H2O
1
I2
3
29.
I2 + 2 Na2S2O32 NaI + Na2S4O6
22 экв(Cr2O7 ) = экв(I2) = экв(S2O3 )
30. 8.2.1
Широкое применение получилианалитические органические
реагенты, предложенные в 1944 г.
Г. Шварценбахом. Он отнес к ним
группу аминополиуксусных
кислот, содержащих
иминодиацетатные фрагменты –
N(CH2COOH)2, связанные с
определенными алифатическими
и ароматическими радикалами.
31.
1) комплексон I –нитрилотриуксусная кислота
CH2COOH
N CH2COOH
CH2COOH
(H3Y)
32.
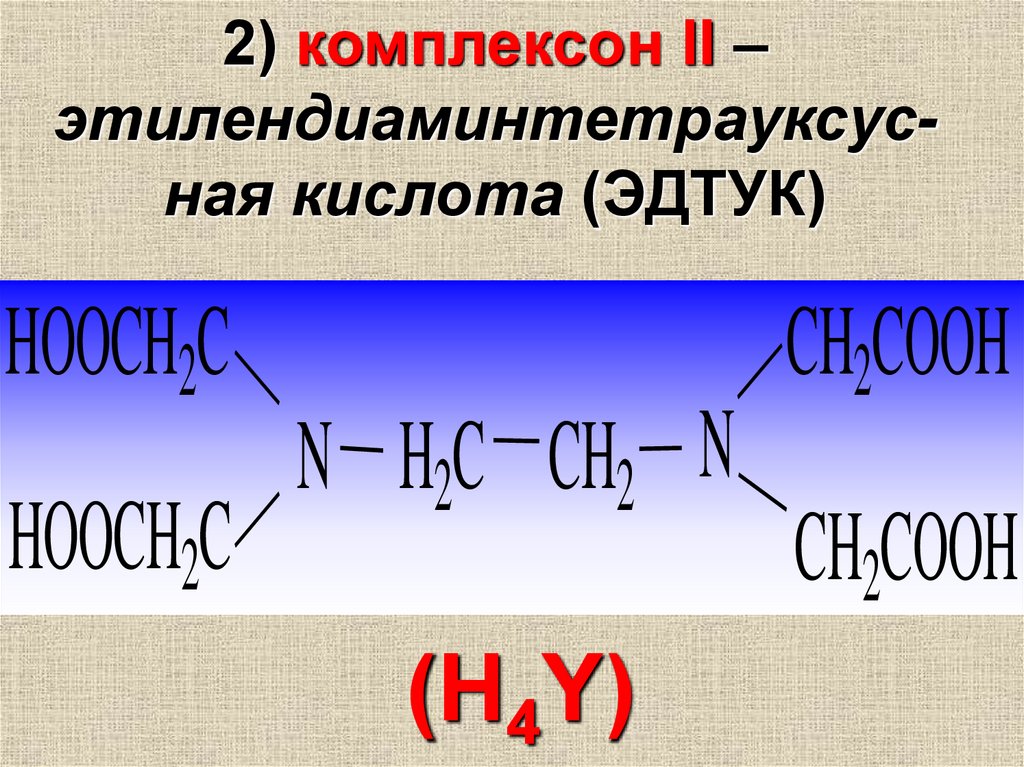
2) комплексон II –этилендиаминтетрауксусная кислота (ЭДТУК)
HOOCH2C
HOOCH2C
N H2C CH2 N
(H4Y)
CH2COOH
CH2COOH
33.
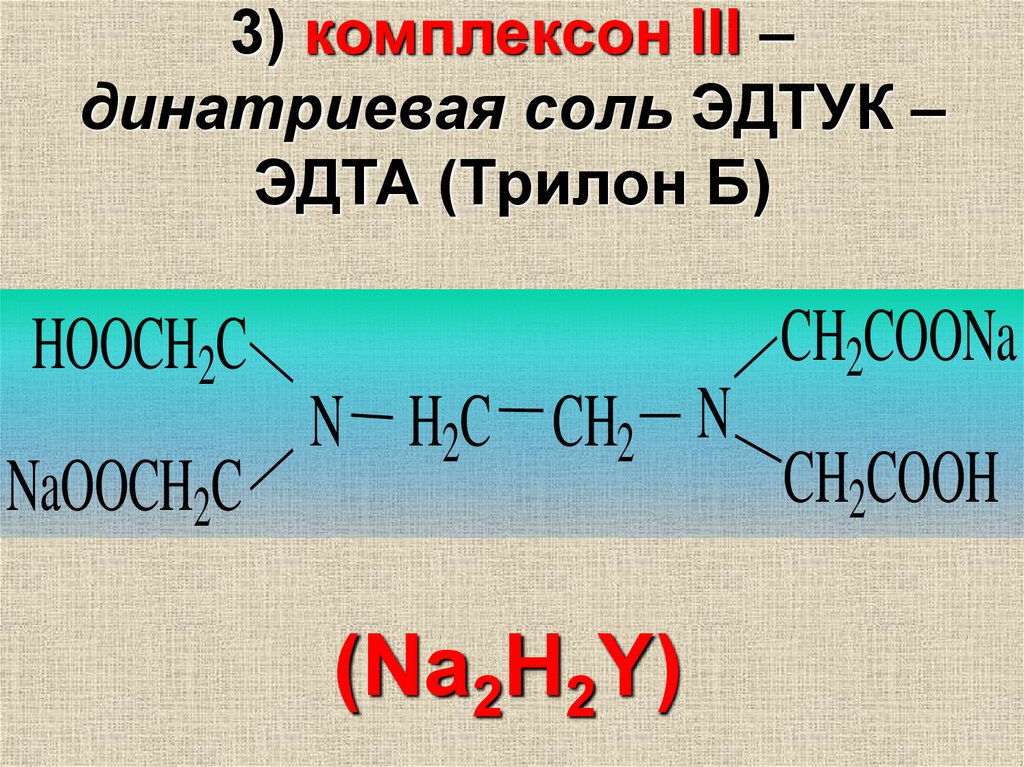
3) комплексон III –динатриевая соль ЭДТУК –
ЭДТА (Трилон Б)
HOOCH2C
NaOOCH2C
N H2C CH2 N
(Na2H2Y)
CH2COONa
CH2COOH
34.
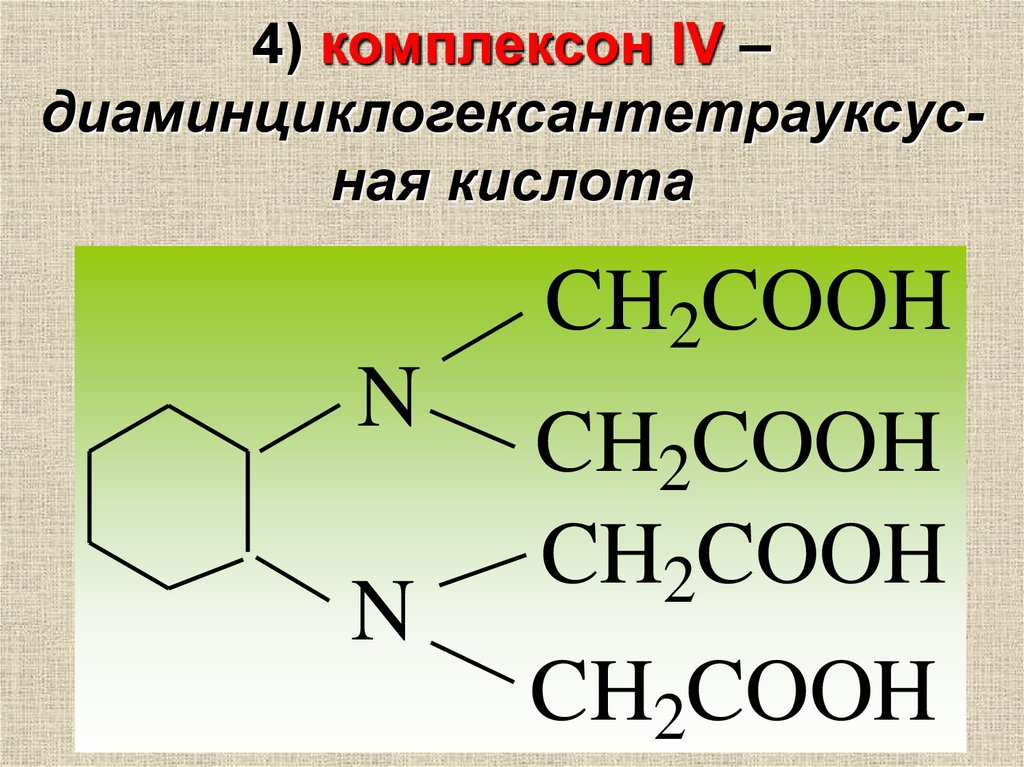
4) комплексон IV –диаминциклогексантетрауксусная кислота
CH2COOH
N
N
CH2COOH
CH2COOH
CH2COOH
35. Ме2+ + [Y]4‾ ↔ [MeY]2‾
С катионами Ме ЭДТАобразует комплексные
соединения в
соотношении 1:1
2+
Ме
+
4
[Y] ‾
↔
2
[MeY] ‾
36.
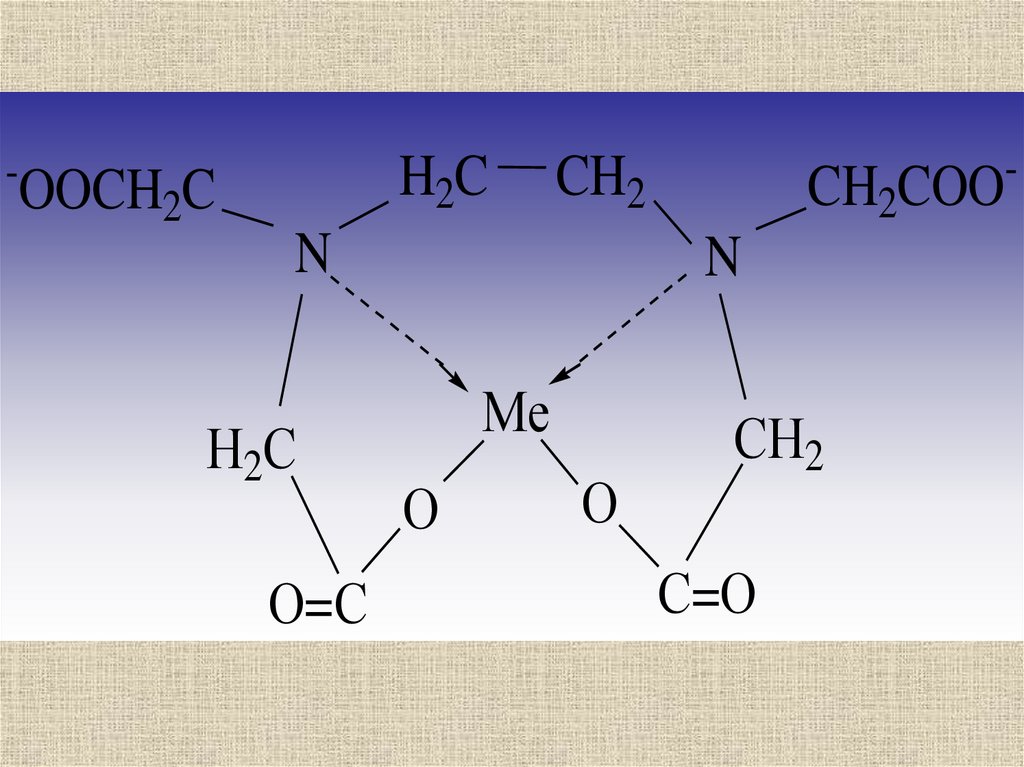
H2C-
OOCH2C
CH2
N
Н2С
О=С
CH2COO
N
Ме
О
О
СН2
С=О
-
37.
ЭДТУК (H4Y) – белоекристаллическое вещество
мало растворимое в воде.
Растворимость H4Y
минимальна при рН 1,6-1,8.
При повышении и
понижении концентрации
ионов водорода
растворимость растет.
38. Высокая растворимость в минеральных кислотах объясняется образованием протонированных форм H5Y+ и H6Y2+
Высокаярастворимость в
минеральных кислотах
объясняется
образованием
протонированных
+
2+
форм H5Y и H6Y
39.
ЭДТУК – четырехпротоннаякислота, которая ионизирует
по 4-м ступеням, причем по
первым двум в
значительной степени (рК1=
=2,07; рК2= 2,75), по третьей
и четвертой – гораздо
меньше (рК3=6,24; рК4=10,34)
40. Поэтому ЭДТА в кислой среде (рН = 4,5) частично протонируется и находится в виде [H2Y]2‾, в слабо щелочной (рН = 8-9) под
действием ОН‾частично депротонируется и
переходит в [HY]3‾, в сильно
щелочной (рН > 12) полностью
депротонируется и находится в
4
виде Y ‾
41. Реакция комплексообразования проходит между полностью ионизированной формой Y4‾ и ионами Ме и характеризуется общей константой
Реакциякомплексообразования
проходит между полностью
4
ионизированной формой Y ‾
и ионами Ме и
характеризуется общей
константой образования
(или устойчивости):
42.
2+Ме
+
4‾
Y
↔
2‾
[MeY]
2
[[ MeY ] ]
4
2
[Y ][ Me ]
43.
Устойчивость комплексов Мес ЭДТА зависит от заряда иона
Ме, электронной конфигурации, и
меняется в зависимости от рН
среды. Наиболее устойчивые
комплексы ЭДТА с
многозарядными ионами р- и dэлементов могут образовываться
в кислой среде.
44.
К ним относятся комплексы3+
3+
3+
с Bi , Fe ,Cr . Менее
устойчивые комплексы с
ЭДТА образуют ионы s2+
2+
2+
элементов: Ba , Mg , Ca .
Их определение
комплексонометрическим
титрованием проводят в
щелочной среде.
45.
8.2.2При визуальном способе
установлении конечной точки
применяют металлоиндикаторы,
изменяющие окраску в
зависимости от концентрации
иона металла. Обычно это
органические соединения,
которые с ионами титруемого
металла образуют окрашенные
комплексы.
46.
1) индикаторы, которые сами неимеют окраски, но образуют с
ионами Ме окрашенные
комплексы
Комплексы Fe(III) с салициловой
кислотой (с молярным
соотношением 1:1) окрашены в
красный цвет, с тайроном – в
зеленый. Тиомочевинные
комплексы с Bi (III) окрашены в
желтый цвет.
47.
2) органические соединения,содержащие в своих молекулах
хромофорные группы и
образующие с ионами Ме
внутрикомплексные
соединения, по цвету
отличающиеся от самих
индикаторов.
Эти индикаторы называются
металлохромные.
48.
Рингбом предложил делитьиндикаторы на 3 группы:
а) индикаторы, содержащие азогруппу
–N=N–
Hапример, эриохромовый черный Т
(при рН 9-10 используется для
определения Mg2+, Ba2+, Cd2+, Pb2+,
Zn2+, Mn2+, Sr2+) и кислотный
хромовый темно-синий (Mn2+, Mg2+,
Zn2+, Pb2+, Ca2+)
49. б) индикаторы, относящиеся к классу трифенилметановых красителей. Например, ксиленоловый оранжевый (при рН 1,5-3: Bi3+, Fe3+;
б) индикаторы, относящиеся кклассу трифенилметановых
красителей. Например,
ксиленоловый оранжевый
(при рН 1,5-3:
при рН
5-7: Cd2+, Co2+, Cu2+, Hg2+, Zn2+);
пирокатехиновый фиолетовый
( при рН 2-4: Bi3+, Ti4+;
2+
3+
2+
рН 5-6: Cu , Fe , Pb )
3+
Bi ,
3+
Fe ;
50.
в) прочие индикаторы– мурексид
2+
2+
(при рН 8-9: Co , Ca ,
2+
2+
Zn , Ni ), дитизон,
ализарин
51. К металлоиндикаторам предъявляется ряд требований: 1) должны в выбранной области рН образовывать с ионами Ме достаточно
устойчивые комплексы ссоотношением Ме:Ind = 1:1
52.
Условные константыустойчивости комплексов
MeInd должны быть меньше
условных констант
устойчивости комплексов
Ме с ЭДТА, т.е.
10
'
MeY
/
'
MeInd
10
4
53.
Достаточно большие значенияконстант устойчивости
комплексов MeInd позволяют
использовать небольшие
соотношения концентраций
индикатора и Ме
сInd / cMe 0,01
54. 2) комплекс иона Ме с Ind должен быть кинетически лабильным и быстро разрушаться при добавлении ЭДТА. Считается, что в
комплексонометрии можноприменять металлоиндикаторы,
для которых период полуобмена
лигандами в комплексе MeInd
1/ 2 10с
55. 3) изменение окраски раствора в конечной точке титровании должно быть контрастным Согласно учению о цвете, предельные цвета,
т.е.исходные (окраска чистого
МеInd) и конечные (окраска
чистого Ind) должны быть по
возможности
дополнительными
56.
Чтобы достичь максимальногоцветового эффекта, используют
смешанные индикаторы, т.е. к
металлоиндикатору добавляют
индифферентный краситель,
создающий цветовой фон,
вследствие чего предельные
окраски до и после конечной точки
титрования становятся
дополнительными.
57.
Для титрования ионов2+
Ca предложена смесь
мурексида и нафтолового
зеленого В: переход
окраски от оливковозеленой через
красновато-серую к чисто
синей.
58.
Молярную долю любой формыиндикатора вычисляют по
уравнению:
4
aY 4
[Y ]
c 'Y
59.
где С'Y – общаяконцентрация
незакомплексованной ЭДТА,
которая равна сумме
равновесных концентраций
всех форм ЭДТА
4
3
2
c'Y [Y ] [ HY ] [ H 2Y ]
2
[ H 3Y ] [ H 4Y ] [ H 5Y ] [ H 6Y ]
60. В большинстве случаев ионы металла и индикатора образуют лишь один комплекс в соотношении 1:1, тогда
[ MеInd ]'MеInd
[ Mе]cInd
61.
[ MеInd ][ Mе]
'MеInd cInd
62. Считают, что человеческий глаз ощущает переходный цвет в следующем интервале отношений концентраций:
cInd1
10
10 [ MеInd ] 1
63.
8.3В фармации
комплексонометрическое
титрование используют для
определения препаратов Са:
хлорида, глюконата, лактата;
препаратов Zn: оксида и
сульфата;
сульфата магния, основного
нитрата висмута и др.
64.
Применяют комплексонометрию прианализе воды для определения
жесткости, а также при анализе
различных сплавов и минералов.
Методами окислительновосстановительного титрования в
клинических и биохимических
исследованиях определяют
содержание ферментов каталазы,
пероксидазы, аскорбиновой кислоты,
сахара в крови, мочевой кислоты в
моче, ионов Са2+ в сыворотке крови.
65.
Перманганатометрию ииодометрию используют для
анализа ряда химических и
лекарственных препаратов.
Перманганатометрия – один из
лучших способов определения
железа в различных объектах.
Этим методом пользуются для
определения общей окисляемости
воды или почвы.
66.
Благодарим завнимание!









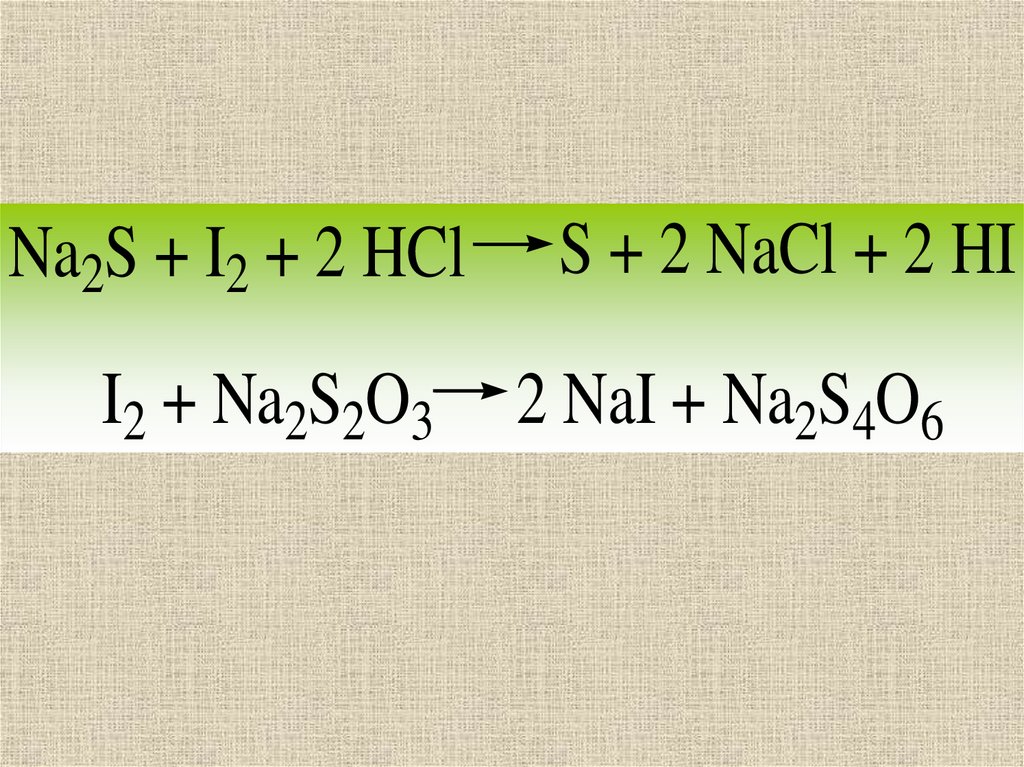


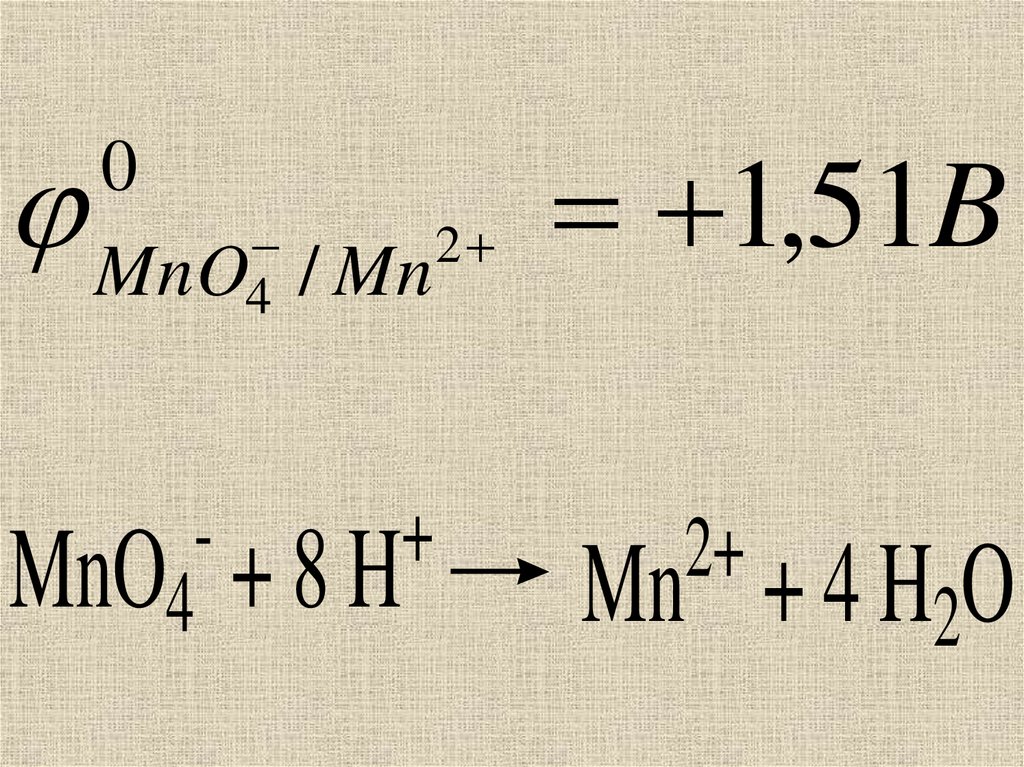
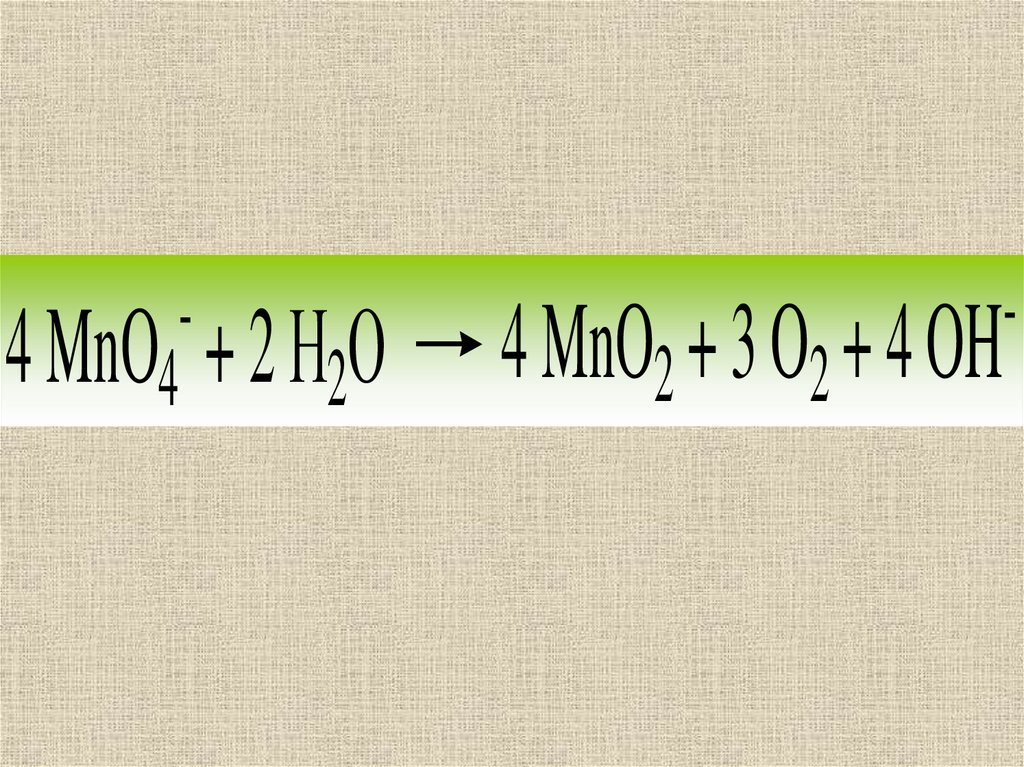
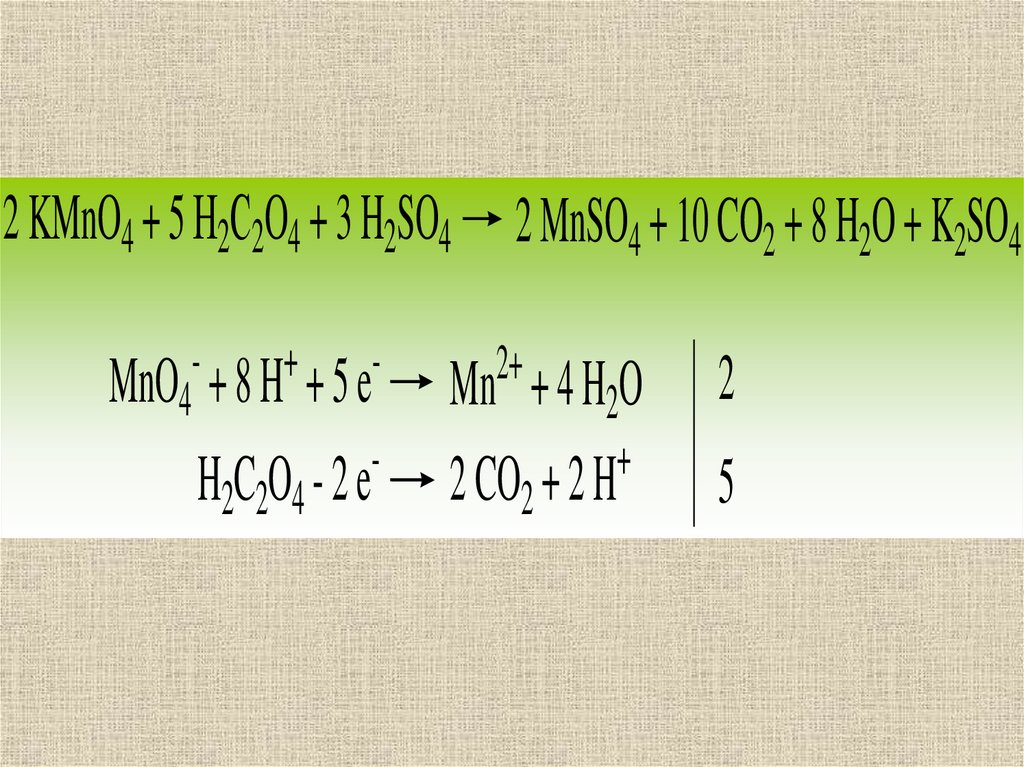


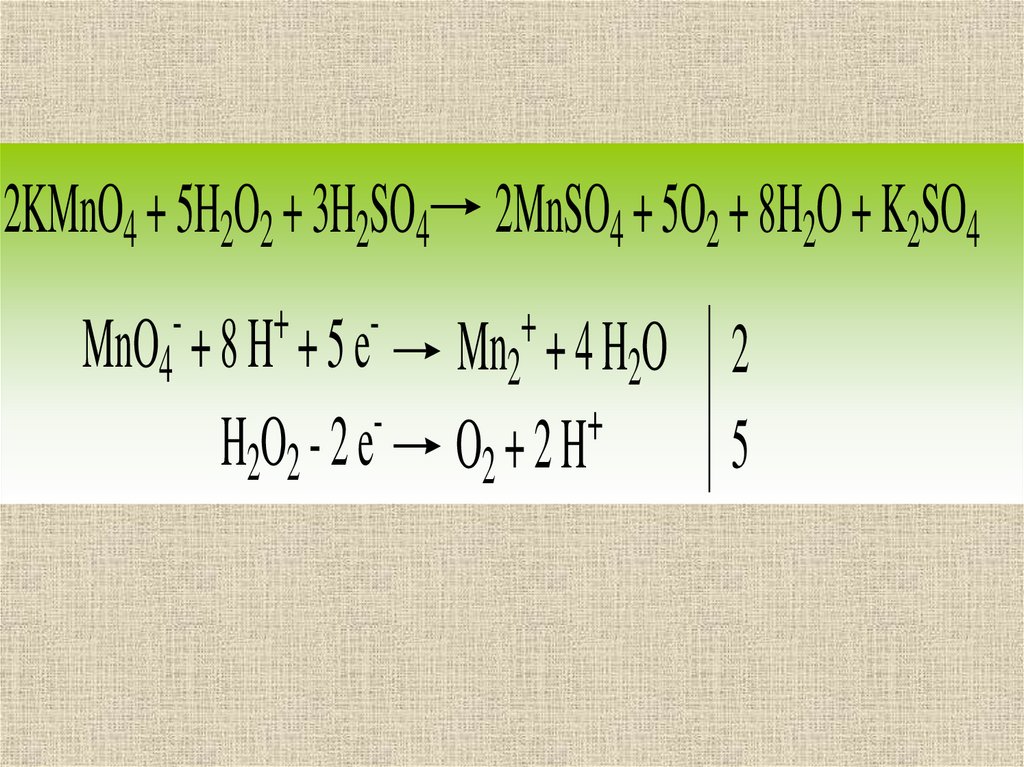


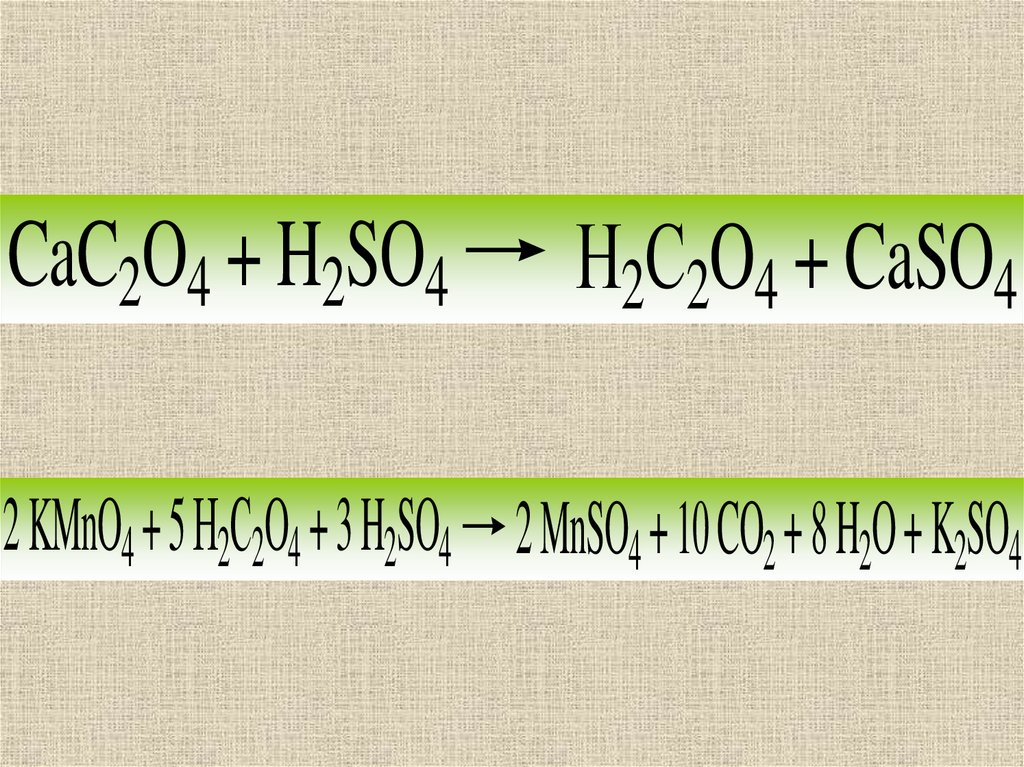

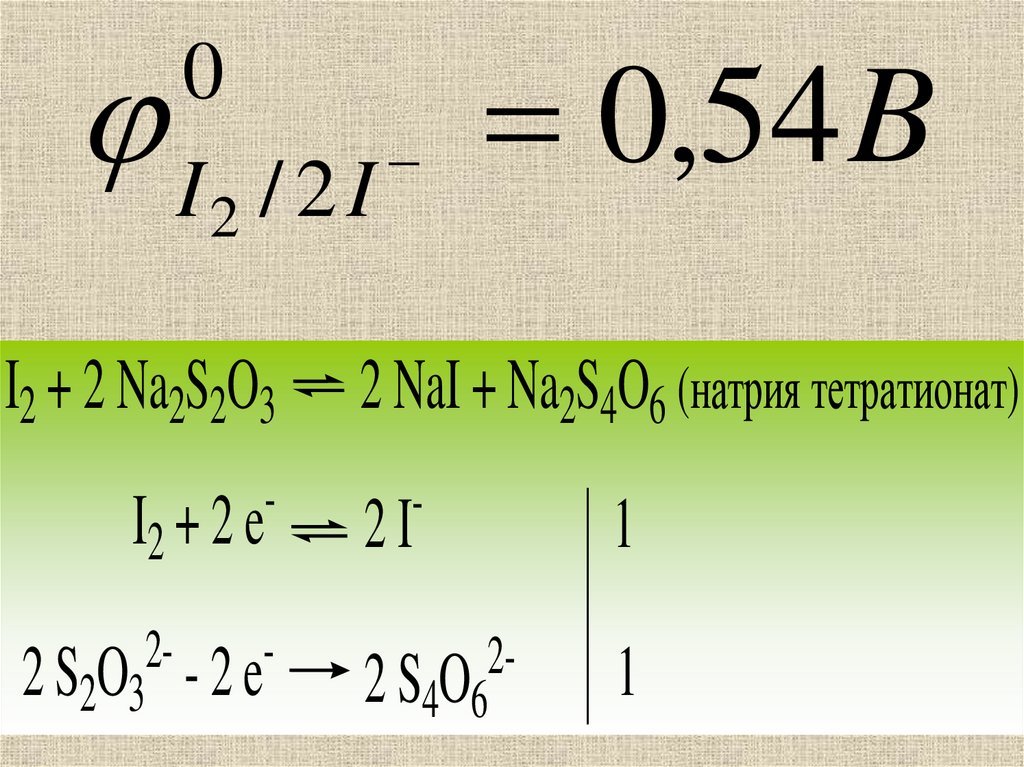




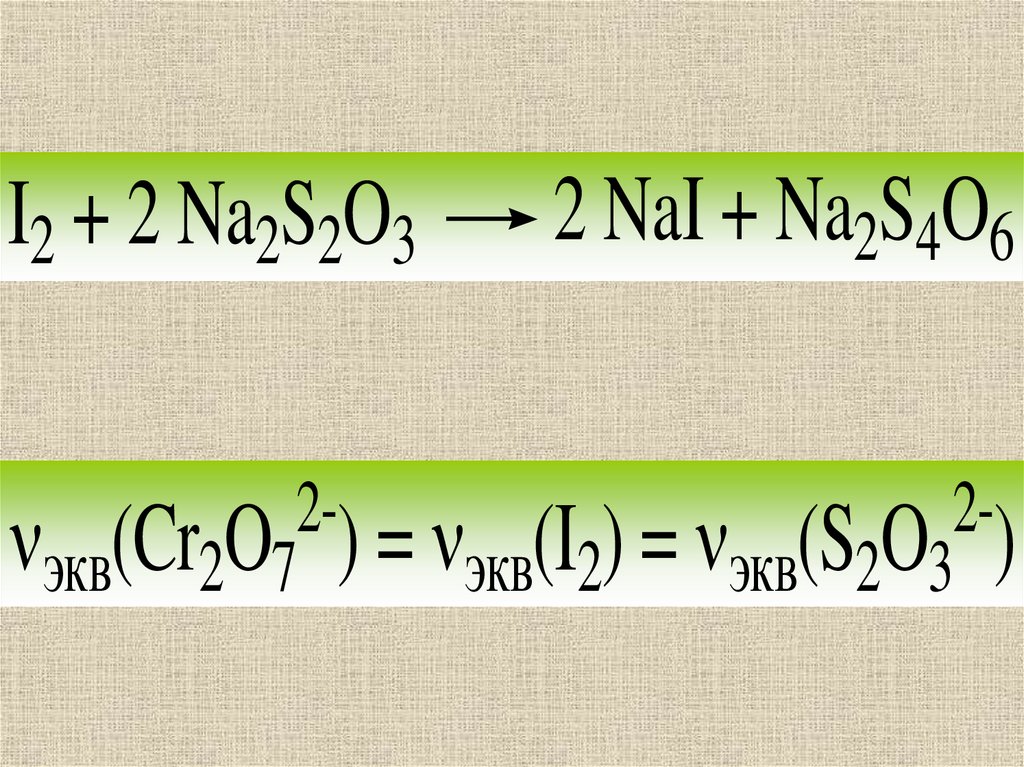


![Ме2+ + [Y]4‾ ↔ [MeY]2‾ Ме2+ + [Y]4‾ ↔ [MeY]2‾](https://cf3.ppt-online.org/files3/slide/n/NDkao0hKspbX74euH3jVUmRGPiFWM6w8tO1yQB/slide-34.jpg)



![Поэтому ЭДТА в кислой среде (рН = 4,5) частично протонируется и находится в виде [H2Y]2‾, в слабо щелочной (рН = 8-9) под Поэтому ЭДТА в кислой среде (рН = 4,5) частично протонируется и находится в виде [H2Y]2‾, в слабо щелочной (рН = 8-9) под](https://cf3.ppt-online.org/files3/slide/n/NDkao0hKspbX74euH3jVUmRGPiFWM6w8tO1yQB/slide-39.jpg)

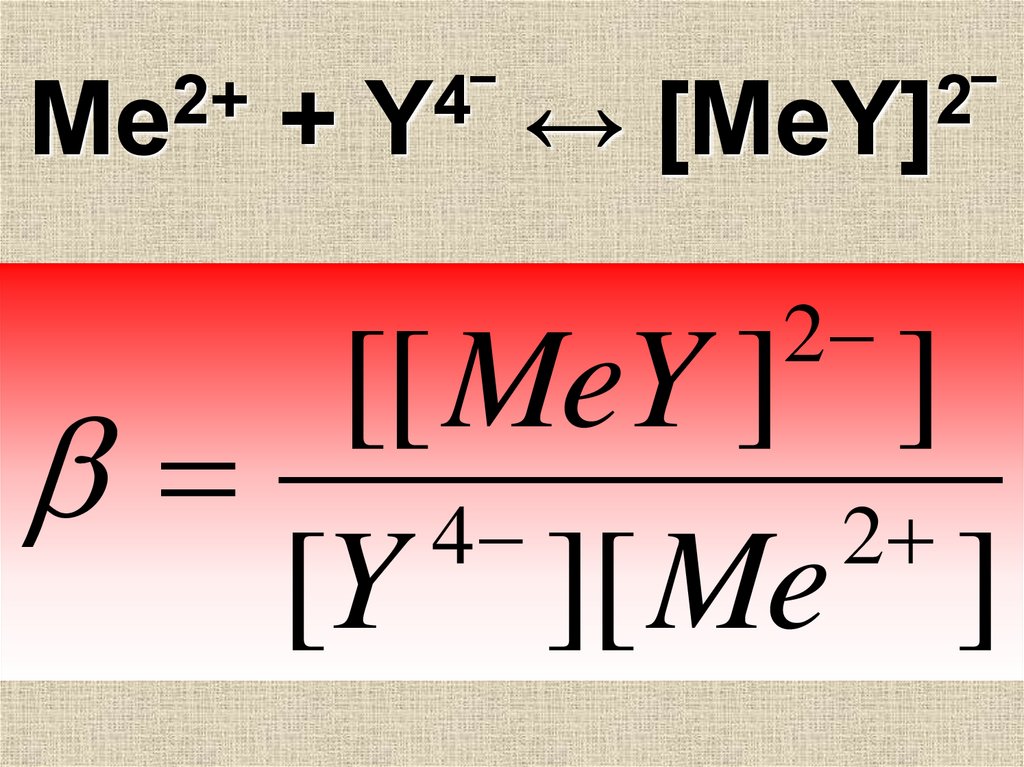


















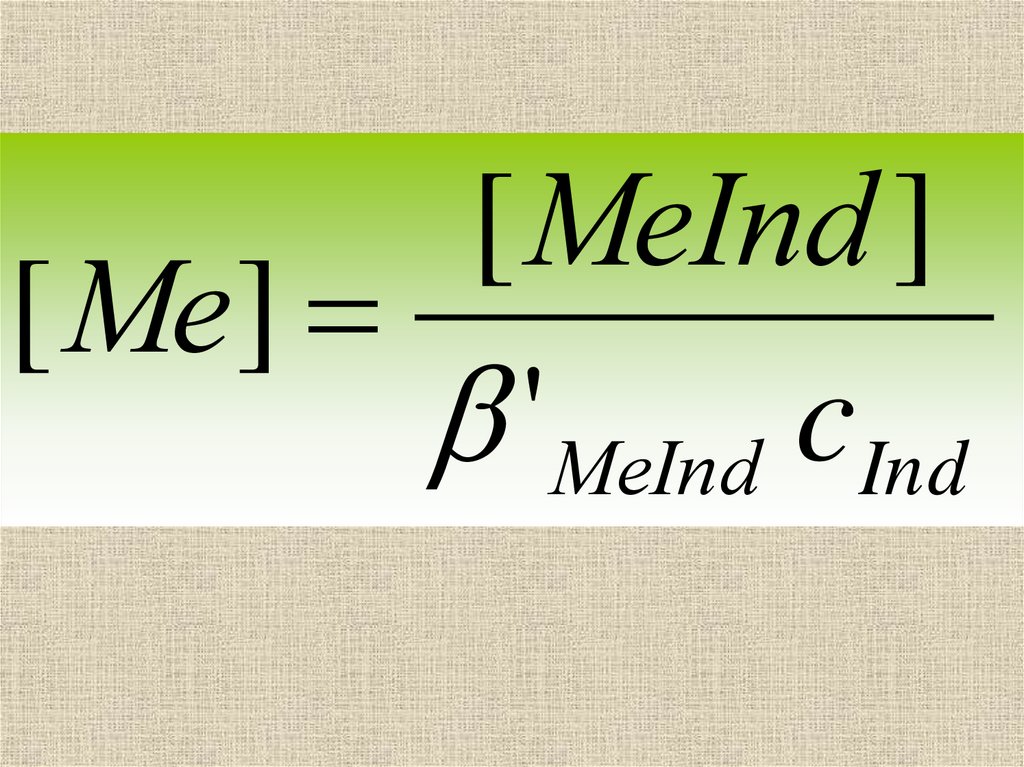





 Химия
Химия








