Похожие презентации:
Карбон
1.
КарбонВуглець
2.
Знаходження в природіС 0,14%
Карбонатні гірські породи (99%С)
Ст. ок. +4
СаСО3 – кальцит
у вигляді вапняку, мармуру, крейди
MgCO3 – магнезит
СаСО3·MgCO3 – доломіт
FeСО3·MgCO3, ZnCO3 – важкі шпати
Cu2CO3(OH)2 ((CuOH)2CO3) – малахіт
Na2CO3 – сода
3.
Нафта(СхНу), газ(СН4, С2Н6), вугілля, торф,сланці
в біосфері(0,01%) 200000 млрд. т.
в атмосфері(≈ 0,03% СО2) 2000 млрд. т.
у вільному стані зустрічається у вигляді графіта
та алмаза
Добування
СН4 + О2 → С + 2Н2О
СН4
С + 2Н2
t
сажа
4.
С 2s22p2С* 2s12p3
вал. = 2
вал. = 4
Ступінь окиснення
С
С
С
-4..........0...........+4
С
С
Утворює ланцюги, цикли
С
5.
Алотропні модифікації карбонуГрафіт має високу тепло- та
електропровідність (як метали)
ρ= 2,1÷ 2,3 г/см3
tпл.= 4492 оС(10 МПа)
tсубл.= 3800оС(за звичайного тиску)
6.
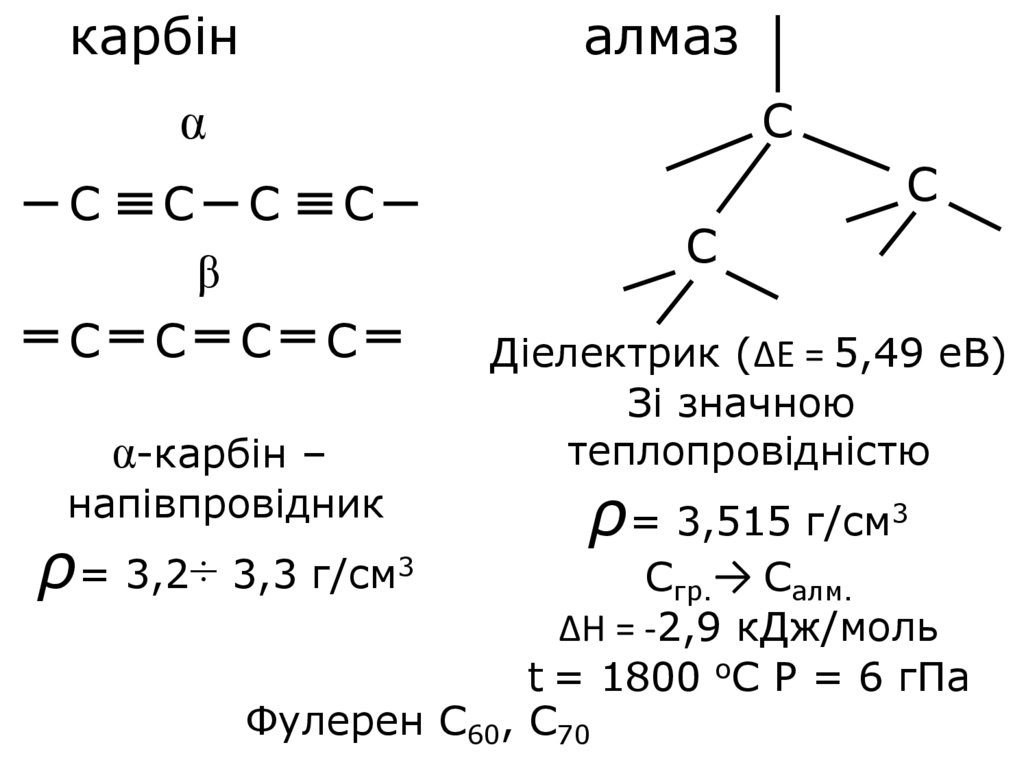
карбіналмаз
С
α
С
С
С
С
С
С
β
С
С
α-карбін –
напівпровідник
ρ= 3,2÷ 3,3 г/см3
С
С
Діелектрик (∆Е = 5,49 еВ)
Зі значною
теплопровідністю
ρ= 3,515 г/см3
Сгр.→ Салм.
∆Н = -2,9 кДж/моль
t = 1800 оС Р = 6 гПа
Фулерен С60, С70
7.
-4Al4C3,
CH4
0
+2
Алмаз,
карбін,
графіт,
фулерен
СО, НСОOH,
HCN
+4
СО2,
Н2СО3
карбонати,
СГ4 (Г–F, Cl,
Br, I),CS2
8.
C доволі інертний, тому що сполуки єполімерами і щоб розірвати зв’язки потрібні
значні затрати енергії
Ме + С → МеС карбіди
0
0
2Н2 + С →
+4
С + О2 → СО2
-4
СН4
C + 2S → СS2
2C + N2 → С2N2
диціан
С + 2F2 → СF4 (тільки з F2)
3С + 4НNO3(к.) →
3СО2 + 4NO + 2H2O
9.
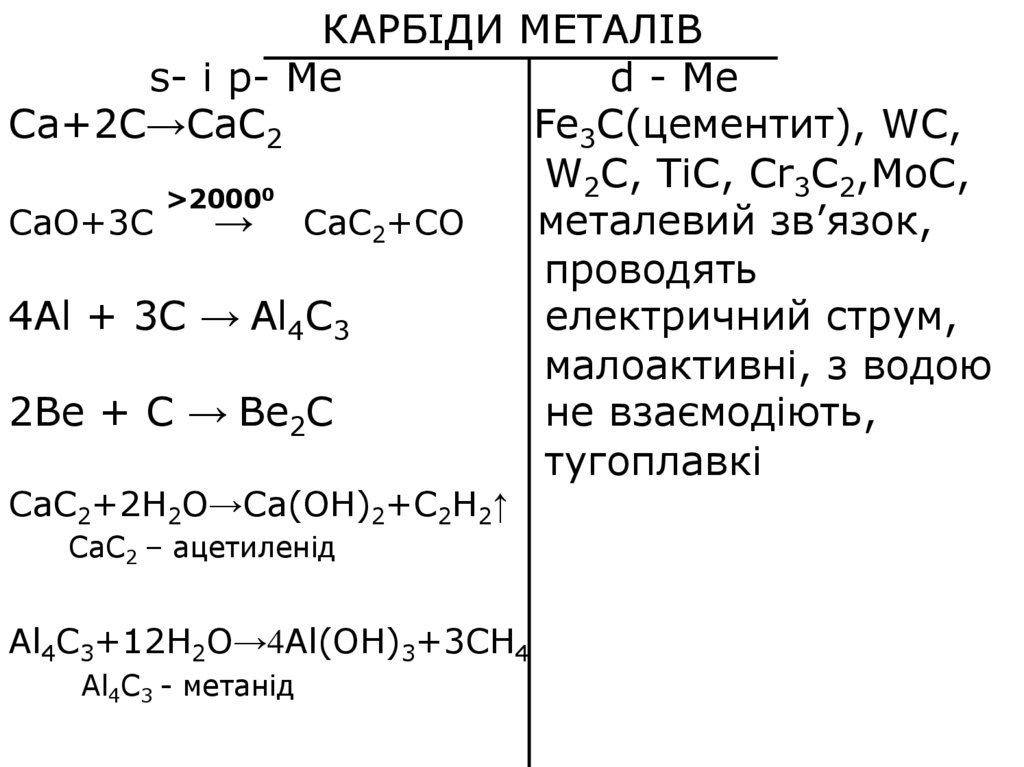
КАРБІДИ МЕТАЛІВs- i p- Ме
d - Me
Ca+2C→CaC2
Fe3C(цементит), WC,
W2C, TiC, Cr3C2,MoC,
>20000
CaO+3C
→ CaC2+CO
металевий зв’язок,
проводять
4Al + 3C → Al4C3
електричний струм,
малоактивні, з водою
2Be + C → Be2C
не взаємодіють,
тугоплавкі
CaC2+2H2O→Ca(OH)2+C2H2↑
CaC2 – ацетиленід
Al4C3+12H2O→4Al(OH)3+3CH4
Al4C3 - метанід
10.
ОксидиСО
С+CО2 →2СО
кокс
С + О2 → СО2
С + О2 → СО2
ΔН < 0
СО2 + С → 2СО
ΔН > 0
генераторний газ
↑ повітря
С + H2О → СО + H2
ΔН > 0
водяний газ
11.
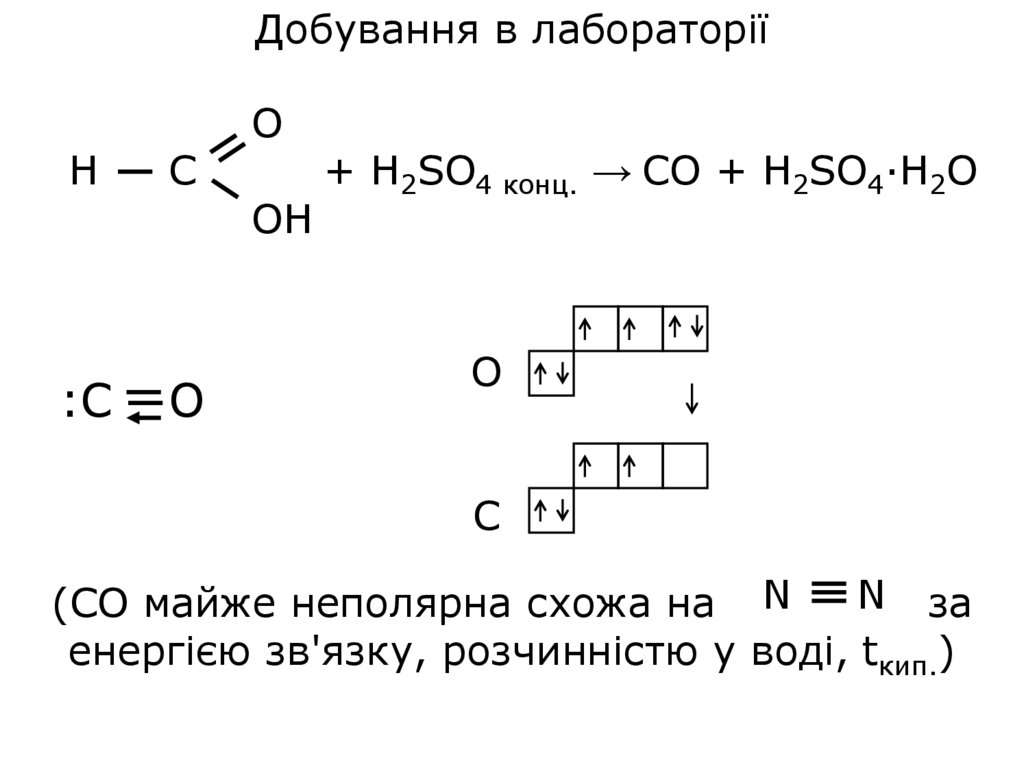
Добування в лабораторіїН
С
О
ОН
:С
О
+ H2SO4 конц. → CO + H2SO4·H2O
O
C
N за
(СО майже неполярна схожа на N
енергією зв'язку, розчинністю у воді, tкип.)
12.
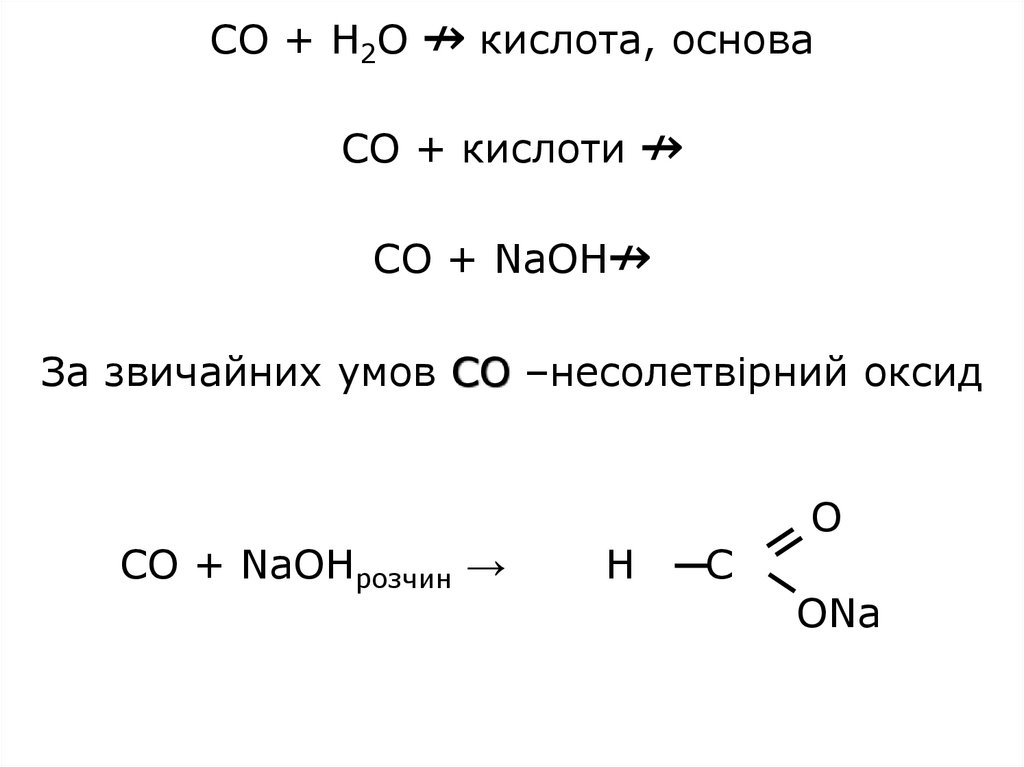
CO + H2O ↛ кислота, основаCO + кислоти ↛
CO + NaOH↛
За звичайних умов СО –несолетвірний оксид
CO + NaOHрозчин →
Н
С
О
ОNa
13.
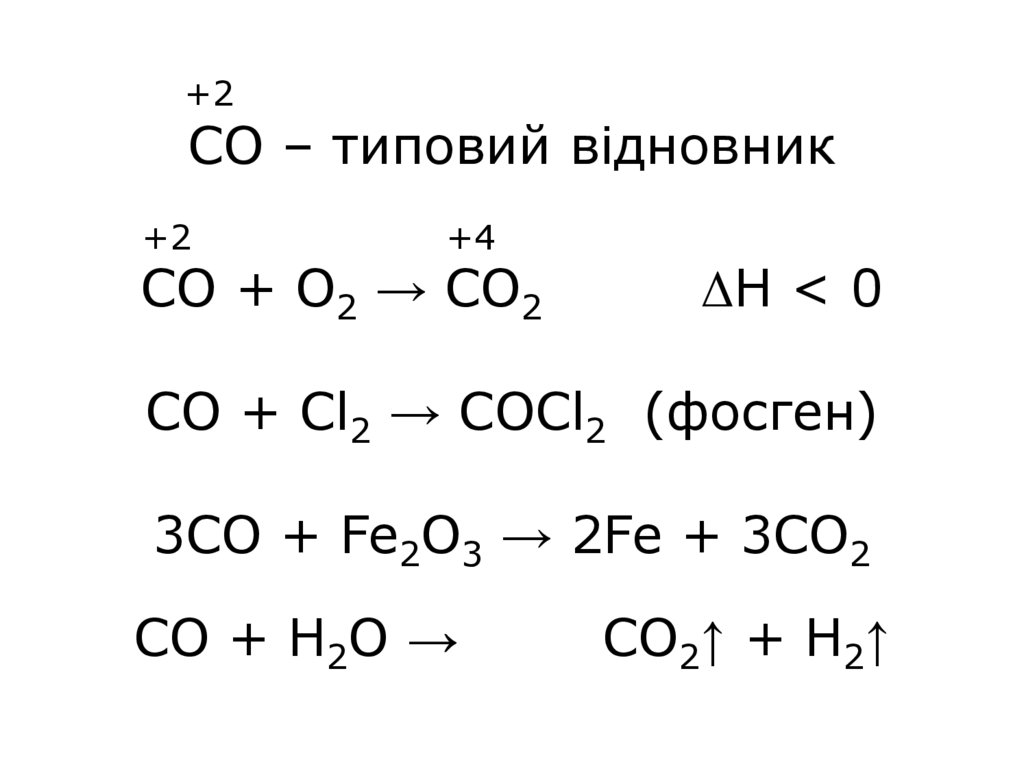
+2CO – типовий відновник
+2
+4
СО + О2 → СО2
ΔН < 0
СО + Сl2 → COCl2 (фосген)
3CO + Fe2O3 → 2Fe + 3CO2
CO + H2O →
CO2↑ + H2↑
14.
4CO +Ni ⇆ Ni(CO)4 карбоніл5CO + Fe
→
Fe(CO)5
СО – донор електронів
Розкладом карбонілів отримують метали
високої чистоти
CO + NH3 →
H2O + HCN
синільна(ціановоднева) кислота
15.
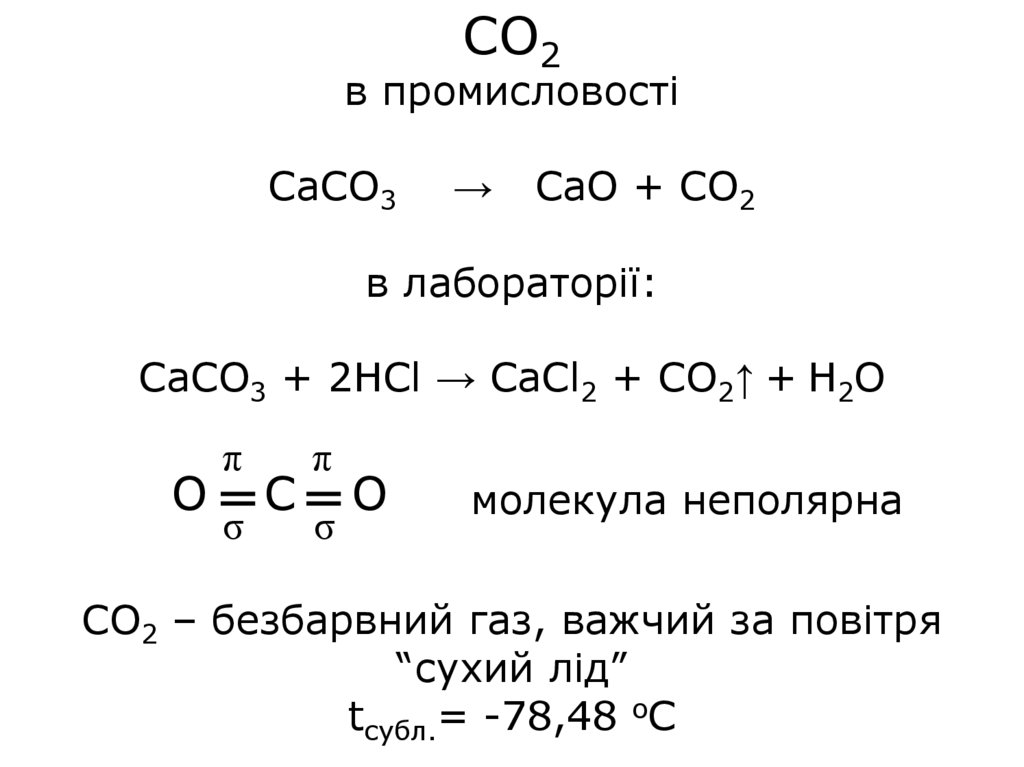
СО2в промисловості
CaCO3
→
CaO + CO2
в лабораторії:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
O
π
σ
C
π
σ
O
молекула неполярна
CO2 – безбарвний газ, важчий за повітря
“сухий лід”
tсубл.= -78,48 оС
16.
CO2 + H2O ⇆ H2CO3слабка кислота
К1 = 1,32·10-4
К2 = 4,68·10-11
О
О
2-
С
О
Середні солі: Na2CO3 кальцинована cода
Кислі солі : NaHCO3 питна сода
17.
Розчинними є лише карбонати лужнихметалів(крім Li2CO3) та амонію.
Розчинні солі у водних розчинах гідролізують
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
2+
2-
Ca + CO3 → CaCO3↓
2CuCl2 + 2Na2CO3 + Н2О → (CuОН)2CO3↓ +CO2↑ +4NaCl
2+
2-
2Cu + 2CO3 + Н2О → (CuОН)2CO3↓ +CO2↑
18.
Cr2(CO3)3Al2(CO3)3
не існують
2AlCl3 + 3Na2CO3 + 3Н2О → Al(ОН)3↓ + 3CO2↑ +6NaCl
3+
2-
2Al + 3CO3 + 3Н2О → Al(ОН)3↓ + 3CO2↑
19.
CaCO3 + CO2 + Н2О → Ca(HCO3)2Ca(HCO3)2 → CaCO3 + H2СO3
Н2 О
СO2
Ca(HCO3)2 + 2NaOH t→ CaCO3 +Na2CO3 + 2Н2О
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2Н2О
20.
+4CO2 – найвищий ступінь окиснення, але окисні
властивості виражені дуже слабо
+4
0
Mg + CO2 → 2MgO + C
+4
+2
C + CO2 → 2CO
CO2 – застосовують у вогнегасниках
21.
Сполуки з сульфуромСН4 + 4S → CS2 + 2H2S
C + 2S → CS2
сірковуглець
Добрий розчинник для
жирів, олій, восків, смол, каучуків,
а також для сірки, фосфору, йоду, тощо,
у воді він розчиняється погано, зі спиртом
змішується у будь-яких співвідношеннях.
Його застосовують як розчинник, та
екстрагент, а також для боротьби зі
шкідниками, але основну масу сірковуглецю
витрачають для одержання віскозного шовку.
Отруйний, вогненебезпечний.
22.
CS2 – безбарвна рідина, tкип.= 46,2 оСмолекула лінійна, неполярна
CS2 – кислотний сульфід
CS2 + Na2S → Na2CS3
кислота
тіокарбонат
основа
CO2 + Na2О → Na2CО3
Na2CS3 + 2HCl
→
карбонат
H2CS3 + 2NaCl
тіовугільна
кислота
К1 = 2·10-3
23.
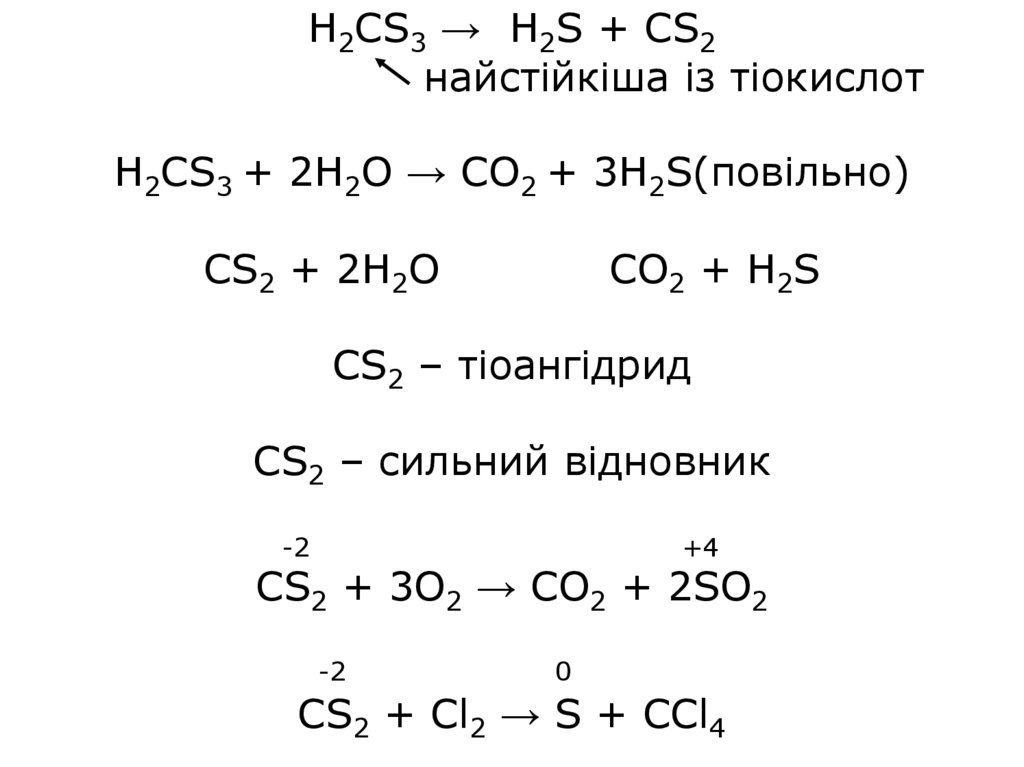
H2CS3 → H2S + CS2найстійкіша із тіокислот
H2CS3 + 2H2O → CO2 + 3H2S(повільно)
t
CS2 + 2H2O
CO2 + H2S
CS2 – тіоангідрид
CS2 – сильний відновник
-2
+4
CS2 + 3O2 → CO2 + 2SO2
-2
0
CS2 + Cl2 → S + CCl4
24.
СПОЛУКИ З ГАЛОГЕНАМИФреони СF4 (tкип.= -128 оС) та СF2Сl2
вони мають значну теплоту випаровування за
низької температури кипіння і застосовуються
як робочі речовини холодильних машин.
Їх використовують також у виробництві
дезодорантів
СCl4 - безбарвна рідина,
застосовують як дуже добрий розчинник
органічних речовин, його негорючість іноді
використовують для гасіння пожеж
25.
CO + Cl2 → COCl2CH4 + 4Cl2→ CCl4 + 4HCl
CCl4, COCl2 – галогеноангідриди
CCl4 + 3H2O → H2CO3 +4HCl
COCl2 + 2H2O → H2CO3 + 2HCl
26.
СПОЛУКИ З НІТРОГЕНОМC2N2
2AgCN → 2Ag + C2N2
CuSO4 + 4KCN → 2CuCN↓ + C2N2 + 2 K2SO4
Диціан – надзвичайно отруйний газ
tкип.= -21OС
27.
π, πN
С
С
N
С
С
σ
N
N
sp – гібридизація
C2N2 + H2 → 2HCN
аналогічно Cl2 + H2 → 2HCl
Cl2 + KOH →
C2N2 + 2KOH → KCN + KCNO + H2O
ціанід
ціанат
28.
HCNNH3 + CO → HCN + H2O
2CH4 +3O2 + 2NH3 → 2HCN +6H2O
HCN ⇆ H+ +CNКд = 1·10-10
H
C
N⇆H
N
¨
C
□
Ізомери (таутомери), перебувають у рівновазі
29.
Промислові способи добування солей:K2CO3 + C + 2NH3 → 2KCN + 3H2O
2NaNH2 + 2C → 2NaCN + 3H2O
CN- - ліганд сильного поля
FeCl2 + 6KCN → K4[Fe(CN)6] + 2KCl
30.
CN- - має відновні властивості2KCN + O2 → 2KCNO
HOCN
Кд≈10-4
H О C
ціанова
N⇆H N
C
ізоціанова
О⇆H
О
N
¨
C
□
“гримуча”
31.
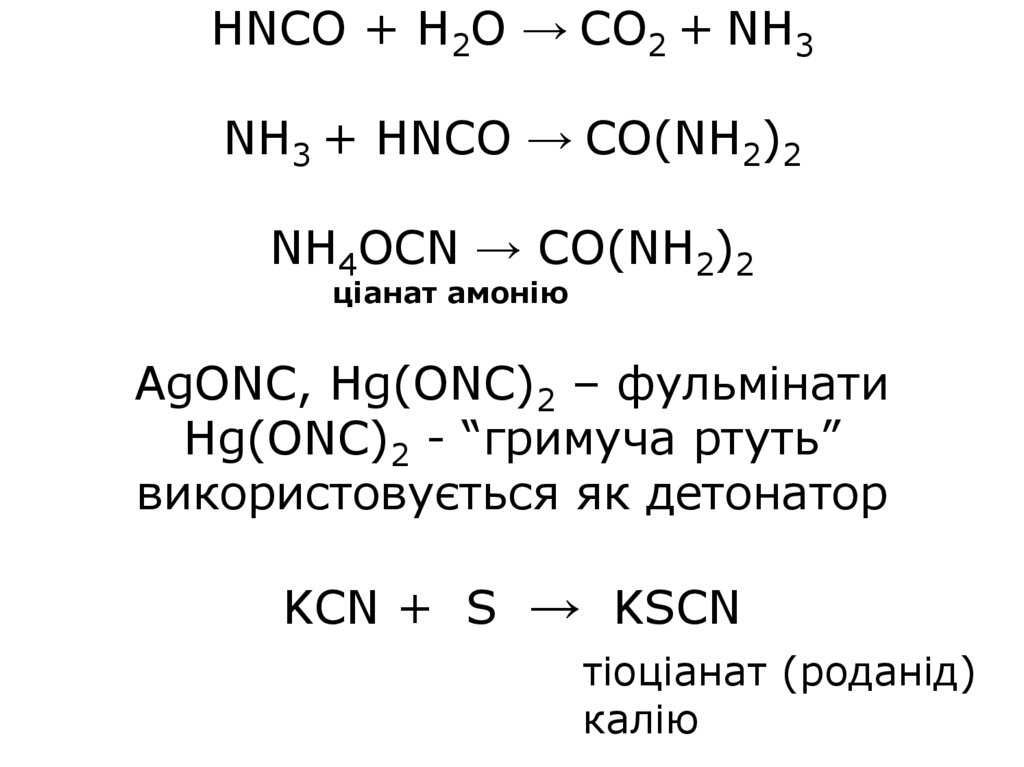
HNСO + H2O → CO2 + NH3NH3 + HNСO → CO(NH2)2
NH4OCN → CO(NH2)2
ціанат амонію
AgONC, Hg(ONC)2 – фульмінати
Hg(ONC)2 - “гримуча ртуть”
використовується як детонатор
KCN + S → KSCN
тіоціанат (роданід)
калію
32.
HS
C
N⇆H
N
C
S
НSCN - сильна кислота(К=0,14), тому роданіди
лужних металів не гідролізують
[Со(NH3)5NCS]2+
[Со(NH3)5SCN]2+
ізомерія зв'язку
FeCl3 + 6KSCN → K3[Fe(SCN)6] + 3KCl
Hg(SCN)2 – тіоціанат Hg
2Hg(SCN)2 → HgS + CS2 + C3N4











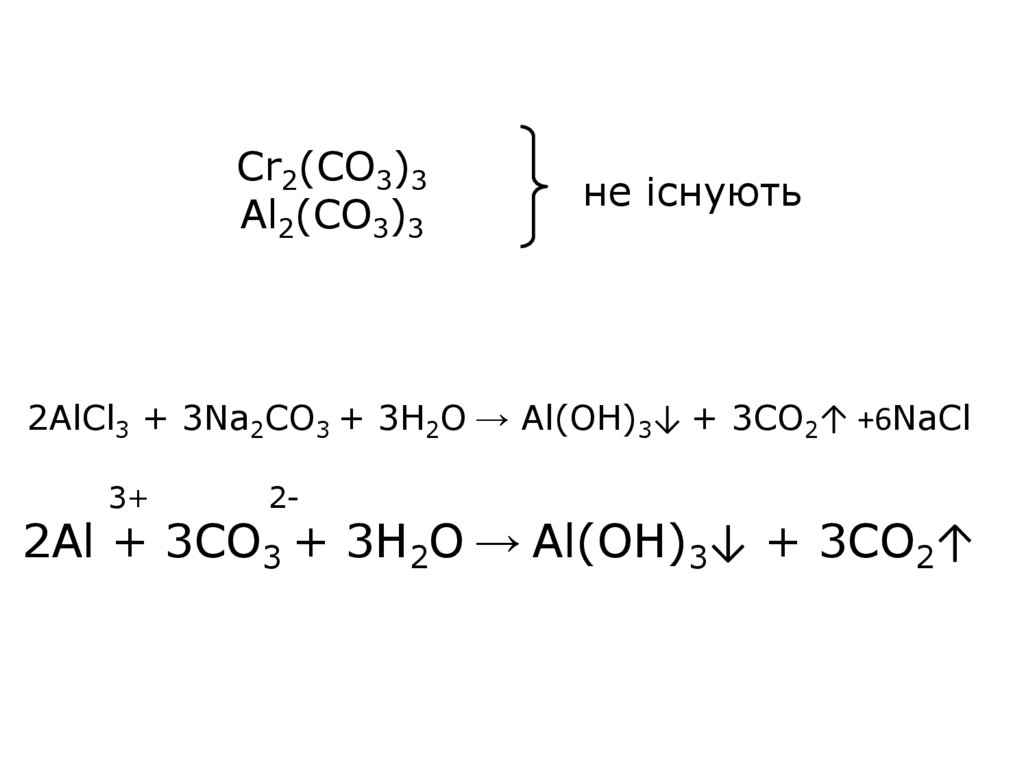
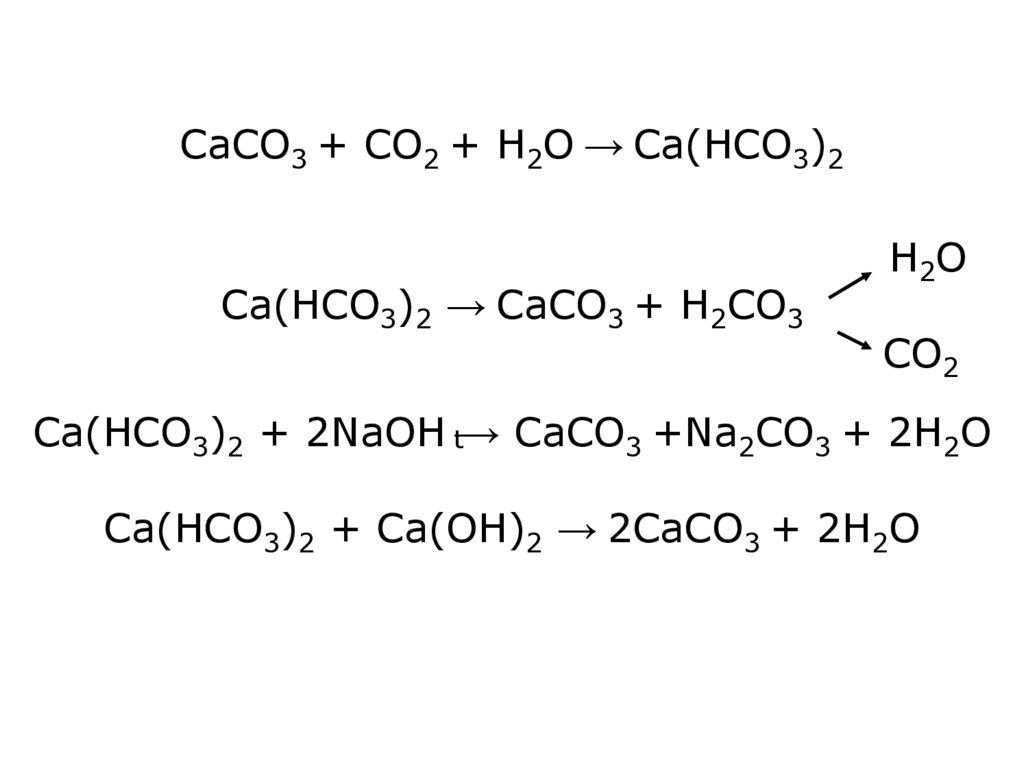











 Химия
Химия








