Похожие презентации:
Классификация химических элементов. Составитель. 8 класс
1.
Тема урока 8 класс:Классификация химических
элементов
Составитель
2.
Предшественники Д. И. Менделеева1. Й. Я. Берцелиус ( шведский
учёный) классифицировал все
элементы на металлы и
неметаллы. Он определил, что
металлам чаще всего
соответствуют
основные оксиды и основания, а
неметаллам – кислотные оксиды и
кислоты.
⮚
⮚
Na→Na2O→NaOH
S →SO3→H2SO4
3.
Свойства гидроксида цинка1. Взаимодействие гидроксида цинка с соляной
кислотой:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Вывод: гидроксид цинка – основание
2. Взаимодействие гидроксида цинка с гидроксидом
натрия:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Вывод: гидроксид цинка – кислота
Итоговый вывод: гидроксид цинка – амфотерное
соединение
4.
Предшественники Д. И. Менделеева2. И. В. Дёберейнер ( немецкий
химик) в 1829 г. предпринял
первую значимую попытку
систематизации элементов . Он
заметил, что некоторые сходные по
своим свойствам элементы можно
объединить по три в группы,
которые он назвал триадами.
Триады Дёберейнера:
Li
Ca
P
S
Cl
Na
Sr
As
Se
Br
K
Ba
Sb
Te
I
М (Na) = ( 7 + 39 ) / 2 = 23
5.
Предшественники Д. И. Менделеева3. А. Бегье де Шанкуртуа
(профессор Парижской
высшей школы) в 1862 г.
Предложил располагать
элементы по спирали в
порядке возрастания их
атомных масс.
Спираль Шанкуртуа:
6.
Предшественники Д. И. Менделеева4. Д. Ньюлендс (английский учёный)
в 1865 г. расположил элементы в
порядке возрастания их атомных масс.
Заметил, что сходство в свойствах
проявляется между каждым восьмым
элементом. Такую закономерность
Ньюлендс назвал законом октав по
аналогии с семью интервалами
до ре ми
музыкальной гаммы. Октава
Ньюлендса:
H
Li Be
фа соль ля
си
B
C
N
O
F
Na Mg
Al
Si
P
S
Cl
K
Ca
Ti
Cr
Mn
Fe
Co Ni Cu
V
Zn
In
As
Se
7.
Предшественники Д. И. Менделеева5. Л. Мейер (немецкий химик) в 1864 г.
расположил химические элементы в
порядке увеличения атомных масс и по
валентности.
Таблица Мейера содержала только
28 элементов.
Вален Вален Вален Вален Вален Вален
тность тность тность тность тность тность
IV
III
II
I
I
II
I ряд
Li
Be
II ряд
C
N
O
F
Na
Mg
III ряд
Si
P
S
Cl
K
Ca
As
Se
Br
Rb
Sr
Te
I
Cs
Ba
IV ряд
V ряд
Sn
Sb
VI ряд
Pb
Bi
Tl
8.
В основу периодического закона Д. И.Менделеев взял коренное свойство
химического элемента- его атомный вес.
• С возрастанием атомного веса
1)металлические свойства постепенно
ослабевают (Na Mg Al Si), а неметаллические
усиливаются (Si, P, S, Cl) и обрываются у
инертного газа (Ar);
• 2)валентность в высших оксидах возрастает от
1-го до 7-и;
• 3)валентность в летучих водородных
соединениях уменьшается от 4-х до 1-го;
• 4)свойства химических элементов повторяются
периодически (через 7 на 8-ой).
9.
Семейства химических элементов сосходными свойствами
Естественные
группы
Химические
элементы
Высшая
валентность
Формула
высшего
оксида
Общие свойства
Щелочные
металлы
Li, Na, K, Rb,
Cs
I
R2O
В воде образуют
щёлочи
Щелочноземел
ьные металлы
Ca, Sr, Ba
II
Халькогены
S, Se, Te
VI
RO3
«Рождающие
руды»
Галогены
F, Cl, Br, I
VII
R2O7
С металлами
образуют соли
RO
Их оксиды –
«земли» сообщают
в воде щелочную
реакцию
10.
ВыводКлассификация химических элементов до
Д. И. Менделеева была не точной, не научной, не
совершенной, так как за основу классификации
брался не главный признак.
11.
• Распределите по группамследующие оксиды: Na2O, CO2,
P2O5, Cr2O3, ZnO, SO2, CaO,
BeO, Ai2O3, CuO.
• Распределите по группам
следующие оксиды: CO, Fe2O3,
BaO, K2O, SiO2, Li2O, Al2O3,
H2O, SO3, N2O5
12.
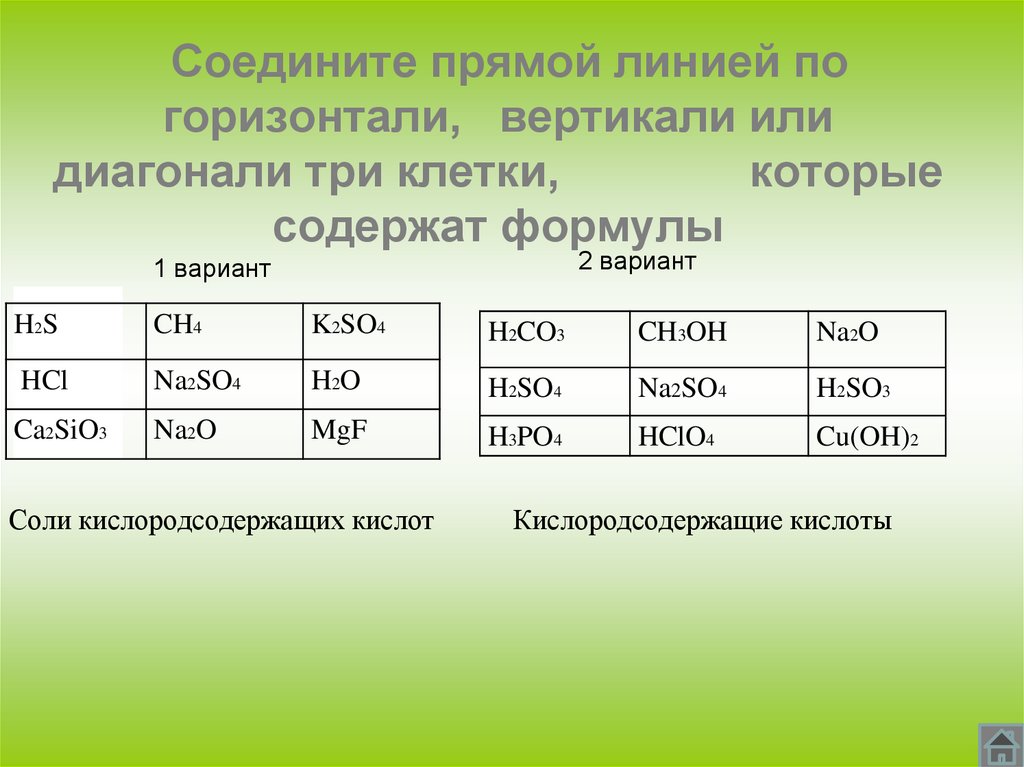
Соедините прямой линией погоризонтали, вертикали или
диагонали три клетки,
которые
содержат формулы
2 вариант
1 вариант
H2S
CH4
K2SO4
H2CO3
CH3OH
Na2O
HCl
Na2SO4
H2O
H2SO4
Na2SO4
H2SO3
Ca2SiO3
Na2O
MgF
H3PO4
HClO4
Cu(OH)2
Соли кислородсодержащих кислот
Кислородсодержащие кислоты
13.
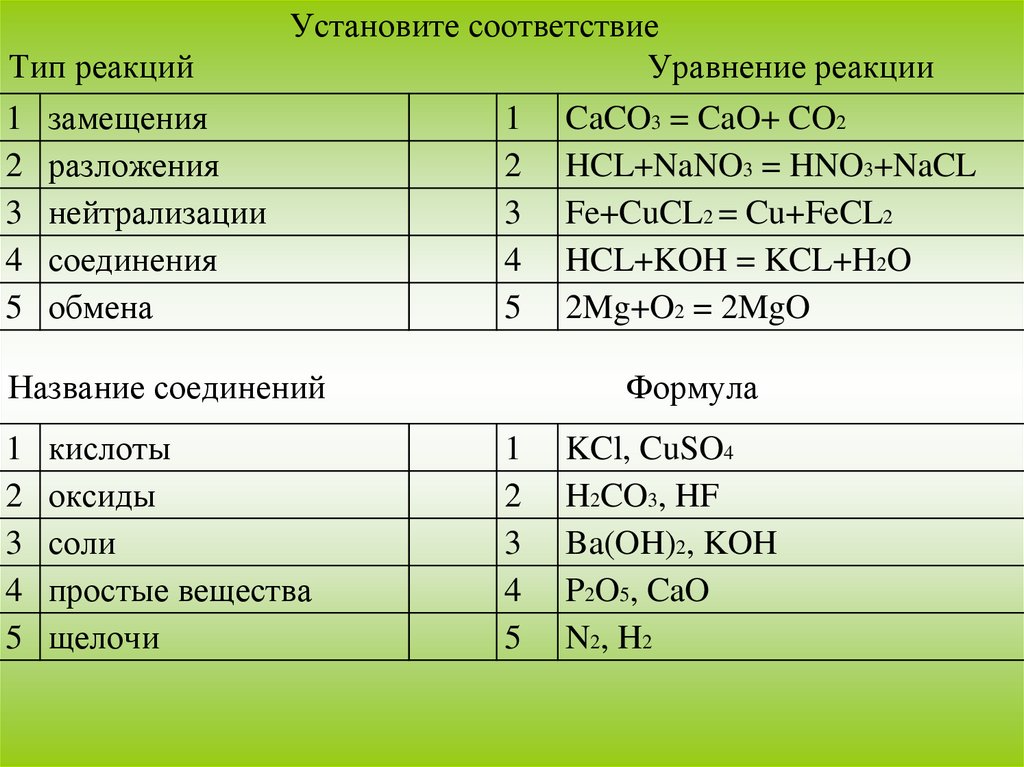
Установите соответствиеТип реакций
Уравнение реакции
1 замещения
1 CaCO3 = CaO+ CO2
2 разложения
2 HCL+NaNO3 = HNO3+NaCL
3 нейтрализации
3 Fe+CuCL2 = Cu+FeCL2
4 соединения
4 HCL+KOH = KCL+H2O
5 обмена
5 2Mg+O2 = 2MgO
Название соединений
1
2
3
4
5
кислоты
оксиды
соли
простые вещества
щелочи
Формула
1
2
3
4
5
KCl, CuSO4
H2CO3, HF
Ba(OH)2, KOH
P2O5, CaO
N2, H2
14.
Третий лишний"Необходимо найти на каждой строке лишнюю формулу вещества и
объяснить, почему именно эта формула лишняя.
1. Найти лишнюю формулу, вычеркнуть ее и назвать класс веществ:
1) Н20, К2SO4, SO2 -. . .;
2) ВаSО4, НС1, СuС12 -. . .;
3) NaОН, СuО, Сu(ОН)2 - . . .;
4) Н2SО3, НС1, КNO3 -. . ..
2. Найти лишнюю формулу, вычеркнуть ее и назвать класс веществ:
1) Н2SO3, LiNO3, Н2SO4 -. . .;
2) NаОН, Ва(ОН)2, Н2S - . . . ; .
3) Nа2СO3, Р2O5, МgO -. . .;
4)А1РО4, СuSО4, Zn(ОН)2 - . . ..
15.
Домашнее заданиеД/з §34 упр. 1-3 ,













 Химия
Химия








