Похожие презентации:
Химия белков. Тема 3
1.
Тема 3. Химиябелков
601-800
9
370
13
2.
БИОЛОГИЧЕСКИЕ ПОЛИМЕРЫБиологические полимеры - это высокомолекулярные природные
соединения, определяющие важнейшие процессы жизнедеятельности.
Свойства биополимеров зависят от строения их молекул: числа и
разнообразия мономерных звеньев, образующих полимер
ОСНОВНЫЕ ТИПЫ БИОПОЛИМЕРОВ
БЕЛКИ
601-800
9
370
13
НУКЛЕИНОВЫЕ
КИСЛОТЫ
ПОЛИСАХАРИДЫ
3.
ХИМИЯ БЕЛКОВГлавные химические компоненты живых организмов
Макроэлементы
микроэлементы
601-800
9
370
13
вода
белки
липиды
углеводы
4.
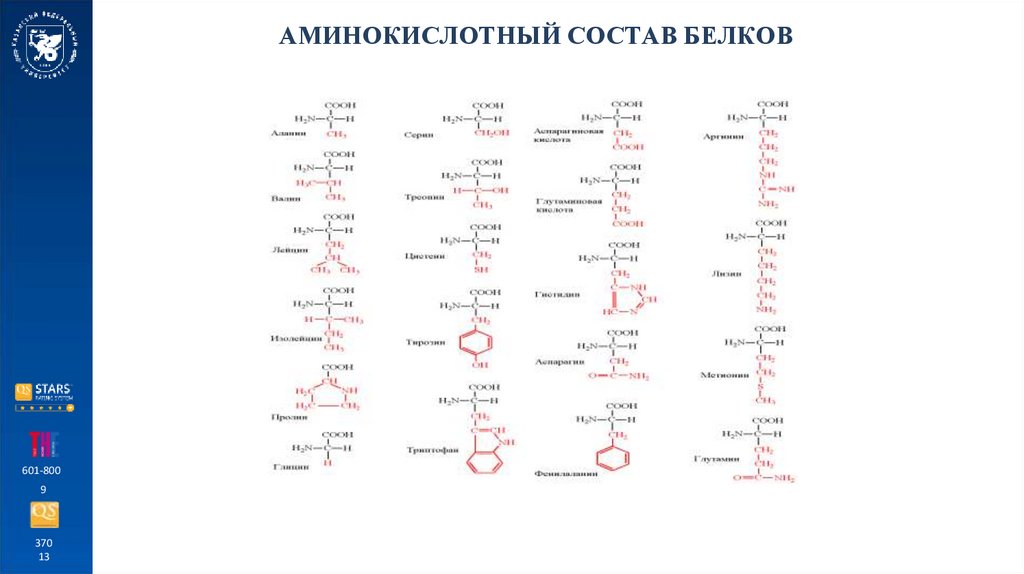
АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКОВГидрофобные (неполярные) аминокислоты:
1) алифатические аминокислоты;
2) ароматические аминокислоты;
Гидрофильные (полярные) аминокислоты:
1) кислые аминокислоты;
2) основные аминокислоты;
3) нейтральные аминокислоты;
4) серосодержащие аминокислоты.
Незаменимые аминокислоты – аминокислоты, не синтезируемые организмом человека и
животных, но входящие в состав их белков. Синтезируются только растениями и человек
получает их с пищей.
Это валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин, триптофан.
601-800
9
370
13
5.
АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКОВ601-800
9
370
13
6.
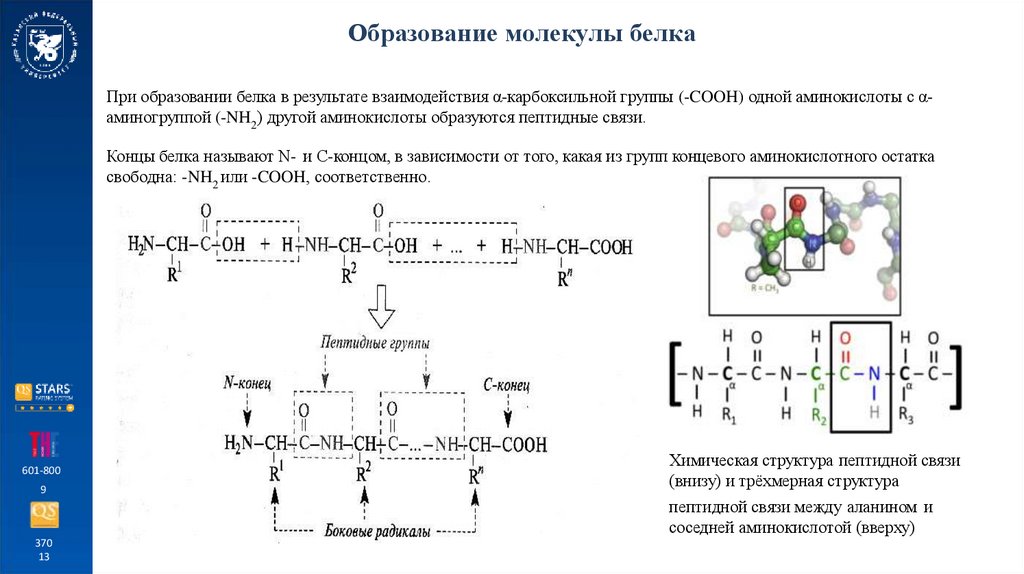
Образование молекулы белкаПри образовании белка в результате взаимодействия α-карбоксильной группы (-COOH) одной аминокислоты с αаминогруппой (-NH2) другой аминокислоты образуются пептидные связи.
Концы белка называют N- и C-концом, в зависимости от того, какая из групп концевого аминокислотного остатка
свободна: -NH2 или -COOH, соответственно.
601-800
9
Химическая структура пептидной связи
(внизу) и трёхмерная структура
пептидной связи между аланином и
соседней аминокислотой (вверху)
370
13
7.
РОЛЬ БЕЛКОВ В ПИТАНИИСоединения белковой и небелковой природы
(ферменты, гормоны, глюкоза,
азотистые основания и т. д.)
Белки пищи
тканей
переваривание
Фонд свободных синтез
аминокислот
Энергия
CO2
Белки
распад
Выводимый азот
Белки относятся к жизненно необходимым веществам, без которых невозможны жизнь, рост и развитие
организма. Белки не образуются из других пищевых веществ и не запасаются в виде резервов.
Характеристики пищевой ценности белков
Биологическая
601-800
ценность
белков
определяется
сбалансированностью
аминокислотного состава и атакуемостью
белков ферментами пищеварительного тракта
Азотистый баланс – это баланс между количеством поступающих
белков и количеством выделяющихся продуктов распада. Три типа
азотистого баланса: азотистое равновесие, положительный азотистый
баланс отрицательный азотистый баланс
9
370
13
Источники пищевых белков - мясо, рыба, молоко, продукты переработки зерна,
хлеб, овощи.
8.
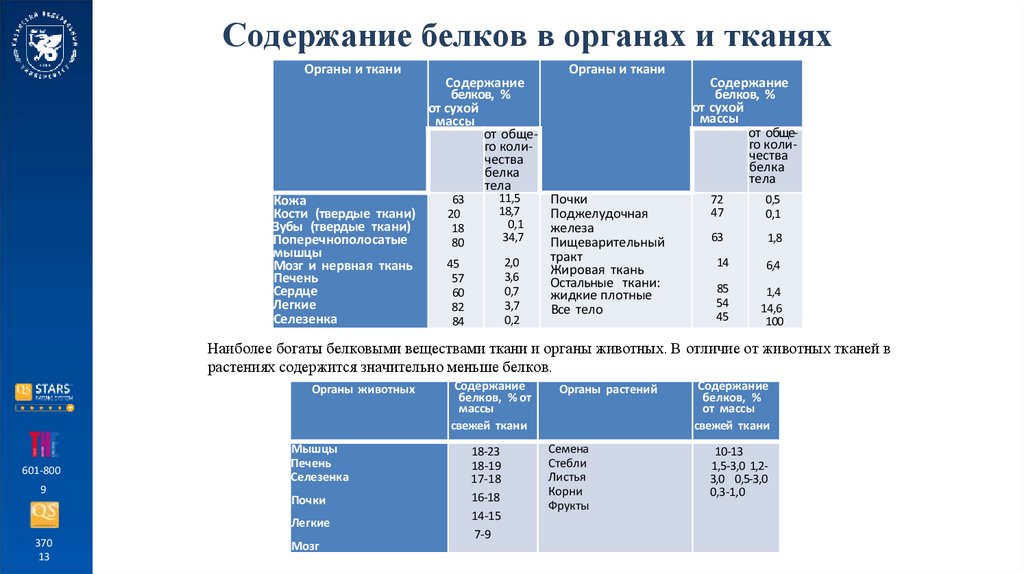
Содержание белков в органах и тканяхОрганы и ткани
Кожа
Кости (твердые ткани)
Зубы (твердые ткани)
Поперечнополосатые
мышцы
Мозг и нервная ткань
Печень
Сердце
Легкие
Селезенка
Содержание
белков, %
от сухой
массы
от общего количества
белка
тела
63
20
18
80
11,5
18,7
0,1
34,7
45
57
60
82
84
2,0
3,6
0,7
3,7
0,2
Органы и ткани
Почки
Поджелудочная
железа
Пищеварительный
тракт
Жировая ткань
Остальные ткани:
жидкие плотные
Все тело
Содержание
белков, %
от сухой
массы
от общего количества
белка
тела
72
47
0,5
0,1
63
1,8
14
6,4
85
54
45
1,4
14,6
100
Наиболее богаты белковыми веществами ткани и органы животных. В отличие от животных тканей в
растениях содержится значительно меньше белков.
Органы животных
601-800
9
Мышцы
Печень
Селезенка
Почки
Легкие
370
13
Мозг
Содержание
белков, % от
массы
свежей ткани
18-23
18-19
17-18
16-18
14-15
7-9
Органы растений
Семена
Стебли
Листья
Корни
Фрукты
Содержание
белков, %
от массы
свежей ткани
10-13
1,5-3,0 1,23,0 0,5-3,0
0,3-1,0
9.
Белки или протеины (от греч. Protos - первый, первичный) —высокомолекулярные соединения, полностью или частично построенные из αаминокислот.
601-800
9
370
13
1728
белок был выделен из пшеничной муки (клейковины) итальянцем Якопо Бартоломео
Беккари
1762
работы по изучению белка молока (казеина) - Халлер
1789
французским ученым Антуаном де Фуркруа исследовался белок крови, было открыто
свойство белка - коагулировать под воздействием кислот или нагревании.
1839
датский ученый Геррит Мульдер предложил называть белки протеинами (греч.
«protos» - первый, главный), предложил первую модель химического строения белка,
предположил что все белки имеют сходную эмпирическую формулу и минимальной
структурной единицей: С40Н62N10O12 - Pr. Хотя существует версия, что впервые
протеином белок назвал Берцелиус.
1894
немецкий физиолог Коссель выдвинул теорию, по которой все белки состоят из
аминокислот.
1904
немецкий ученый Эмиль Фишер экспериментально доказал, что белки состоят из
аминокислотных остатков, связанных пептидной связью
10.
Классификация белков (исторический аспект)1. Первая классификация предложена Ф.Гоппе-Зейлером (вторая половина XIX века):простые,
сложные, белковоподобные (протеиноиды).
2. Классификация белков по происхождению (животные, растения, микробы). Не получила
широкого распространения.
3. По типу строения:
а) фибриллярные (полимерные системы, структура которых высокорегулярная и поддерживается
за счет межмолекулярных взаимодействий между цепями). Соотношение по вертикали и
горизонтали (> 1:10) (коллаген, кератин)
б) глобулярные (сферическая форма, водорастворимые). Соотношение по вертикали и горизонтали
1:3 – миоглобин).
601-800
9
370
13
11.
Классификация белковПо электрохимическим признакам (кислые, основные и нейтральные)
По полярным
амфифильные)
признакам
(полярные
(гидрофильные),
неполярные
(гидрофобные),
По форме молекул (глобулярные), фибриллярные.
По молекулярной массе (низкомолекулярные – альбумин, высокомолекулярные – глобулины)
По изменению концентрации (конститутивные – с постоянной и
изменяемой скоростью синтеза)
индуцибельные – с
По продолжительности жизни (быстро обновляемые (Т1/2<60/ ) и медленно обновляемые
(T1/2> недели) белки)
По функциям (транспортные,
сократительные и т.д.)
белки–ферменты,
601-800
9
370
13
По химическому составу (простые и сложные).
гормоны,
антитела,
структурные,
12.
ОСНОВНЫЕ ФУНКЦИИ БЕЛКОВ1) Структурная. Во все структуры живой клетки входят белки.
2) Регуляторная. Некоторые гормоны являются белками
3) Защитная. Иммунная защита обеспечивается высокоспецифическими белками – иммуноглобулинами.
4) Рецепторная. Белки являются обязательным компонентом рецепторов, способны узнавать другие
молекулы.
5) Транспортная. Они транспортируют жиры, пигменты, гормоны, лекарственные вещества,
различные гидрофобные соединения и др.
6) Опорная. Коллаген, белки костной ткани.
7) Энергетическая. Окисление 1 г белка сопровождается выделением 17,6 кдж энергии. В сутки
15% энергии образуется за счет распада белков.
8) Сократительная (двигательная). Эту функцию выполняют белки мышечной ткани - актин,
миозин
9) Генно-регуляторная функция гистонов.
601-800
9
10) Гемостатическая. Фибриноген и другие белки плазмы крови участвуют в процессах
свертывания крови
370
13
13.
Особенности белковых молекулБесконечное разнообразие структуры при строгой специфичности каждого белка. В природе
существует от 1010-10 12 различных белков, которые обеспечивают существование 1.2 х106 видов
живых организмов (от вирусов до человека).
2) Многообразие физических и химических превращений. Происходит взаимодействие как
между белками, так и отдельными фрагментами белковых молекул.
3) Белки способны к внутримолекулярным взаимодействиям, что обеспечивает структуры
молекулы, изменчивость и пластичность их формы, обратимость переходов из глобулярное
в фибриллярное состояние.
4) Белкам свойственна способность взаимодействовать с другими химическими соединениями
(нуклеиновыми кислотами, полисахаридами, липидами), образуя надмолекулярные комплексы.
. Эти комплексы-основа субклеточных структур.
5) Белки способны закономерно изменять свою структуру под влиянием внешнего воздействия
и восстанавливать исходную структуру при прекращении этого воздействия.
6) Многие белки обладают уникальной особенностью каталитически ускорять химические
реакции, протекающие в человеческом организме.
1)
601-800
9
370
13
14.
Физико-химические свойства белков1. Молекулярная масса. Размер белка может измеряться в числе аминокислотных остатков
или в дальтонах (молекулярная масса), но из-за относительно большой величины молекулы
масса белка выражается в производных единицах — килодальтонах (кДа).
Первое определение молекулярной массы сделано Адаиром (Adair) в 1920 г. (Определил массу
гемоглобина -72 000, современные методы 64 500-66 000).
Для определения молекулярной массы белков применяют
такие методы, как осмометрический, вискозиметрический,
диффузионный, гель-фильтрация, массспектрометрический анализ и др.
601-800
9
Сравнительный размер молекул белков. Слева направо: антитело (IgG), гемоглобин, инсулин
(гормон), аденилаткиназа (фермент) и глютаминсинтетаза (фермент)
370
13
15.
2. Растворимость белка. Белки, растворяясь в воде образуют коллоидные растворы,диаметр частиц от 10-3 до 10-1 мкм. Частицы белка не проходят через полупроницаемые
мембраны и это свойство лежит в основе очистки белка от низкомолекулярных соединений
методом диализа.
Растворимость белка определяется:
- наличием полярных боковых радикалов;
- электрическим зарядом (большинство белков несут избыточный отрицательный заряд,
т.к. изоэлектрическая точка большинства белков ниже рН 7);
- степенью гидратации (гидратная вода может составлять 20% массы белка).
1. Водорастворимые белки – альбумины (белки крови, молока, яичный белок)
2. Нерастворимые в воде - склеропротеины ( кератин волос, шерсти, пера; коллаген кожи,
сухожилий; фиброин шелка.
3. Растворимые в разбавленных водных растворах солей, кислот, щелочей (глобулины –
белковые ферменты, гормоны; глутелины – белки семян злаковых (не растворяются в
растворах солей!). Частный случай – глиадины (растворяются в 70% спирте). Гистоны и
протамины (растворяются в щелочных растворах).
601-800
9
370
13
16.
3. Амфотерность белка. Белки обладают свойством амфотерности, то есть в зависимостиот условий проявляют как кислотные, так и основные свойства.
Каждый белок характеризуется изоэлектрической точкой (Pi) — кислотностью среды
(рН), при которой суммарный электрический заряд молекул данного белка равен нулю
и, соответственно, они не перемещаются в электрическом поле (например, при
электрофорезе).
Изоэлектрическая точка большинства белков животных тканей лежит в пределах от 5,5 до 7,0, что
свидетельствует о частичном преобладании кислых аминокислот. В изоэлектрической точке
белки наименее устойчивы в растворе и легко выпадают в осадок. Изоэлектрическая точка белка
в сильной степени зависит от присутствия в растворе ионов солей, но на ее величину не влияет
концентрация белка.
601-800
9
370
13
17.
4. Денатурация белка. Природные белковые тела обладают строго заданной пространственнойконфигурацией и рядом характерных физико-химических и биологических свойств при физиологических
значениях температуры и рН среды. Под влиянием различных факторов (физических, химических) белки
подвергаются свертыванию и выпадают в осадок, теряя свои свойства.
Денатурация – это нарушение уникальной структуры белка, преимущественно ее третичной структуры,
приводящее к потере характерных для нее свойств (растворимость, электрофоретическая подвижность,
биологическая активность и т.д.). Большинство белков денатурирует при нагревании их растворов выше 50600С.
При денатурации ослабляются гидрофобные взаимодействия, разрываются водородные связи, а в присутствии
восстановителей и дисульфидные связи. Денатурация с разрывом невалентных связей обычно обратима. Путем
образования новых невалентных связей, а также благодаря взаимодействию с денатурирующим веществом
стабилизируется новая конформация.
Возникающее метастабильное состояние при восстановлении физиологических условий может вернуться к
первоначальной конформации (ренатурация).
Денатурация и
ренатурация на примере
панкреатической
рибонуклеазы
601-800
9
370
13
Белок альбумин в яйце
претерпевает денатурацию в
процессе его приготовления.
Ниже представлен этот
процесс на примере скрепок.
18.
1.2.
3.
4.
5.
6.
601-800
9
370
13
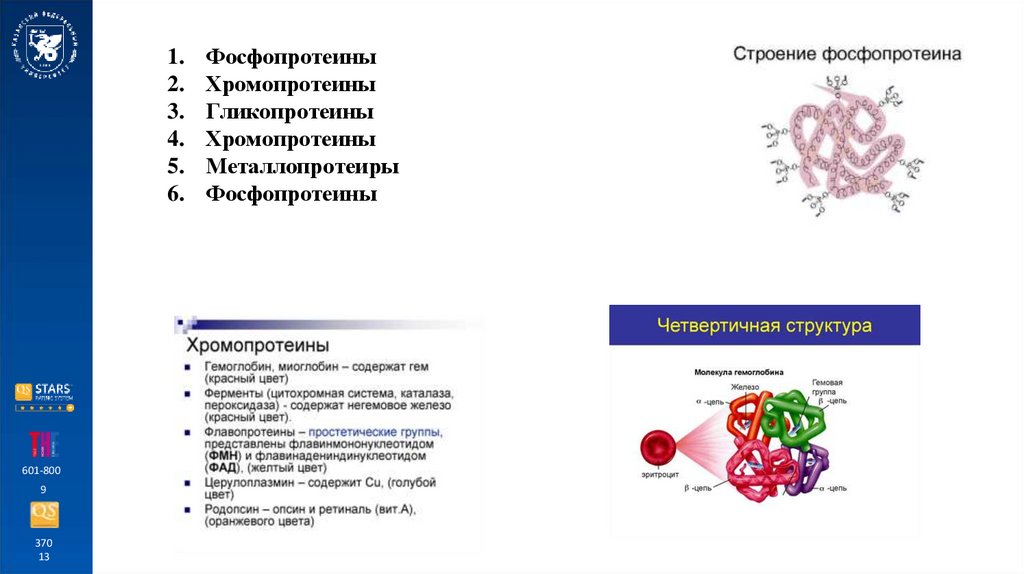
Фосфопротеины
Хромопротеины
Гликопротеины
Хромопротеины
Металлопротеиры
Фосфопротеины
19.
601-8009
370
13
20.
601-8009
370
13
21.
601-8009
370
13
22.
601-8009
370
13















 Химия
Химия