Похожие презентации:
Оксиды неметаллов и кислородсодержащие кислоты. 11 класс
1.
«Сами трудясь, вымногое сделаете для
себя и для близких, а
если при труде успеха
не будет, будет
неудача, не беда –
попробуйте еще».
Д.И.Менделеев
2. Вопросы:
• 1.Где в периодической таблице расположены неметаллы?• 2) Какой из неметаллов имеет самый маленький радиус
атома?
• 3) Как изменяется характер химических свойств простых
веществ-неметаллов в группе?
• 4) Какое из простых веществ проявляет свойства только
окислителя?
• 5) К каким электронным семействам относят элементынеметаллы?
• 6) Какие элементы неметаллы являются биогенными?
• 7)Чем можно объяснить различие в химической
активности неметаллов?
3. Самостоятельная работа
Вариант 1А1. Число электронов на внешнем электронном слое атома
серы в основном состоянии:
•один;
3) три;
•два;
4) шесть.
А2. Молекулярное строение имеет:
•кремний;
3) алмаз;
•сера;
4) красный фосфор.
А3. Неметаллические свойства усиливаются в ряду:
•O, N, F, Cl
3) Si, P, S, Cl
•F, Cl, Br, I
4) N, O, S, P
А4. В роли восстановителя сера выступает в реакции с:
•HNO3;
3) H2;
•Fe;
4) C
В1. Установите соответствие между схемой реакции и схемой
процесса окисления в ней. (цифры в ответе могут повторяться)
Схема реакции
Процесс окисления
А. N2O + C→N2+CO2
1. H02→2H-
Б.C+H2→CH4
2. C0→C-4
В. Na+H2→NaH
3. C0→C+4
Г. Сl2+H2O→HClO+HCl
4.Cl20→2Cl-1
5. H02→2H+1
6. Cl20→2Cl+1
7. Na0→Na+1
8. 2N+1→N20
Вариант 2
А1. Число электронов на внешнем электронном слое атома хлора
в основном состоянии:
•один;
3) шесть;
•пять;
4) семь.
А2. Немолекулярное строение имеет:
•йод;
3) алмаз;
•сера;
4) белый фосфор.
А3. Неметаллические свойства ослабевают в ряду:
•Si, P, S, Cl
3) Br, Se, Te, I
•Sb, Fs, P, N
4) O, S, Se, Te
А4. В роли окислителя фосфор выступает в реакции с:
•HNO3;
3) Cl2;
•Ca;
4) KClO3
В1. Установите соответствие между схемой реакции и схемой
процесса
окисления в ней. (цифры в ответе могут повторяться)
Схема реакции
А. N2O + C→N2+CO2
Процесс восстановления
1. H02→2H+1
Б. Br2+H2O→HBrO+HBr
2. C0→C-4
В. N2+H2→NH3
3. C0→C+4
Г. C+H2→CH4
4. 2N+1→N20
5. Br20→ 2Br+1
6. H02→2H7. Br20→ 2Br-1
8. N20→2N-3
4. Ответы
Вариант 11. 3
2.2
3. 3
4.1
5. А3 Б5 В7 Г6
Вариант 2
1.4
2.3
3.4
4.2
5.А4 Б7 В8 Г2
5. Сицилийское озеро
6. Оксиды неметаллов и кислородсодержащие кислоты
11 класс14.04.2023г.
Оксиды
неметаллов и
кислородсодер
жащие
кислоты
7.
В результате изучения темы ,выбудете способны:
1. Рассматривать классификацию оксидов НеМе
2.Делать выводы по химической активности
оксидов НеМе
3.Рассматривать физические св-ва НеМеО
4. Рассматривать способы получения НеМеО
5.Писать уравнения реакций характеризующих
хим. св-ва оксидов НеМе
6.Осуществлять рефлексию учебной
деятельности
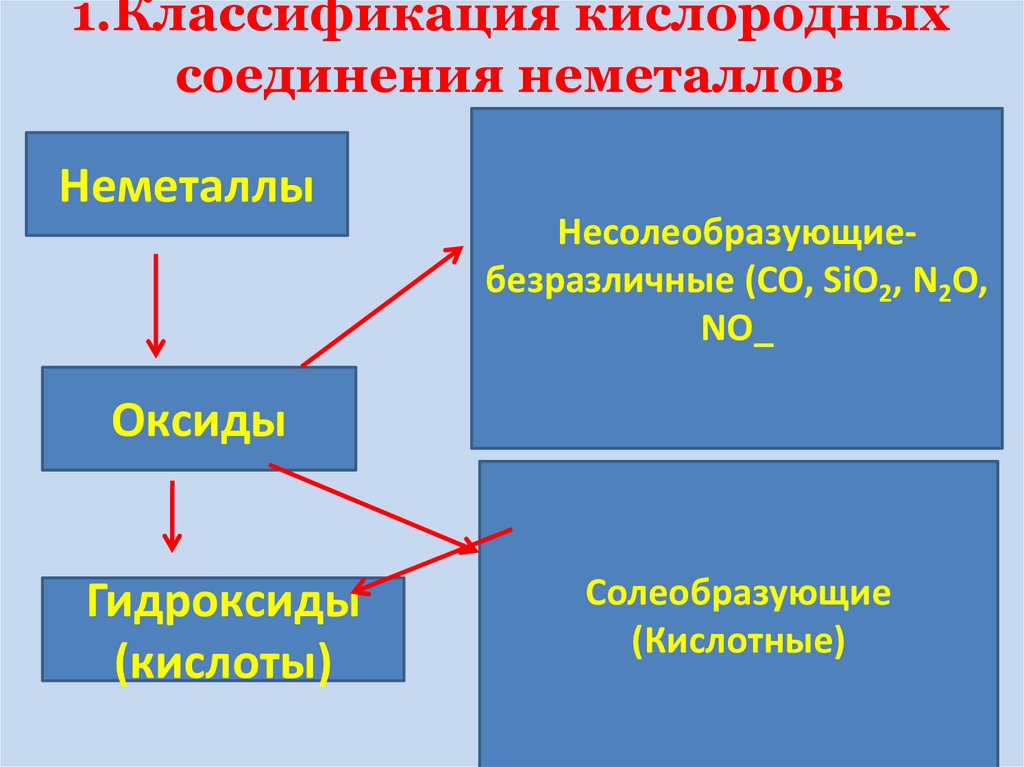
8. 1.Классификация кислородных соединения неметаллов
НеметаллыНесолеобразующиебезразличные (CO, SiO2, N2O,
NO_
Оксиды
Гидроксиды
(кислоты)
Солеобразующие
(Кислотные)
9.
Как определить характер оксида:1. Определяем СО элемента, образующего
оксид.
1) Если СО элемента = +3 или более, то
оксид - кислотный
2) Если СО элемента = +1 или +2 , и
элемент – неметалл,- то оксид
безразличный (несолеобразующий)
10.
I1
2 2
3 3
1
4
Н
II
III
IV
1
He 4,0032
Водород
Гелий
B
5
10,811
Бор
C
6
12,011
Углерод
Si
Кремний
SiO2
14,00
Азот
14 Р
28,086
7
N
6
15 S
30,9738
Фосфор
H2SiO3
ЛВС
Сера
Селен
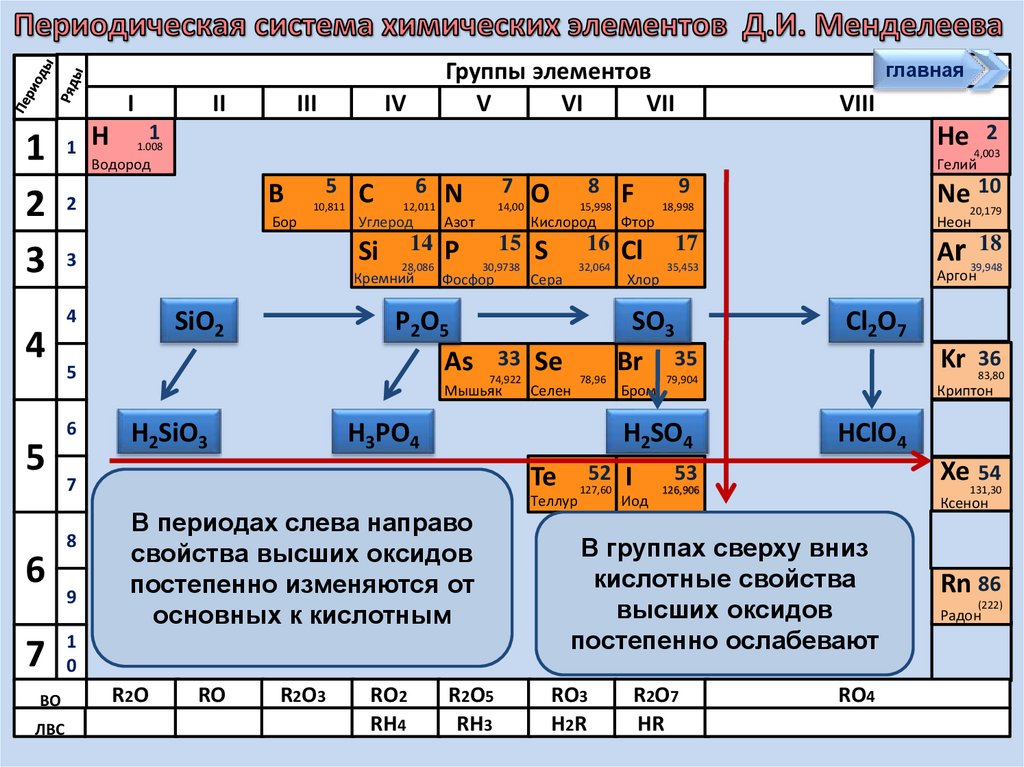
В периодах слева направо
свойства высших оксидов
постепенно изменяются от
основных к кислотным
RO
R 2 O3
RO2
RH4
R 2 O5
RH3
Теллур
10
Ne20,179
Фтор
Хлор
Неон
17
18
Ar 39,948
35,453
Аргон
Cl2O7
Kr 36
83,80
Бром
52 I
Te
R2 O
9
18,998
H2SO4
7 10
ВО
F
16 Cl
32,064
H3PO4
7
9
15,998
P2O5
SO3
33 Se
35
As 74,922
Br 79,904
78,96
5
8
8
O
Кислород
Мышьяк
5
VIII
1.008
4
6
главная
Группы элементов
V
VI
VII
127,60
Криптон
HClO4
Xe131,30
54
53
Иод
126,906
Ксенон
В группах сверху вниз
кислотные
свойства
85
At (210)
высших
оксидов
Астат
постепенно ослабевают
RO3
H2 R
R 2 O7
HR
RO4
Rn 86
(222)
Радон
11.
I1
2 2
3 3
1
4
Н
II
III
IV
6
VIII
1
1.008
Водород
B
5
10,811
Бор
C
6
12,011
Углерод
Si
Кремний
14,00
Азот
14 Р
28,086
7
N
8
O
15,998
Кислород
15 S
30,9738
Фосфор
F
Фтор
16 Cl
Сера
32,064
9
18,998
Хлор
17
35,453
4
33 Se
As 74,922
Br
78,96
5
Мышьяк
5
главная
Группы элементов
V
VI
VII
Бром
R2+7O7-2
6
7
8
Селен
35
79,904
R2+5O5-2
R+6O3-2
Te
Теллур
52 I
127,60
53
Иод
126,906
R+4O2-2
At
9
85
(210)
Астат
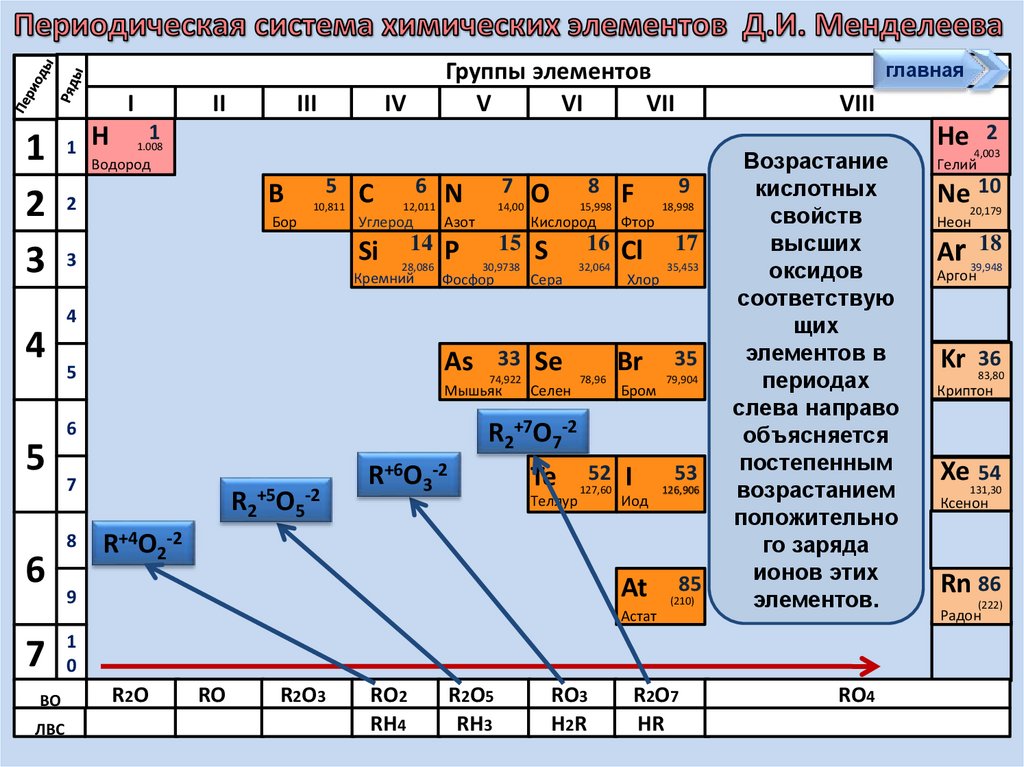
Возрастание
кислотных
свойств
высших
оксидов
соответствую
щих
элементов в
периодах
слева направо
объясняется
постепенным
возрастанием
положительно
го заряда
ионов этих
элементов.
7 10
ВО
ЛВС
R2 O
RO
R 2 O3
RO2
RH4
R 2 O5
RH3
RO3
H2 R
R 2 O7
HR
RO4
He 4,0032
Гелий
10
Ne20,179
Неон
18
Ar 39,948
Аргон
Kr 36
83,80
Криптон
Xe131,30
54
Ксенон
Rn 86
(222)
Радон
12.
ЗаданиеДаны формулы кислотных оксидов. Расположите эти формулы в порядке
усиления кислотных свойств оксидов.
13. 2.Оксиды НеМе
1.Кристаллическая решетка:Преимущественно молекулярная,
SiO2 - атомная
2.Физические свойства:
газы(CO2, SO2, CO, NO2),
жидкости(H2O, N2O3, SO3 ),
твердые вещества(SiO2, P2O5, N2O5)
Табл.21-22 стр.175-178
14.
Физические свойства,или калейдоскоп красок и
запахов
N 2O
NO2
NO
N 2O 3
N 2O 5
Бесцветный газ,
сладковатый запах
Красно-бурый газ,
резкий запах
Бесцветный газ, при
низких температурах –
голубая жидкость
Синяя жидкость
Белые, летучие
кристаллы
15.
Соедините между собой оксиды неметаллов икислородсодержащие кислоты, соответствующие им.
16.
3.Получение оксидов НеМеЗадание 1.Написать уравнения реакций
1.Взаимодействие простых веществ с кислородом
2. Окисление сложных веществ кислородом
3. Окисление простых и сложных веществ другими
окислителями
4. Термическое разложение сложных веществ (солей, кислот)
5. Взаимодействие солей неустойчивых
кислородсодержащих кислот с сильными кислотами и с
кислотными или амфотерными оксидами
17.
Физкультминутка«Сложные вещества делятся на оксиды, основания, кислоты и соли» —
прямые руки и опустить, вдоль тела.
«Оксиды» — две руки соединить над головой, изображая букву О, что
указывает на оксиды.
«Делятся на несолеобразующие» — перекрестить руки над головой, что
означает отрицание.
«И солеобразующие» — отвести руки в стороны, выполнить волнообразные
движения руками. Это символизирует, что данные оксиды взаимодействуют с
водой и образуют соли.
«Солеобразующие оксиды бывают основными» — правая рука в сторону
вправо.
«Кислотными» — левая рука в сторону влево.
«И амфотерными» — соединить прямые руки перед собой.
18.
Окисление безразличныхнесолеобразующих оксидовдо кислотных
2CO+O2↔2CO2
Восстановление Ме
с помощью безразличныхнесолеобразующих оксидов
t
CO+FeO↔Fe+CO
2↑
t
19.
4.Химические свойства оксидов НеМеВзаимодействие
с основными
оксидами
Взаимодействие
со щелочами
Менее летучие
кислотные оксиды
вытесняют более
летучие кислотные
оксиды из их солей.
Взаимодействие
с кислородом
(если возможно
повышение степени
окисления)
Взаимодействие
с водой
Стр.178
20.
Задание 2.Группа 1.С какими из следующихвеществ будет
реагировать CO2:
CO2 + CaO →
CO2 + P2O5 →
CO2 + NaOH→
CO2 + Na2SO4 →
CO2 + H2O→
21.
Группа 1.С какими из следующих веществбудет
реагировать CO2: Проверка!
CO2 + CaO →CaCO3
CO2 + P2O5 →
CO2 + 2NaOH→Na2CO3+H2O
CO2 + Na2SO4 →
CO2 + H2O→H2CO3
22.
Группа 2.С какими из следующих веществбудет
реагировать P2O5 :
P2O5+ H2O →
P2O5+ NaOH →
P2O5 + CO2 →
P2O5+ K2SO4 →
P2O5+ Сa(OH)2→
23.
Группа 2.С какими из следующих веществбудет
реагировать P2O5 : Проверка!
P2O5+ 3H2O →2H3PO4
P2O5+ 6NaOH →2Na3PO4+3H2O
P2O5 + CO2 →
P2O5+ K2SO4 →
P2O5+ 3Сa(OH)2→Ca3(PO4)2+3H2O
24.
Группа 3.С какими из следующих веществбудет
реагировать SO3:
SO3 + Na2O →
SO3+ CO2 →
SO3 +2NaOH→
SO3+ K2SO4 →
SO3 + H2O→
25.
Группа 3.С какими из следующих веществбудет
реагировать SO3: Проверка!
SO3 + Na2O →Na2SO4
SO3+ CO2 →
SO3 +2NaOH→Na2SO4+H2O
SO3+ K2SO4 →
SO3 + H2O→H2SO4
26.
Группа 4.С какими из следующих веществбудет
реагировать SO2:
SO2+ H2O →
SO2+ Na2O→
SO2+ CO2 →
SO2 +K2SO4 →
SO2 +Сa(OH)2→
27.
Группа 4.С какими из следующих веществбудет
реагировать SO2: Проверка!
SO2+ H2O →H2SO3
SO2+ Na2O→Na2SO3
SO2+ CO2 →
SO2 +K2SO4 →
SO2 +Сa(OH)2→CaSO3+H2O
28.
Группа 5.С какими из следующих веществбудет
реагировать N2O5 :
N2O5+ H2O →
N2O5+ K2O →
N2O5+ CO2 →
N2O5 +K2SO4 →
N2O5+Mg(OH)2→
29.
Группа 5.С какими из следующих веществбудет
реагировать N2O5 : Проверка!
N2O5+ H2O →2HNO3
N2O5+ K2O →2KNO3
N2O5+ CO2 →
N2O5 +K2SO4 →
N2O5+Mg(OH)2→Mg(NO3)2+H2O
30.
Лабораторная работа №7. Распознавание хлоридов и сульфатовЦель работы: ознакомиться и провести качественные реакции на сульфат-, хлорид-ионы.
•Оборудование и реактивы: штатив с пробирками, растворы нитьрата серебра, хлорида
бария, соляной кислоты, серной кислоты,
•Ход работы:
1. Обнаружение сульфат-иона. Внесите в пробирку 1 мл раствора хлорида бария и столько
же раствора серной кислоты. Что наблюдаете? Составьте молекулярные, ионные и
сокращённые ионные уравнения осуществлённых реакций. Сделайте вывод – что является
качественной реакцией на сульфат-ионы?
2. Обнаружение хлорид-иона. В пробирку налейте 1 мл раствора нитрат серебра и столько
же по объему раствора соляной кислоты. Что наблюдаете? Составьте молекулярные,
ионные и сокращённые ионные уравнения осуществлённых реакций. Сделайте вывод о
способе обнаружения хлорид-ионов?
3. Уберите рабочее место и по итогам проведенных опытов заполните таблицу, сделайте
выводы.
31. Кислотные дожди
Чемопасны?
Откуда
берутся?
Пути
решения
32.
33.
Домашнее задание:1) проработать §38, используя электронное
приложение к учебнику, выполните тесты к §38
2) Для тех, кто сдаёт ЕГЭ: задачи № 5,6 стр.
179;
3) Творческие задания:
Подготовьте презентацию (по выбору)
«Кислотные дожди», «Азотная кислота и её
применение», «Серная кислота и её
применение»
34.
БЛАГАДАРЮЗА
УРОК!!!































 Химия
Химия