Похожие презентации:
Оксиды неметаллов
1. Оксиды неметаллов
Урок по химии 11 класс2. Что такое оксиды?
• Оксиды- бинарные соединения скислородом в степени окисления (-2).
• Общая формула оксидов: ЭmOn
где m число атомов элемента Э, а
n – число атомов кислорода.
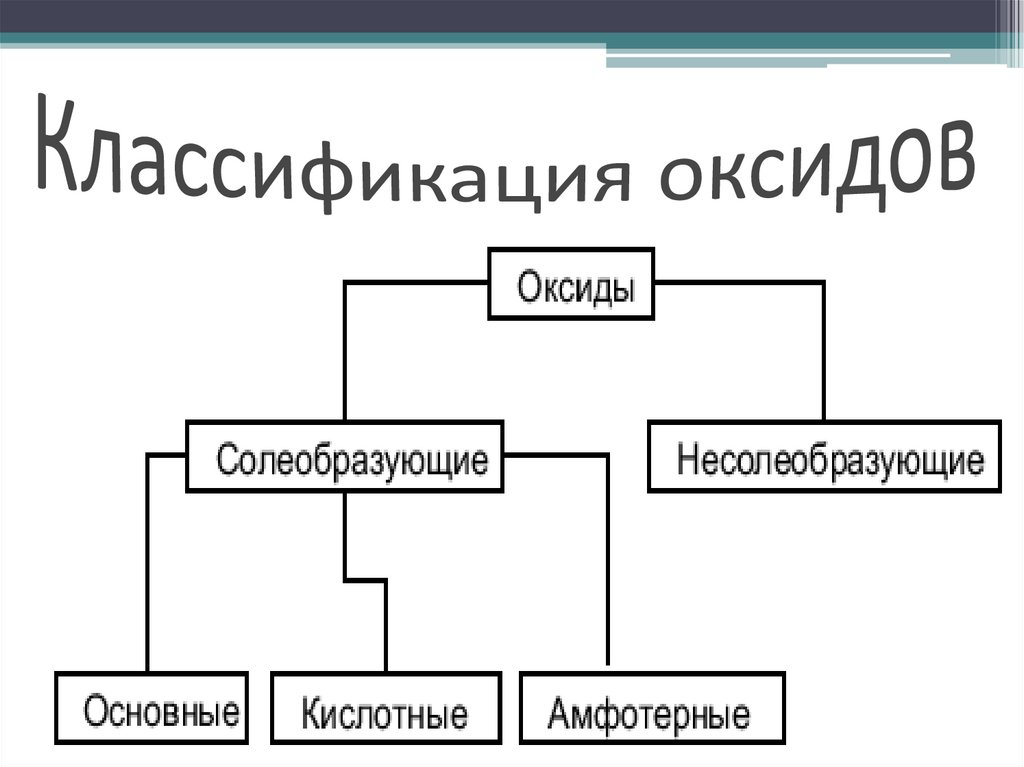
3. Классификация оксидов
4. Солеобразующие оксиды
• Солеобразующими называют такиеоксиды, которые в результате
химических реакций способны
образовывать соли.
• Солеобразующие оксиды, в свою
очередь подразделяются на:
основные, кислотные и амфотерные.
5. Несолеобразующие оксиды
Несолеобразующими называютсятакие оксиды, которые не
взаимодействуют ни со щелочами,
ни с кислотами и не образуют солей.
Их немного, в их состав входят
неметаллы.
6.
Кислотными оксидами называются такие оксиды, которым вкачестве гидратов соответствуют кислоты. Кислотные оксиды
называют также ангидридами кислот.
• Например: кислотные оксиды
SO3 → H2SO4
- соответствующая гидратная форма (кислота)
Р2О5→ H3РO4
• - Какие элементы образуют кислотные оксиды?
Кислотные оксиды образуют неметаллы и металлы при проявлений ими высокой
валентности. Например, оксид марганца (VII) - кислотный оксид, так как в качестве гидрата
ему соответствует кислота HMnO4 и это оксид металла с высокой валентностью.
• Большинство кислотных оксидов могут взаимодействовать с водой непосредственно и при
этом образовывать кислоты.
• Например: СrО3 + H2O → H2CrO4
Р2О5 + H2O → H3РO4
SO3 + H2O → H2SO4
• Некоторые оксиды непосредственно с водой не взаимодействуют. Такого типа оксиды сами
могут быть получены из кислот. Например:
H2SiO3→ SiO2 + H2O (температура)
Это подтверждает названия кислотных оксидов - ангидриды, то есть "не содержащие воду".
• Оксиды SO2 и CO2 реагирую с водой обратимо: СО2 + H2O ↔ H2CO3
SО2 + H2O ↔ H2SO3
7.
1. c водойSO3 + H2O = H2SO4
2. с основаниями
Ca(OH)2 + CO2 = CaCO3 + H2O
3. с основными оксидами
CO2 + CaO = CaCO3
4.с некоторыми солями
CaCO3 + SiO2 = CaSiO3 + CO2
8. Закономерности изменения свойств оксидов неметаллов в ПСХЭ
1.В периодах слева направо свойства высших оксидов и гидроксидовпостепенно изменяются от основных к кислотным
В пределах одного периода с ростом номера группы происходит усиление
кислотных свойств оксидов и соответствующих им гидроксидов:
Si+4O2
P2+5O5
S+6O3
Cl2+7O7
H2Si+4O3
H3P+5O4
H2S+6O4
HCl+7O4
Усиление кислотных свойств оксидов и гидроксидов
Объяснение: Постепенно возрастает заряд ядра и уменьшается радиус иона
2. В группах сверху вниз кислотные свойства высших оксидов неметаллов
уменьшаются
N2+5O5
P2+5O5
As2+5O5
Sb2+5O5
Bi2+5O5
HN+5O3
H 3P+5O4 H 3 As+5O4 H Sb+5 (OH)6 HBi+5O3
Ослабление кислотных свойств
Объяснение: Постепенно возрастает заряд ядра и увеличивается радиус
9. Домашнее задание
Параграф 31 стр.128- 129, таблицы 20-22, сделатьконспект по презентации
Знать химические свойства оксидов неметаллов и
закономерности их изменения в периоде и группе.
Уметь приводить примеры и записывать уравнения
химических реакций, характеризующих свойства
оксидов неметаллов.








 Химия
Химия








