Похожие презентации:
Опыт Резерфорда по рассеянию альфа-частиц
1. Опыт Резерфорда по рассеянию альфа-частиц
ОПЫТ РЕЗЕРФОРДА ПО РАССЕЯНИЮАЛЬФА-ЧАСТИЦ
Белозерова М.Ю.
ЧУОО «Павлодарский высший колледж управления»
2.
Говорил, чтосуществует
предел деления
— атом.
Демокрит
460–370 гг. до н.э.
Считал, что
делимость
вещества
бесконечна.
Аристотель
384–322 гг. до н.э.
3. предложил первую модель атома.
Модель ТомсонаПРЕДЛОЖИЛ
ПЕРВУЮ МОДЕЛЬ
АТОМА.
Модель атома Томсона оказалась в
полном противоречии с опытами по
исследованию распределения
положительного заряда в атоме.
Атомное ядро — тело малых
размеров, в котором
сконцентрированы почти вся масса
и весь положительный заряд атома.
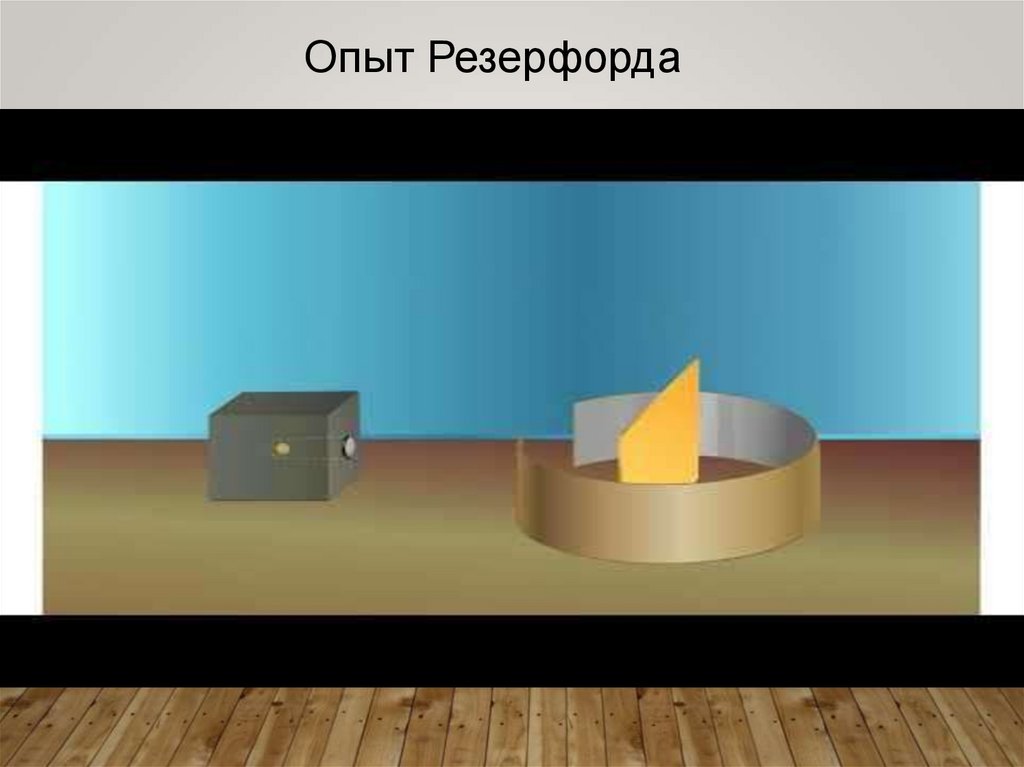
4. Опыт Резерфорда
Резерфорд предложил применитьзондирование атома с помощью α-частиц,
которые возникают при радиоактивном
распаде радия и некоторых других
элементов.
Эрнест Резерфорд
1871–1937 гг.
5.
Опыт Резерфорда6.
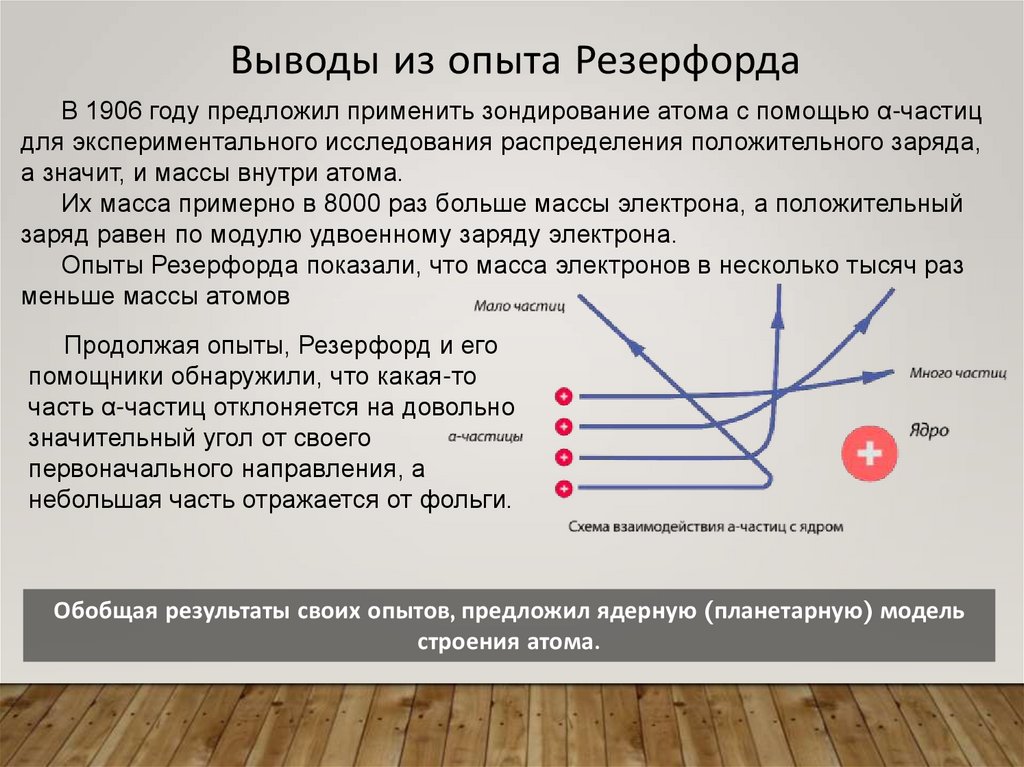
Выводы из опыта РезерфордаВ 1906 году предложил применить зондирование атома с помощью α-частиц
для экспериментального исследования распределения положительного заряда,
а значит, и массы внутри атома.
Их масса примерно в 8000 раз больше массы электрона, а положительный
заряд равен по модулю удвоенному заряду электрона.
Опыты Резерфорда показали, что масса электронов в несколько тысяч раз
меньше массы атомов
Продолжая опыты, Резерфорд и его
помощники обнаружили, что какая-то
часть α-частиц отклоняется на довольно
значительный угол от своего
первоначального направления, а
небольшая часть отражается от фольги.
Обобщая результаты своих опытов, предложил ядерную (планетарную) модель
строения атома.
7.
Модель ТомсонаМодель Резерфорда
8.
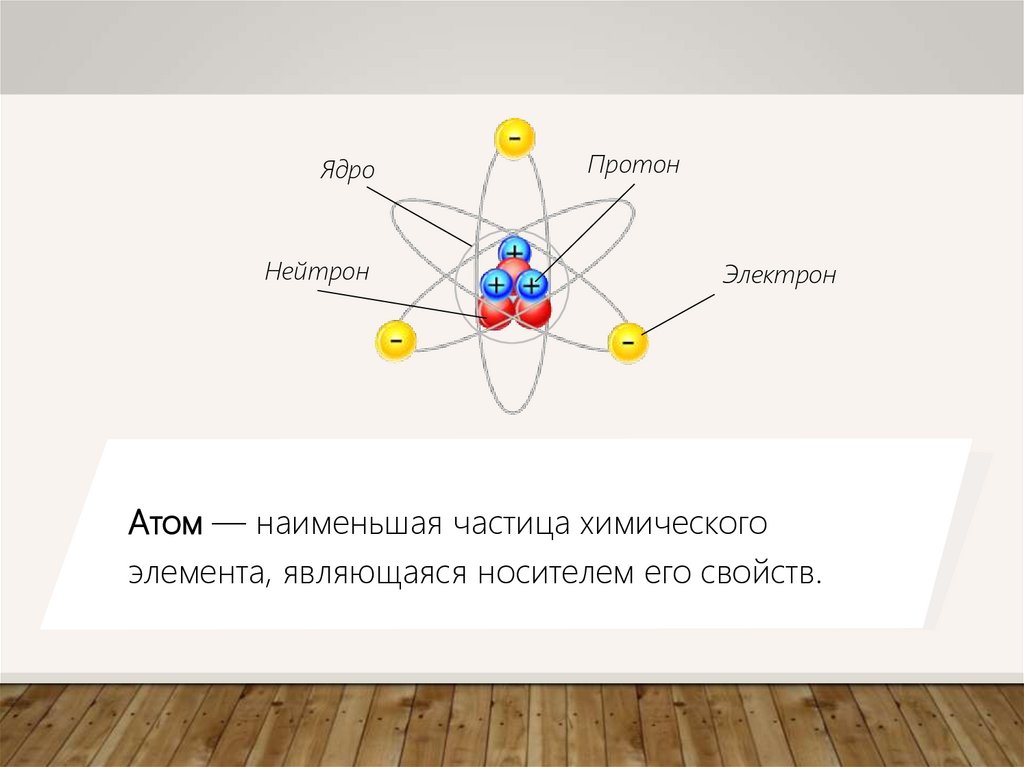
ЯдроНейтрон
Протон
Электрон
Атом — наименьшая частица химического
элемента, являющаяся носителем его свойств.
9.
-+
-19
1,6 ∙ 10 Кл
10.
Np = Ne = Zгде
Np — число протонов
Ne — число электронов
Z
— порядковый номер элемента
A = N p + Nn
где
A — атомная масса
Nn — число нейтронов
11. Состав Атома: = 86 = 86 = 222-86=136
СОСТАВ АТОМА:Ne = 86
Np = 86
Nn = 222-86=136
СОСТАВ ЯДРА:
Np = 86
Nn = 222-86=136
222
86
Rn
12.
Недостатки планетарной модели атомаМодель не согласуется с наблюдаемой
стабильностью атомов.
Модель не объясняет наблюдаемые
на опыте оптические спектры атомов.
Датский физик Нильс Бор в 1913 г. нашёл выход
из затруднительного положения в теории атома.
Создал первую квантовую теорию атома, принял активное
участие в разработке основ квантовой механики. Бор внёс
большой вклад в развитие теории атомного ядра и ядерных
реакций развил теорию деления атомных ядер.









 Физика
Физика








